
Строение атома Нестеров
.pdf
Наиболее простое электронное строение имеет атом водорода. Порядковый номер элемента Н свидетельствует о том, что заряд ядра атома водорода равен +1. Следовательно, в нейтральном атоме водорода имеется один единственный электрон. Он располагается на 1s-орбитали:
электронная формула атома Н – 1s1, схема заселения орбиталей – 1s 

 .
.
Следующий за водородом элемент гелий имеет два электрона в нейтральном атоме. Оба они в соответствии с принципом В.Паули заселяют 1s-орбиталь:
электронная формула Не – 1s2, схема заселения орбиталей – 1s 

 .
.
В атомах Н и Не идет последовательное заселение 1s–орбитали, поэтому их называют 1s-элементами. В атоме гелия завершается заполнение первого энергетического уровня, а сам элемент гелий замыкает первый период периодической системы.
Во втором периоде расположены восемь элементов: возглавляют его два 2s-элемента (Li, Ве), за ними располагаются 2р-элементы (B…Ne) – в этих элементах идет последовательное заселение 2р-орбиталей.
Разберем электронное строение некоторых элементов II-го периода.
• Например, порядковый номер атома бора равен пяти, следовательно Zядра(В) = +5 и в нейтральном атоме бора имеется пять электронов. У атомов II-го периода они располагаются на двух энергетических уровнях. Второй уровень для атома В будет внешним, валентным. Именно орбитали и электроны II-го уровня будут способны участвовать в связывании и другими атомами. На орбиталях II-го уровня в атоме бора имеется три электрона (см. номер группы):
N= 5, Zядра = 5, электронная формула атома В – 1s22s22p1.
•В атоме азота семь электронов, из них пять находятся на орбиталях второго энергетического уровня:
41

N= 7, Zядра = 7, электронная формула атома N – 1s22s22p3.
•В атоме неона десять электронов:
N = 10, Zядра = 10, электронная формула атома Nе – 1s22s22p6.
Схема заселения атомных орбиталей, учитывая их разницу в энергиях, будет выглядеть следующим образом:
Относительная |
|
Относительная |
энергия АО |
или, если вдвое |
энергия АО |
|
|
|
|
увеличить масштаб, |
|
|
чтобы более заметной |
|
|
была разница в энергиях |
|
2p |
2s- и 2p-робиталей: |
|
|
|
|
2s |
|
|
1s
B |
N |
Ne |
Из этих энергетических схем можно сделать несколько выводов:
Самый простой: 1s-орбиталь существенно отличается по энергии от орбиталей II-го энергетического уровня, т.е. 1s-электроны гораздо прочней связаны с ядром соответствующего атома. Поэтому в химических реакциях эти электроны никогда не теряются в пользу другого атома (при образовании ионных связей) и даже не обобществляются с другими атомами (при образовании ковалентных связей). 1s-орбиталь (1s-электроны) не являются валентными, соответственно, подробно анализировать распределение электронов на таких орбиталях не требуется. В дальнейшем схематично
будет разбираться заселение электронами только высоколежащих и сопоставимых по энергии валентных орбиталей!
По периоду в соответствии с ростом заряда ядра энергия валентных атомных орбиталей постепенно понижается. Это согласуется с качественными рассуждениями о том, что растет притяжение электронов к
42

ядру. Более строго этот вывод можно обосновать с использованием формулы (1.27) на стр.25 (сомножитель Ео < 0, см. формулу (1.15) на стр.15). Сопоставление энергии валентных АО элементов одного периода будет полезным, когда речь пойдет об изменении радиусов, электроотрицательности атомов.
Тот факт, что 2s-орбитали понижают свою энергию чуть сильней, чем 2р-орбитали объясняется большей проникающей способностью s-орбиталей, они "лучше чувствуют" растущий заряд ядра. Это несколько увеличивает разницу в энергиях между 2s- и 2р-орбиталями, что постепенно затрудняет возбуждение атомов.3
Рассмотрим кратко валентные возможности обсуждаемых атомов. Схема распределения электронов на валентных орбиталях:
B |
B* |
N |
N* |
Ne |
основное |
возбужденное |
основное |
возбужденное |
состояние атома В |
состояние атома N |
||
Атом бора очень легко переходит в возбужденное состояние и практически во всех своих ковалентных соединениях использует для связывания с атомами-партнерами все три валентных электрона. Более того, за счет имеющейся пустой АО атом В может выступать акцептором электронных пар и поэтому, как мы убедимся в дальнейшем, особенно хорошо связывается с атомами-донорами (например, с атомами N, O, галогенами). Самым простым подтверждением этих слов является высокая стабильность нитрида BN, оксида B2O3 и галогенидов (особенно, фторида BF3) бора, а
также легкость образования ионов [В(ОН)4]–, [BF4]–, в которых атом бора четырехвалентен:
3 Растущая разница между 2s- и 2р-орбиталями скажется на энергетических схемах двухатомных молекул (O2, N2, CO и т.п.) при анализе их строения с точки зрения метода молекулярных орбиталей (ММО).
43

BF3 + F– |
[BF4]– 4 |
Атом азота, наоборот, с атомами-донорами связывается плохо (кислородные соединения, галогениды азота малоустойчивы). В то же время атом N во многих соединениях также четырехковалентен (самые известные примеры: NH4+, HNO3). Причем в ионе аммония четвертая связь получена по донорноакцепторному механизму (за счет донорных свойств самого атома азота):
NH3 + H+  [NH4]+,
[NH4]+,
а в молекуле азотной кислоты четвертая связь образована атомом N* за счет 2р-орбитали с электронной парой5. Позднее мы выясним, почему донорные способности атома азота достаточно хорошо реализуются при связывании с H+ или атомами Si и хуже – при связывании с другими элементами III-го периода.
Атом неона химически ни с какими другими атомами не связывается. Казалось бы, атом Ne – потенциальный донор электронных пар, но, чтобы эти способности реализовать атому-донору, как правило, требуется иметь отрицательный заряд. А для этого необходимо иметь полярные связи с каким-либо партнером, т.е. чтобы установилась связь по донорноакцепторному механизму, уже должны быть образованы связи за счет орбиталей с неспаренными электронами. В основном состоянии атома неона их нет. Для возбуждения требуется перевод электронов на орбитали другого (III-го) энергетического уровня. Энергия 3s-орбитали слишком велика (см. рис.1.10) и в химических реакциях такие затраты никогда не окупаются.
Рассмотрим электронное строение элементов III-го периода. Валентным для них является третий энергетический уровень. На третьем энергетическом уровне вначале будет заполняться электронами 3s-орбиталь:
4Подробно логику данной реакции обсудим в разделе модуле №5.
5Речь идет о трехцентровой πр-р-р–связи. Разберем подробно в разделе "Теория химической связи".
44
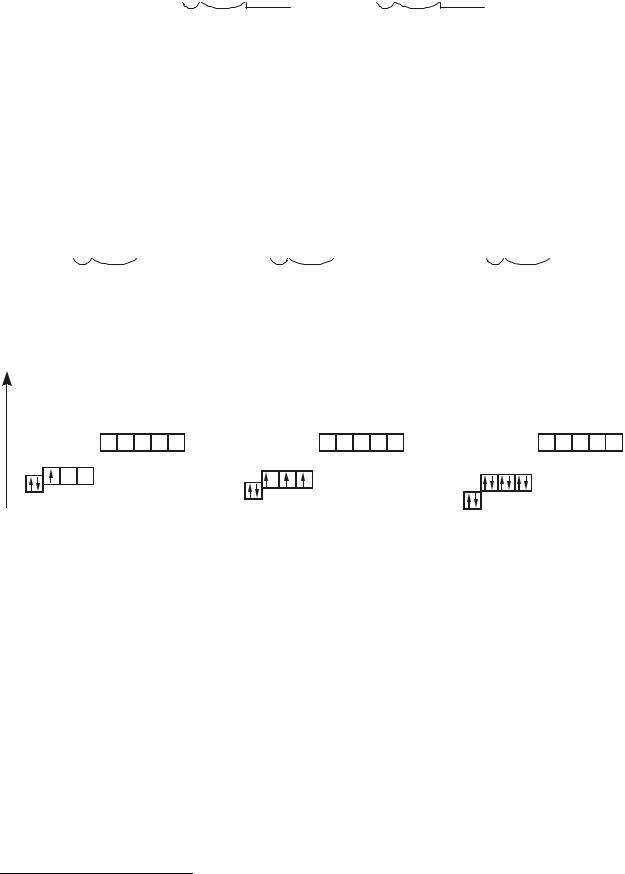
Na 1s22s22p63s13p0 , Mg 1s22s22p63s23p0.
Наличие пустых 3р-, а, тем более 3d-орбиталей в атоме натрия не имеет никакого существенного значения, поэтому их часто вообще не указывают, также, как и 3d-орбитали атома магния.6 Роль орбиталей усиливается в
химии р-элементов (Al…Cl, Ar). |
|
|
|
|
|
||
|
Электронные формулы некоторых атомов: |
|
|
||||
Al |
P |
Ar |
|||||
1s22s22p63s23p13d0 |
1s22s22p63s23p33d0 |
1s22s22p63s23p63d0 |
|||||
|
|
|
|
|
|
|
|
Соотношение в энергиях валентных орбиталей и схемы распределения электронов на них:
|
Al |
P |
Ar |
|
3d |
3d |
3d |
3s |
3p |
3p |
3p |
|
|||
|
|
3s |
3s |
|
|
|
Из анализа приведенных схем нетрудно понять, что атом алюминия легче, чем следующие за ним р-элементы переходит в возбужденное состояние. Более того, в своих соединениях с неметаллическими элементами алюминий никогда не остается трехковалентным: будучи потенциальным акцептором электронных пар, Al* обязательно использует в дополнительном связывании остающуюся пустой 3р-орбиталь, а при связывании с сильно электроотрицательными атомами – еще и 3d-орбитали. Например, галогениды AlГ3 состоят вовсе не из четырехатомных молекул. Иодид и бромид алюминия, строго говоря, имеют состав Al2Г6 (каждый атом алюминия связан с четырьмя атомами галогена):
6 В дальнейшем мы убедимся, что для этих элементов, особенно для Na, характерно образование металлических и ионных связей. В "первом приближении" можно считать, что в этих формах взаимодействия орбитали практически не участвуют. Важно знать лишь число валентных электронов.
45
|
|
|
|
|
|
|
|
|
|
Br |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Хлорид, фторид, а также кислородные соединения (оксид, |
Br |
|
Al |
Br |
|
||||||||
|
|
|
|
||||||||||
гидроксид) |
алюминия |
являются |
ионно-ковалентными |
|
Br |
.. |
|
||||||
|
|
|
|
|
|
|
|
. |
|
|
. |
|
|
полимерами, в структуре которых каждый атом Al связан с |
|
.. |
|
.Br |
|||||||||
шестью партнерами. Но наиболее простыми примерами |
|
|
|
Br |
|
|
|||||||
частиц, в составе которых атом алюминия поддерживает |
|
|
|
|
|
||||||||
|
|
|
|
|
|
||||||||
связь с |
шестью другими атомами, |
являются |
островные ионы |
3– |
, |
||||||||
[AlF6] |
|||||||||||||
[Al(OH)6] |
3– |
, |
3+ |
Как видно, Al |
3+ |
является |
более |
|
активным |
||||
|
[Al(OH2)6] . |
|
|
||||||||||
акцептором электронных пар, чем атом бора. Используя свои 3d–орбитали, он способен связываться с большим числом атомов-доноров.
Обсудим проблему использования 3d–орбиталей в связывании на примере более знакомых элементов – азота и фосфора.
N |
P |
3d |
2p |
3s |
3p |
2s |
|
|
|
|
Сравнив однотипные соединения данных элементов, можно сделать вывод, что 3d–орбитали атома фосфора активно используются в процессах возбуждения и донорно-акцепторном взаимодействии в тех соединениях, где фосфор связан с более электроотрицательными элементами и имеет положительные степени окисления. Это косвенно свидетельствует о том, в этих случаях 3d–орбитали становятся энергетически более доступными, более выгодными, т.е. понижают свою энергию.7 Для примера кратко сравним структуру и стабильность соединений азота и фосфора в степенях окисления –III и +V:
7 В дальнейшем это предположение будет подкреплено при анализе орбитальных энергий и их зависимости от эффектов экранирования и проникновения.
46

|
|
–III |
|
|
|
|
|
+V |
|||||
|
|
|
|
|
|
|
|
|
|
|
|||
Ковалентные соединения |
|
Ковалентные галогениды |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
PF5, PCl5, PBr5 |
||
NH3, NH4+ |
|
|
|
|
PH3, PH4+ |
NГ5 |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
[PF6]–, [PCl6]– |
|
|
|
|
|
|
|
|
|
|
|
|||
Устроены одинаково, но из-за |
|
|
|
||||||||||
большего радиуса атома |
|
|
Не смотря на большую длину |
||||||||||
фосфора PH3, PH4+ гораздо |
|
|
связи, получены PF5, PCl5, |
||||||||||
менее стабильны: |
+ |
|
|
PBr5. Стабильность падает из-за |
|||||||||
|
|
|
|
|
|
Н |
|
|
Не |
|
увеличения радиуса галогена, |
||
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
известны |
но фторид и хлорид образуются |
|
Э |
|
|
|
|
|
Э |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
в условиях горения фосфора в |
|||
.. |
|
|
|
|
|
Н Н |
|
|
|
|
|
||
Н Н |
Н |
|
|
|
|
Н |
. |
|
|
атмосфере соответствующего |
|||
|
|
|
|
|
|
|
|
|
|
|
|
||
Соединение состава РН5 не |
|
|
галогена. |
||||||||||
|
известно. |
|
|
|
|
|
|
||||||
|
|
|
|
|
|||||||||
Ионные соединения |
|
Ковалентные кислородные соединения |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Mg3N2 |
|
|
|
|
|
|
Mg3P2 |
N2O5, |
|
(P2O5)n, Р4О10 |
|||
|
|
|
|
|
|
HNO3 |
|
(НРО3)n, Н3РО4 и другие |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Различаются и состав, и структура |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
веществ. Например: |
Устроены одинаково, фосфиды менее стабильны, чем нитриды.
Не смотря на большую длину связи, соединения фосфора (+V) более разнообразны и более стабильны.
У следующих за фосфором элементов (S и Cl) 3d–орбитали также используются в дополнительном взаимодействии (например, в кислородных соединениях). Однако акцепторные способности постепенно уменьшаются из-за растущей электроотрицательности элементов. Замыкающий период аргон, как He и Ne является инертным элементом, в химическом связывании не участвует, т.к. в атоме отсутствуют неспаренные электроны.
47

Таким образом, электронное строение внешних уровней элементов II-го и III-го периодов в основном состоянии совпадает. Однако при связывании с более электроотрицательными элементами валентные возможности атомов III-го периода увеличиваются благодаря наличию пустых 3d–орбиталей.
Следом за аргоном располагается элемент калий. Поскольку последний 19-тый электрон этого атома располагается на 4s-орбитали, калий возглавляет IV-й период:
К 1s22s22p63s23p63d04s1, Са 1s22s22p63s23p63d04s2.
По той причине, что 3d–орбитали заселяются электронами у элементов IV-го периода, отличает его от двух предыдущих. Четвертый и последующие периоды называют большими. Начинаются и завершаются все большие периоды, как и периоды типических элементов (II-ой и III-й) двумя ns– и
шестью np–элементами. Но между ними вклиниваются, так называемые, переходные элементы, у которых идет заполнение или (n-1)d– (в IV-м и V-м периодах):
K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr
4s- |
3d-элементы |
4р-элементы |
элементы |
|
|
Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te J Xe |
||
5s- |
4d-элементы |
5р-элементы |
элементы |
|
, |
или (n-1)d– и (n-2)f–орбиталей (в VI-м и VII-м периодах; здесь n – главное квантовое число внешних электронов, совпадающее с номером периода). Такая структура больших периодов согласуется с правилами В.Клечковского, с энергиями соответствующих АО. В коротком варианте Периодической системы элементы длинных периодов располагают в двух рядах. В итоге в вертикальных столбцах (группах) оказываются элементы разных типов.
48

Поэтому каждая вертикальная группа элементов в свою очередь подразделяется на две подгруппы. Главные подгруппы объединяют s– или р–элементы с одинаковым электронным строением внешнего энергетического уровня. Побочные подгруппы объединяют только d–элементы. Распределение электронов на (n-1)d– и ns–орбиталях этих атомов зачастую различается. Поскольку энергии этих АО довольно близки (см. рис.2.10 на стр.29), порой наблюдаются электронные проскоки с ns– на (n-1)d–орбитали. В коротком варианте таблицы f–элементы вынесены в отдельные строки: лантаноиды (4f–элементы) и актиноиды (5f–элементы).
Рассмотрим электронное строение некоторых элементов d– (Sc, Cr, Fe, Cu) и р–элементов (Ga, As, Kr) IV-го периода.
Sc является первым 3d–элементом: 1s22s22p63s23p63d14s24p0.
Волнистыми линиями выделены сопоставимые по энергии валентные орбитали атома скандия. В атомах титана и ванадия идет последовательное увеличение числа 3d–электронов, а в атоме хрома наблюдается электронный проскок и формируется полузаполненный 3d–подуровень:
Cr 1s22s22p63s23p63d54s14p0.
В атоме марганца 3d5–конфигурация сохраняется, а дополнительный электрон заселяет 4s–орбиталь. В атомах Fe, Co и Ni опять возобновляется заполнение 3d–подуровня, причем полностью завершенным он оказывается в атоме меди (вновь происходит "провал" электрона с 4s–орбитали на 3d–подуровень):
Fe 1s22s22p63s23p63d64s24p0 |
Cu 1s22s22p63s23p63d104s14p0. |
|||
|
|
|
|
|
Соотношение в энергиях валентных орбиталей и схемы распределения электронов на них:
49

|
Cr |
|
|
Fe |
|
|
Cu |
|
3d |
4s |
4p |
3d |
4s |
4p |
|
4s |
4p |
|
3d |
|||||||
|
|
|
|
|
|
С ростом заряда ядра энергия всех валентных АО уменьшается. Особенно быстро стабилизируются 3d–орбитали, постепенно они становятся самыми "низколежащими". Как отмечалось ранее на примере р-элементов, дополнительно энергия 3d–орбиталей понижается при ионизации атомов. Поэтому в ионах 3d–металлов остающиеся валентные электроны расположены на 3d–орбиталях:
Fe …3d64s24p0 |
|
Fe2+ …3d64s04p0 |
Fe3+ …3d54s04p0 |
|||||
|
Fe |
|
|
Fe2+ |
|
|
Fe3+ |
|
3d |
4s |
4p |
3d |
4s |
4p |
3d |
4s |
4p |
|
|
|
||||||
|
|
|
|
|||||
Постепенная стабилизация 3d–орбиталей делает их практически невалентными уже для Zn и, тем более, для последующих 4р-элементов. Более того, в положительных степенях окисления 3d–орбитали дополнительно отдаляются по энергии от 4s– и 4р-орбиталей, а вот "высоколежащие" 4d–орбитали, наоборот, приближаются к валентным АО и могут быть использованы для возбуждения атома, и в донорно-акцепторном взаимодействии:
Ga:[Ne]3s23p63d104s24p14d0, As:[Ne]3s23p63d104s24p34d0, Kr: [Ne]3s23p63d104s24p64d0
50
