
Строение атома Нестеров
.pdfВ рамках самоподготовки по модулю 2 предлагается обсудить следующие вопросы:
1. Опишите изменения происходящие с электронными оболочками ионов при сближении двух противоположно заряженных частиц.
2.Каков порядок напряжённости электрического поля вблизи однозарядного иона?
3.Дайте определение понятию «деформируемость», сформулируйте условия определения её относительного значения.
4.Как изменяется деформируемость атомов от гелия до радона? Почему?
5.Какая величина называется «поляризующим действием» (ПД) иона, от каких факторов она зависит?
6.Как и почему изменяется (ПД) катионов элементов главной подгруппы второй группы?
7.Расположите анионы типа ЭО32- (Э= C, N, S) по мере роста их ПД и дайте объяснение предложенному варианту.
8.Объясните явление, которое называется контрполяризующим действием.
9.Когда и почему происходит аномально высокая деформация электронных оболочек взаимодействующих ионов?
10.Как рост ПД катиона сказывается на его КЧ в кристаллической решётке?
11.Ионы Ме2+ у железа и цинка имеют близкие значения ионных радиусов. Почему их оксиды типа МеО имеют различное строение (для каждого из оксидов укажите тип кристаллической решётки)?
12.Как и почему изменяются температуры плавления галогенидов элементов главных подгрупп I и II групп?
13.Как изменение ПД влияет на энергию кристаллической решётки? 14.Как по значению ПД катиона определить тип и степень диссоциации
соединений типа R-O-H?
141
15.Как используя представления о значении ПД катиона и аниона предсказать возможность гидролиза данной частицы и оценить степень её гидролиза?
16.Почему с ростом основности кислоты степень её диссоциации снижается?
17.Почему литий возглавляет ряд напряжений?
18.Как и почему изменяется стабильность форм при переходе от кислоты к её соли?
19.Как и почему изменяются окислительные свойства перманганатионов при уменьшении рН раствора?
20.Укажите на какие вопросы способна ответить теория поляризации и каковы её недостатки.
21.Укажите знаки изменения энтропии и энтальпии при ассоциации молекул.
22.Почему реальные газовые системы не могут быть описаны в рамках уравнения идеального газа?
23.Между молекулами с каким типом химической связи возможен ориентационный тип взаимодействия, от каких величин и параметров состояния системы он зависит?
24.Опишите механизм индукционного взаимодействия. Между молекулами каких типов он возможен, какие факторы предопределяют его значения?
25.Какое взаимодействие называется дисперсионным? От каких факторов зависит его вклад в общую энергию межмолекулярного взаимодействия?
26.Какие свойства молекулярных веществ можно предсказывать на основе представлений о межмолекулярном взаимодействии?
142
27.Сравните суммарную энергию трёх типов межмолекулярного взаимодействия для HI и H2O (табл.1.6). Почему температура кипения воды выше, чем у HI?
28.Почему СО имеет температуру кипения практически такую же как азот?
29.Почему изменение температур кипения и плавления в ряду галогенводородов носит экстремальный характер?
30.Расположите оксиды азота в ряд по мере увеличения их температур плавления и дайте объяснение предлагаемому варианту.
Проектное задание Выявите основные принципы построения энергетических диаграмм
образования ионной связи, установите корреляцию между составом, строением и свойствами веществ с преимущественно ионным характером связи, укажите фазы, которые успешно могут быть описаны в рамках изученной теории, отметьте её недостатки. Рассмотрите свойства галогенидов, оксидов и солей кислородных кислот с точки зрения теории поляризации, установите зависимости между свойствами газообразных веществ и энергией межмолекулярного взаимодействия.
ТЕСТ РУБЕЖНОГО КОНТРОЛЯ №2
1.В основе теории ионной связи лежит представление |
|
|
|
|||
1. |
О числе электронов на валентном |
2. |
О различие в радиусах атомов |
|
||
|
уровне |
|
|
|
|
|
3. |
О стабильности электронной оболочки |
4. |
О |
перекрывании |
электронных |
|
|
типа инертного (благородного) газа |
|
орбиталей. |
|
|
|
2. |
Минимум энергии в ионной системе достигается |
|
|
|
|
|
1. |
В результате действия сил отталкивания |
2. |
В результате действия сил притяжения |
|||
|
и притяжения |
|
|
|
|
|
3. |
В результате действия сил отталкивания |
4. |
В |
результате |
действия |
сил |
|
|
|
межэлектронного взаимодействия |
|
||
3. |
Ионные молекулы могут существовать только |
|
|
|
|
|
143

1. |
|
В жидкой фазе |
2. |
|
В твёрдой фазе |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
3. |
|
В газовой фазе |
4. |
|
В аморфной фазе |
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
4. |
Структура ионных кристаллических фаз определяется |
|
|
|
|||||||
1. |
|
Зарядом иона |
2. |
|
Отношением ионных радиусов |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
3. |
|
Электроотрицательностью исходного |
4. |
|
Потенциалом |
ионизации |
исходного |
||||
|
|
атома |
|
|
|
атома |
|
|
|
||
5. |
Для ионных веществ не характерно такое свойство, как |
|
|
|
|||||||
1. |
|
Высокая температура плавления |
2. |
|
Прозрачность |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
3. |
|
Летучесть |
4. |
|
Высокая твёрдость |
|
|
||||
|
|
|
|
|
|
|
|
|
|||
6. |
|
Теория ионной связи сталкивается с трудностями при описании стркутуры и свойств |
|||||||||
веществ, в состав которых катионы с |
|
|
|
|
|
|
|
|
|||
1. |
|
Низким зарядом |
2. |
|
8ē оболочкой |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
||
3. |
|
18ē и (18+2)ē оболочками |
4. |
|
Большим ионным радиусом |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
7. |
|
Деформируемость ионов не зависит от их |
|
|
|
|
Радиуса |
|
|
|
|
1. |
|
|
Электронного строения |
|
|
2. |
|
|
|
|
|
3. |
|
|
Заряда |
|
|
4. |
|
Потенциала |
ионизации |
исходного |
|
|
|
|
|
|
|
|
|
атома |
|
|
|
8. |
|
Поляризующим действием (ПД)не обладают |
|
|
|
Катионы |
|
|
|
||
1. |
|
|
Атомы |
|
|
2. |
|
|
|
|
|
3. |
|
|
Анионы |
|
|
4. |
|
Протоны |
|
|
|
9. |
ПД |
катионов не зависит от их |
|
|
|
|
Электронного строения |
|
|||
1. |
|
|
Заряда |
|
|
2. |
|
|
|||
3. |
|
|
Радиуса |
|
|
4. |
|
Энергии сродства |
к |
электрону |
|
|
|
|
|
|
|
|
|
исходного атома |
|
|
|
9. |
ПД катионов близкого радиуса и одинакового заряда возрастает в соответствии с |
||||||||||
изменением электронной в ряду |
|
|
|
|
8ē, 18ē, (18 +2)ē, 2ē |
|
|
||||
1. |
|
|
2ē, 8ē,18ē,(18 +2)ē |
|
|
2. |
|
|
|
||
3. |
|
|
18ē, (18 +2)ē, 2ē, 8ē |
|
|
4. |
|
18ē, 8ē (18 +2)ē, 2ē |
|
|
|
10. С |
помощью теории поляризации невозможно |
прогнозировать |
|
|
|
||||||
1. |
|
|
Кислотноосновные свойства веществ |
|
|
2. |
|
Координационное |
число |
ионов в |
|
|
|
|
|
|
|
|
|
кристаллах |
|
|
|
3.Температуру плавления молекулярных 4. Окислительно-восстановительные
веществ |
свойства фаз. |
11.Межмолекулярное взаимодействие
1.Понижает энтальпию и энтропию 2. Понижает энтальпию и повышает
системы |
энтропию системы |
3.Повышает энтальпию и энтропию 4. Повышает энтальпию и понижает
|
системы |
|
|
энтропию системы |
12. Ориентационное взаимодействие возможно только |
между |
|||
1. |
Неполярными молекулами |
2. |
Полярными молекулами |
|
3. |
Радикалами |
4. |
Кластерами |
|
13. |
Между молекулами азота наблюдается |
|
|
Индукционное взаимодействие |
1. |
Ориентационное взаимодействие |
2. |
||
3. |
Дисперсионное взаимодействие |
4. |
Все типы перечисленные в ответах |
|
|
|
|
|
1,2,3. |
14.Почему СО имеет очень низкую температуру кипения? |
||||
1. |
Молекула СО имеет маленькую массу |
|
2. |
Молекула СО неполярна |
144

3. |
В молекуле СО между атомами тройная 4. |
Молекула СО полярна |
|
связь |
|
15. Почему температура плавления простых веществ галогенов увеличивается в подгруппе сверху вниз?
1. |
В связи с ростом массы |
2. |
В связи с энергии индукционного |
|
|
|
взаимодействия |
3.В связи с ростом деформируемости 4. В связи с ростом заряда ядра молекул
Задания 1,4,6,9,13 и 15 оцениваются в 2 балла Задания 2,3,7,10,11 и 14 оцениваются в 3 балла Задания 5,8 и 12 оцениваются в 4 балла.
Оценка при выполнении теста: 20 – 28 баллов – удовлетворительно 29 – 36 баллов – хорошо 37 – 42 балла - отлично.
Список литературы:
1.Карапетьянц М.Х., Дракин С.И. Строение вещества, М., «Высшая школа»,1970, 180 с.
2.Коттон Ф., Уилкинсон Дж., Современная неорганическая химия, т.1,
М., «Мир», 1968, 225 с.
3.Дей К., Селбин Д., Теоретическая неорганическая химия, М., «Химия», 1971, 416 с.
4.Химия и периодическая таблица, под ред. К.Сайто, М., «Мир», 1982,
320с.
5.О.С. Зайцев, Общая химия, М., «Высшая школа», 1983, 248 с.
6.А. Барнард, Теоретические основы неорганической химии, М.,
«Мир», 1968, 362 с.
7. Краснов К.С., Молекулы и химическая связь, М., «Высшая школа», 1977, 280 с.
8. Ахметов Н.С., Общая и неорганическая химия, М., «Высшая школа»,1981, 679 с.
145
9.Н.Н. Рунов, Строение атомов и молекул, М.,«Просвещение»,1987,143
с.
10.Я.А.Угай «Общая химия» М., «Высшая школа», 1977, 408 с.
11.Э.Картмел, Г.В.А.Фоулс «Валентность и строение молекул», М., «Химия», 1979, 360 с.
Модуль №3
Теории ковалентной связи
Комплексная цель Знакомство с ранними представлениями о ковалентной связи, овладение
навыками предсказания структур молекул на основе метода отталкивания локализованных электронных пар (МОЛЭП), а также описания молекул в рамках кавантовомеханических теорий МВС и ММО ЛКАО и твёрдых фаз в рамках электростатических и квантовомеханических представлений.
Содержание
3.1. Теория Льюиса и метод ОЛЭП.
Теория предложенная Косселем удовлетворительно описывает химическую связь только в фазах образованных атомами элементов значительно отличающихся по своей электроотрицательности, т.е. ограниченное число химических объектов. Другой подход к проблеме интерпретации понятия «химическая связь» развивался параллельно с формированием представлений о ионной связи. В 1907 Н.А. Морозов и в 1916-1918 годах Д.Н.Льюис выдвинули гипотезу, согласно которой
146

образование химической связи обусловлено образованием в процессе взаимодействия атомов общей электронной пары, локализующейся в межядерном пространстве. На образование указанной пары каждый из соединяющихся атомов поставляет по одному электрону валентного уровня, электронная пара взаимодействует с ядрами обоих этих атомов в результате чего в системе возникают как силы притяжения так и отталкивания (рис.1.7). Наличие двух типов взаимодействий в системе должно в конечном итоге приводить к достижению системой состояния равновесия, характеризующегося локальным минимумом энергии.
Рис.1.3. Схема сил электростатического притяжения и отталкивания в молекуле Н2.
При этом стабильность рассматриваемой системы будет предопределяться соотношением сил отталкивания и притяжения, так же как в случае формирования ионной связи (рис.1.3). Каждую общую электронную пару Льюис предложил обозначать точками или одной чертой c указанием числа неподелённых электронных пар. Это было необходимо для продтверждения основной гипотезы описанных выше представлений о стремлении каждого из атомов к достройке внешней оболочки до 8 или 2-х электронной:
147
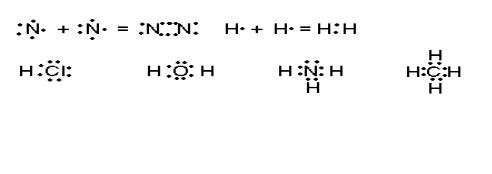
Рис.2.3. Изображение ковалентной связи в молекулах по Льюису.
Связь, в основе образования которой лежит обобществление валентных электронов, Льюис назвал ковалентной. Пары обеспечивающие химическую связь называются связующими, а локализованные у исходных атомов – неподелёнными, например в молекуле Н2О (рис.2.3) у атома кислорода две связующие электронные пары и две неподелённые. Принимая во внимание, что ковалентная связь может возникать как между атомами одного элемента, так и между атомами с различной электроотрицательностью, было высказано предположение, что в первом случае общая электронная пара будет располагаться в центре тяжести ядер соединяющихся атомов, а во-втором – смещаться в сторону более электроотрицательного атома. Связь первого типа была названа неполярной, например. молекулы H2. N2, а второго типа – полярной ковалентной (молекулы HCI, H2O, NH3, CH4 - рис.2.3).
Несмотря на то, что в основе теорий и Косселя и Льюиса лежат электростатические представления, характер постулируемой в них локализации электронной плотности различен, что приводит к выводам о различных свойствах формирующихся в системах связей. Ионы имеют сферическую симметрию окружающего их электрического поля, способного воздействовать на заряженные частицы в любом направлении. Поэтому их координационные числа зависят, преимущественно, от относительных размеров образующих фазу ионов и, следовательно, могут варьироваться в некоторых пределах (например, к.ч. иона хлора в хлориде натрия и цезия - см. модуль 2). Указанные факторы предопределяют ненаправленность и
148
ненасыщаемость ионной связи. Ковалентные же связи локализованы между отдельными, соединёнными между собой атомами и имеют строгую направленность в пространстве, т.е в отличии от ионных они насыщаемы, а углы между ними (валентные углы по Льюису) имеют строго определённые значения при фиксированных параметрах системы.
Необходимо отметить, что уже на первом этапе развития представлений о ковалентной связи её авторы столкнулись со значительными трудностями в вопросе предсказания состава молекул различных элементов. Как отмечалось выше, в теории Льюиса внимание концентрируется на окружении каждого атома октетом электронов (или наличием у атома водорода электронной пары). Однако имеется большое количество молекул, радикалов и молекулярных ионов, для которых это правило не выполняется и существование которых данной теорией не прогнозируется. Такие частицы могут быть условно разделены на три типа.
Кпервой группе относятся молекулы с нечётной суммой электронов в системе, например, NO, NO2, CIO2 и т.д.. В молекулах данного типа число электронов, окружающих атомы азота и хлора нечётное и по определению не может равняться восьми.
Второй возможный случай нарушения правила октета характерен для молекул, в состав которых входят элементы главных и побочных подгрупп I, II и III групп. Например, в галогенидах бора общее число электронных пар окружающих атом бора равно трём, а в галогенидах бериллия и лития (образующих газообразную фазу этих веществ) число таких пар – две и одна, соответственно.
Ктретьему типу веществ, не подчиняющихся правилу октета, относятся большинство молекулы, в состав которых входят элементы V, VI, VII и VIII групп. Например, в молекулах галогенидов фосфора состава РГ5 и в Р2О5 число связующих электронных пар, окружающих атом фосфора, равно пяти, в оксидах серы SO2 и SO3 – общее число пар вокруг атомов серы 5 и 6,
149

соответственно, в SF6 – 6, а в CI2O7 окружение атома хлора – 7 связующих электронных пар, в RеO4 и XеO4 - 8 и т.д..
Приведённые примеры показывают, что классическая теория Льюиса, хотя и является существенным шагом вперёд по сравнению концепцией ионной связи, обладает низкой предсказательной способностью в вопросах о составе молекул элементов, большинства подгрупп Периодической системы.
Больших успехов представления о локализованной между ядрами электронной плотности достигли в интерпретации строения молекул. Простой метод определения геометрической формы молекулы был предложен Гиллеспи. В основе этого метода лежит модель отталкивания локализованных электронных пар (МОЛЭП). Модель предполагает, что связующие и неподелённые электронные пары, окружающие центральный атом, для минимизации энергии отталкивания удаляются друг от друга на максимально возможное расстояния, что предопределяет оптимальное (с точки зрения энергии систем) значения углов связей (при фиксированном числе указанных пар).
Рис.3.3. Расположение связующих электронных пар в пространстве вокруг центрального атома А при условии отсутствия у этого атома неподелённых электронных пар валентного уровня. Число связующих пар: а) две, б) три, в) четыре, г) пять, д) шесть, е) семь.
150
