
Строение атома Нестеров
.pdfФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
«ЮЖНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ»
А. А. НЕСТЕРОВ, Э.А.БИКЯШЕВ
ТЕОРИЯ ХИМИЧЕСКОГО СТРОЕНИЯ И СВОЙСТВА ВЕЩЕСТВ
(учебник)
Ростов-на-Дону
2008
1
Рецензенты:
Заведующий кафедрой химии Донского государственного технического университета, д.т.н., профессор Кужаров А.С.
Заведующий кафедрой физической и коллоидной химии ЮФУ, д.х.н., профессо, Коган В.А.
Нестеров А.А.,Бикяшев Э.А..
Теория химического строения и свойства веществ: Учебник. – Ростов-на-
Дону, 2008. 120 с.
АННОТАЦИЯ
Новые образовательные технологии, в том числе, кредитно-модульная, модульно-квалиметрическая требуют совершенствования изложения материала учебных курсов и иных подходов к их структурированию. В связи с этим возникает необходимость создания учебников нового поколения, в которых, наряду с изложением фактического материала, формулируются задачи, связанные с освоением различных модулей, обосновывается необходимость каждого из них в процессе целостного освоения курса, формулируется перечень навыков (компетенций), которые они должны получить в процессе обучения.
Особенностью представленного учебника является впервые предпринятая попытка изложения материала квантовой химии без привлечения сложного математического аппарата. Традиционная форма в нем заменена на рассмотрение основных положений теорий с помощью многочисленных иллюстраций, дающих возможность визуально представить себе изменение состояния атомных и молекулярных систем. Указанный подход связан с тем, что учебник преимущественно предназначен для студентов первых курсов специальностей "Химия", "Химия, физика, механика материалов", а также студентов нехимических специальностей, не имеющих достаточной подготовки в области высшей математики. Несмотря на указанный, несколько упрощенный подход, учебник в полной мере отвечает программам основных и элективных курсов: "Строение атома", "Химическая связь", "Введение в теории строения атома и химической связи", а также разделов курсов "Неорганическая химия" и "Общая химия".
2
Введение
Курс «Ведение в теории строения атома и химической связи» имеет цель (наряду с курсом «Общая химия») подготовить студентов к восприятию на современном уровне материала неорганической и органической химии. Необходимость такой последовательности при изучении химической части программы подготовки бакалавров по направлению «Химия, физика и механика материалов» вытекает из предмета химии, заключающегося в изучении веществ и их превращений. В свою очередь, свойства вещества предопределяются их атомным составом и строением, а изменение состава или строения представляет собой сущность химического превращения. В связи с этим понимание изменений в системе происходящих в процессе и по завершении химических реакций невозможно без знаний основ теорий строения атома и химической связи.
Как известно, число описанных в настоящее время соединений приближается к пяти миллионам, а число химических реакций, которые теоретически могут протекать между этими веществами, оценивается величиной порядка 1040. Поэтому для приобретения навыков, позволяющих ориентироваться в таком объёме химической информации, необходимо знание общих закономерностей протекания химических процессов и факторов, с помощью которых этими процессами можно управлять и оценивать возможность их осуществления при определённых (или заданных) параметрах системы. Одной из таких теорий является химическая термодинамика, которая позволяет определить направление самопроизвольного протекания химической реакции, если известны термодинамические данные для всех компонентов рассматриваемой системы. Однако для многих известных веществ ∆Go298, ∆Ho298, So298, теплоёмкости и т.д. ещё экспериментально не определены, но они могут быть с высокой точностью оценены, если известно строение молекул или кристаллов реагентов, а также, если исследователю известна связь между термодинамическими и структурными характеристиками веществ. Также
3
можно отметить, что статистическая термодинамика позволяет рассчитывать равновесные концентрации веществ по молекулярным постоянным, значения которых, в свою очередь, могут быть получены опытным или расчётным путём. В последнем случае необходимо знание законов описывающих состояние электронов в атомах, молекулах, кластерах и активных комплексах, а также строение принимающих участие в реакциях частиц. Такие же расчёты можно провести в случае процессов с участием твёрдых фаз, при этом в ряде случаев для таких реакций расчёт является единственным путем, позволяющим оценить их термодинамику.
Умение вычислить скорость процесса и научиться ею управлять не менее важно, чем определить направление протекания реакции. Для определения скорости реакции необходимо иметь представления о ёе элементарных актах, в процессе которых происходит разрушение одних и возникновение других химических связей, т.е. меняется состав и структура участвующих во взаимодействии частиц. Следовательно, без знаний теорий строения вещества и химической связи невозможно понять механизм химической реакции и прогнозировать её развитие, решать основные задачи материаловедения - создание материалов с заранее заданными свойствами, т. е. разработки технологии этих объектов. Кроме практической ценности, которую имеет для материаловеда учение о строении атома и химической связи, оно помогает построить цельную и гармоническую картину химических явлений и во многом определяет общетеоретическую подготовку специалиста в области технологии и свойств фаз, а также материалов на их основе.
Осознавая важность данного курса в общей системе знаний о веществах и их свойствах, не следует забывать, что он читается в первом семестре и предназначен для вчерашних школьников. Студенты – первокурсники ещё не знают высшей математики, а их знания в области строении атома и химической связи, сформировавшиеся на основе школьной программы, эклектичны и скудны. В связи с этим, при разработке данного учебника было
4
учтено, что основы теорий строения атома и химической связи следует раскрыть, преимущественно, на качественном уровне, без использования математического аппарата квантовой механики. Однако изложение материала по возможности должно соответствовать строгим математическим моделям и физической реальности, а возможные упрощения не изменяли бы сущность основных положений теорий и на качественном уровне позволяли бы студентам решать поставленные перед ними задачи.
Введение
Курс «Ведение в теории строения атома и химической связи» имеет цель (наряду с курсом «Общая химия») подготовить студентов к восприятию на современном уровне материала неорганической и органической химии. Необходимость такой последовательности при изучении химической части программы подготовки бакалавров по направлению «Химия, физика и механика материалов» вытекает из предмета химии, заключающегося в изучении веществ и их превращений. В свою очередь, свойства вещества предопределяются их атомным составом и строением, а изменение состава или строения представляет собой сущность химического превращения. В связи с этим понимание изменений в системе происходящих в процессе и по завершении химических реакций невозможно без знаний основ теорий строения атома и химической связи.
Как известно, число описанных в настоящее время соединений приближается к пяти миллионам, а число химических реакций, которые теоретически могут протекать между этими веществами, оценивается величиной порядка 1040. Поэтому для приобретения навыков, позволяющих ориентироваться в таком объёме химической информации, необходимо знание общих закономерностей протекания химических процессов и факторов, с помощью которых этими процессами можно управлять и оценивать возможность их осуществления при определённых (или заданных) параметрах системы. Одной из таких теорий является химическая термодинамика, которая позволяет определить направление
5
самопроизвольного протекания химической реакции, если известны термодинамические данные для всех компонентов рассматриваемой системы. Однако для многих известных веществ ∆Go298, ∆Ho298, So298, теплоёмкости и т.д. ещё экспериментально не определены, но они могут быть с высокой точностью оценены, если известно строение молекул или кристаллов реагентов, а также, если исследователю известна связь между термодинамическими и структурными характеристиками веществ. Также можно отметить, что статистическая термодинамика позволяет рассчитывать равновесные концентрации веществ по молекулярным постоянным, значения которых, в свою очередь, могут быть получены опытным или расчётным путём. В последнем случае необходимо знание законов описывающих состояние электронов в атомах, молекулах, кластерах и активных комплексах, а также строение принимающих участие в реакциях частиц. Такие же расчёты можно провести в случае процессов с участием твёрдых фаз, при этом в ряде случаев для таких реакций расчёт является единственным путем, позволяющим оценить их термодинамику.
Умение вычислить скорость процесса и научиться ею управлять не менее важно, чем определить направление протекания реакции. Для определения скорости реакции необходимо иметь представления о ёе элементарных актах, в процессе которых происходит разрушение одних и возникновение других химических связей, т.е. меняется состав и структура участвующих во взаимодействии частиц. Следовательно, без знаний теорий строения вещества и химической связи невозможно понять механизм химической реакции и прогнозировать её развитие, решать основные задачи материаловедения - создание материалов с заранее заданными свойствами, т. е. разработки технологии этих объектов. Кроме практической ценности, которую имеет для материаловеда учение о строении атома и химической связи, оно помогает построить цельную и гармоническую картину химических явлений и во многом определяет общетеоретическую подготовку
6
специалиста в области технологии и свойств фаз, а также материалов на их основе.
Осознавая важность данного курса в общей системе знаний о веществах и их свойствах, не следует забывать, что он читается в первом семестре и предназначен для вчерашних школьников. Студенты – первокурсники ещё не знают высшей математики, а их знания в области строении атома и химической связи, сформировавшиеся на основе школьной программы, эклектичны и скудны. В связи с этим, при разработке данного учебника было учтено, что основы теорий строения атома и химической связи следует раскрыть, преимущественно, на качественном уровне, без использования математического аппарата квантовой механики. Однако изложение материала по возможности должно соответствовать строгим математическим моделям и физической реальности, а возможные упрощения не изменяли бы сущность основных положений теорий и на качественном уровне позволяли бы студентам решать поставленные перед ними задачи.
ОБЩИЕ ПОЛОЖЕНИЯ Предметом дисциплины являются вопросы строения атома, истории
формирования |
представлений о химической |
связи |
и основные теории, |
|
базирующиеся |
на |
электростатических |
и |
квантовомеханических |
представлениях, в том числе теория и практика |
межмолекулярного |
|||
взаимодействия. |
|
|
|
|
К задачам дисциплины можно отнести освоение основных теорий строения атома и использование общетеоретических вопросов в практике описания различных ионных и молекулярных систем, в том числе при прогнозе формирования определённых кристаллических структур и предсказании их относительной стабильности, а также при выявлении
зависимостей между физико-химическими |
свойствами молекулярных |
веществ и их составом или строением. |
|
7
Достижение поставленных задач достигается методами основанными на последовательном изложении материала от простых моделей к сложным с детальным анализом возможностей каждой из рассматриваемых теорий с оценкой возможного круга задач, которые могут быть решены на основе рассматриваемых представлений, а также анализом усвоения студентами материала курса, основанным на результатах выполнения ими проектных и тестовых заданий.
В учебнике рассмотрены основные законы и принципы предопределяющие строение атомов и формирование химической связи в кристаллических, жидких и газообразных веществах, относящихся к различным классам и типам.
8
Модуль №1 1 Развитие представлений о строении атома
Комплексная цель
В результате изучения данного модуля необходимо познакомиться с историей развития представлений о структуре атома, с достоинствами и недостатками наиболее известных моделей: У.Томсона и Дж.Дж.Томсона ("кексовая"), Э.Резерфорда ("ядерная" или "планетарная"), Н.Бора и Бора– Зоммерфельда ("квантовая") и современная квантово-механическая модель. Нужно научиться анализировать внутреннюю согласованность положений той или иной модели, а также их совместимость с известными на данный момент экспериментальными фактами. Необходимо научиться применять количественные модели для расчета важных атомных характеристик. Поскольку математический аппарат квантово-механической модели не входит в школьную программу, в рамках данной модели необходимо усвоить полуколичественные правила квантования и их влияние на электронное строение атомов и ионов.
Изучая материал, изложенный в модуле, важно усвоить зависимость электронного строения атомов (и одноатомных ионов) от положения элемента в периодической системе, взаимосвязь между строением электронного остова и способом заселения валентных орбиталей. Необходимо научиться анализировать факторы, влияющие важнейшие атомные свойства (орбитальные радиусы, энергии ионизации, сродство к электрону и электроотрицательность) и усвоить закономерности изменения этих свойств в периодах и подгруппах периодической системы.
Содержание
1.1 Ранние модели строения атома
Атом (в переводе с греческого – неделимый) долгое время считался простейшей, элементарной частицей мироздания. Но в самом конце XIX века были открыты некоторые явления, а также выполнены эксперименты, результаты которых свидетельствовали о сложности атома:
9
•Радиоактивность (самопроизвольный распад атомов некоторых элементов);
•Фотоэффект (испускание электронов металлами, при облучении их светом).
•Катодные лучи (испускание потока электронов при создании большой разности потенциалов между двумя металлическими электродами).
|
|
|
|
|
|
Осмысление |
новых |
фактов |
|||
|
|
|
|
|
|
потребовало изменить представление об |
|||||
|
|
|
|
|
|
атоме как о примитивном материальном |
|||||
|
|
|
|
|
|
объекте. |
Возникла |
необходимость |
|||
|
|
|
|
|
|
задуматься об устройстве атома. |
|
||||
|
|
|
|
|
|
– После открытия электронов и |
|||||
|
|
|
|
|
|
экспериментального |
определения |
их |
|||
|
|
|
|
|
|
свойств (заряда и массы) в конце XIX – в |
|||||
|
|
|
|
|
|
начале XX веков были предложены |
|||||
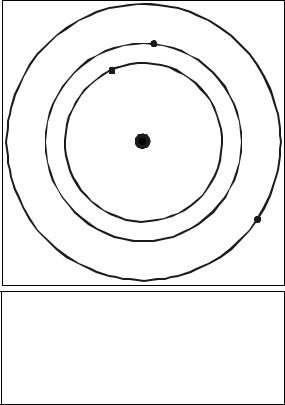
Рисунок |
1.1- |
Схема |
ядерной |
несколько моделей строения атомов, в |
|||||||
(планетарной) |
модели |
атома |
составе |
которых |
предполагалось |
||||||
Резерфорда |
в |
соответствие |
с |
наличие |
электронов, |
колеблющихся |
и |
||||
законами классической механики. |
|
или |
поступательно |
движущихся |
в |
||||||
|
|
|
|
|
|
положительно заряженной среде. Таким |
|||||
образом, достигалась электронейтральность атома, и качественно |
|||||||||||
объяснялись их спектральные свойства. |
|
|
|
|
|
||||||
– Экспериментальная проверка подобных моделей |
была |
выполнена |
|||||||||
Э.Резерфордом с коллегами. В опытах по рассеянию α-частиц при облучении |
|||||||||||
тонкой золотой фольги было убедительно показано, что в атомах имеется |
|||||||||||
ничтожная по размеру, но очень массивная положительно заряженная |
|||||||||||
частица. Выявленные факты указывали на то, что такая частица в атоме |
|||||||||||
имеется лишь одна. Стало ясно, что отличаются атомы разных элементов |
|||||||||||
величиной |
|
положительного заряда этой |
частицы и числом |
электронов, |
|||||||
|
|
|
|
|
|
10 |
|
|
|
|
|
