
Строение атома Нестеров
.pdf
У атомов элементов IV – VII периодов имеется шесть близких по энергии орбиталей, пять из которых принадлежат предвнешнему d-подуровню и одна внешнему s-подуровню. При взаимодействии N таких атомов образуется единая sdзона, состоящая из 6N МО (рис.10.6). За счёт большего числа МО ширина этой зоны больше, чем зон, образующихся за счёт s и p-орбиталей (рис. 10.6 (а) и (б)). Так как энергия валентных электронов в кристалле кальция (при равном числе этих электронов) ниже, чем в кристалле магния, первый имеет более высокую энергию кристаллической решётки и более высокую температуру плавления.
Рис. 10.6 - Расположение энергетических зон в кристаллах: (а) кальция и (б) магния
Анализируя представленную выше теоретическую концепцию, можно сделать вывод, что с её помощью можно описывать химическую связь в любых кристаллических веществах. На рис.10.7 представлена схема формирования энергетических зон в кристалле алмаза. У атомов углерода, из которых он образован, валентными являются 2s и 2p орбитали. Из этих АО на первом этапе (d > d2), образуются две различные зоны (N МО s-зоны и
221

3N р-зоны). При дальнейшем сближении атомов в кристаллической решётке (d1< d <d2) исходные зоны сливаются в единую sp-зону состоящую из 4N МО. При (d < d1) единая энергетическая зона расщепляется на две зоны, каждая из которых состоит из 2N МО. Все 4N валентных электронов N атомов углерода (при равновесном межатомном расстоянии d0) располагаются на орбиталях нижней зоны, заполняя их полностью, а 2N орбиталей верхней зоны остаются свободными. Валентная зона и зона проводимости разделены запрещённой зоной, ширина которой (∆Е) для кристалла алмаза составляет 5,6 эВ, т.е. данный кристалл является диэлектриком.
Рис. 10.7 - Расположение энергетических зон в кристалле алмаза. d0– межатомное расстояние в кристалле алмаза.
Аналогичная картина образования энергетических зон наблюдается в кристаллах других простых веществ элементов главной подгруппы IV группы: кремния, германия и α-олова. С ростом радиуса атома длина связи между ними в кристаллах возрастает (d0 смещается в сторону d1), что приводит к уменьшению ∆Е : эта величина составляет для кремния 1,1 эВ, для германия 0,7 эВ и для α-олова 0,1 эВ, т.е. все они относятся к полупроводникам.
222

Использование зонной теории для описания ионных кристаллов рассмотрим на примере NaCl (рис.10.8). Как видно из данного рисунка МО орбитали в этом кристалле формируются из 3s АО атомов натрия и 3р АО атомов хлора. В исходном состоянии орбитали 3s атомов натрия расположены по энергии ниже 3р орбиталей атомов хлора. При сближении атомов происходит их ионизация с образованием катиона Na+ и аниона Cl־. Ион Cl־ оказывается в окружении положительно заряженных ионов Na+, что приводит к резкому снижению энергии электронов аниона. Наоборот, ион Na+ попадает в окружение анионов, отрицательный заряд которых приводит к росту энергии МО, сформированных из 3s АО. Нижняя р-зона содержит 3N МО, а N ионов Cl־ имеют 6N электронов на р-орбиталях. Следовательно в кристалле NaCl р-зона полностью заполнена и является валентной, а s-зона представляет собой зону проводимости и при 0оК полностью свободна.
Рис.10.8 - Расположение энергетических зон в кристалле хлорида натрия. d0– межионное расстояние в кристалле хлорида натрия.
Валентная зона и зона проводимости в кристалле NaCl разделены широкой запрещённой зоной (∆Е = 6 эВ), т.е. кристалл относится к диэлектрикам.
223
Рассмотренные примеры показывают, что строго говоря, деление кристаллов на проводники, полупроводники и диэлектрики условно. Так, например, если к кристаллу алмаза или NaCl приложить достаточное (определяемое значением ∆Е) напряжение, то электроны из валентной зоны перейдут в зону проводимости, т.е. кристалл будет проводить электрический ток. Напряжённость внешнего электрического поля достаточная для превращения диэлектрика в проводник называется напряжением пробоя. Очевидно, что чем больше значение ∆Е кристалла, тем при более высокой напряжённости внешнего поля наступает его пробой. То же касается теоретически возможного перехода проводник – полупроводник, рассмотренного выше на примере кристалла бериллия. Ещё больше стираются эти различия при высоких температурах, когда вероятность перехода электронов из валентной зоны в зону проводимости у диэлектриков и полупроводников резко возрастает, а электропроводность металлов наоборот снижается. Тем не менее в настоящее время принято считать, что если при с.у. кристалл имеет ∆Е > 3 эВ, то он относиться к диэлектрикам (монокристаллические и поликристаллические материалы на основе таких фаз называются изоляторами), если у кристалла при с.у. 0,1≤ ∆Е ≤ 3 эВ, то его относят к полупроводникам. В металлах ∆Е = 0, и они отличаются от полупроводников и диэлектриков обратно пропорциональной зависимостью электропроводности от температуры.
4.3 Строение кристаллов металлов.
Как отмечалось выше, связь в металлах обладает такими свойствами как ненаправленность и ненасыщаемость. С другой стороны условием устойчивости любой формы (в том числе и кристалла) является минимальное (при заданных параметрах состояния системы) значение её изобарноизотермического или изохорно-изотермического потенциалов. Одним из возможных способов достижения минимума энергии системой является
224
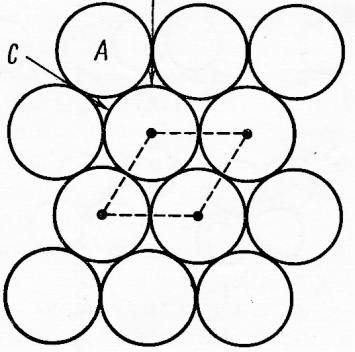
максимальное сближение в пространстве её структурных единиц, т.е. их плотнейшая упаковка. Хотя тенденция к достижению плотнейшей упаковки свойственна для всех типов кристаллических структур, она, практически, может быть реализована только в кристаллах с ненаправленным характером химической связи между атомами или ионами, которые в таких фазах можно считать сферическими. Таким образом модель плотнейшей упаковки предусматривает формирование структуры из одинаковых атомов, имеющих сферическую симметрию и притягивающихся друг к другу, в следствии образования между ними химической связи.
В
Рис.10.9 - Однослойная плотнейшая упаковка: А – атомы, В и С – пустоты.
На рис. 10.9 изображён двумерный плотноупакованный слой атомов, расположенных на одной плоскости. Каждый атом такого слоя соприкасается с шестью соседними атомами и окружён шестью лунками (пустотами), а каждая из лунок окружена тремя атомами. Исходя из того, что к.ч. атомов в слое равно 6, а «к.ч.» лунок – трём, можно сделать вывод, что число лунок в слое в два раза больше чем число атомов. Для получения объёмной
225

плотноупакованной структуры (рис.10.10) атомы второго слоя необходимо уложить в пустоты В или С (заполнить атомами все пустоты первого слоя невозможно с геометрической точки зрения – сравните число атомов и пустот первого слоя).
Рис.10.10 - Двухслойная плотнейшая упаковка.
Таким образом, в двухслойной структуре возникают пустоты двух видов:
1.Над лункой первого слоя находиться атом второго слоя (или лунка второго слоя над атомом первого слоя). Пустота в обоих случаях окружена четырьмя атомами, центры которых образуют правильный тетраэдр (рис. 10.11, а). Такие пустоты называют тетраэдрическими и обозначают символом Т (Т – пустоты).
2.Пустота второго слоя находиться над пустотой первого слоя и окружена шестью атомами, центры которых образуют правильный октаэдр (рис. 10.11, б). Эти пустоты называются октаэдрическими (или О – пустотами).
Анализ двухслойной модели показывает, что число О – пустот в ней совпадает с числом атомов, образующих систему, а число Т – пустот в два раза больше числа атомов. Геометрические расчёты показывают, что условный радиус пустот типа О равен 0,41 r, а типа Т – 0,22 r, где r –
226

металлический радиус атомов, образующих рассматриваемую кристаллическую решётку.
Рис.10.11 - Пустоты плотнейшей упаковки: (а) – тетраэдрическая, (б) - октаэдрическая
Так как во втором слое имеются два типа пустот, атомы третьего слоя можно помещать либо в лунки Т, либо в лунки О ( рис. 12.10).
227

Рис. 10.12 - Гексагональная (а) и кубическая (б) плотнейшие упаковки. Если атомы третьего слоя помещены в лунки Т (т.е. каждый атом третьего слоя находиться над атомом первого слоя), то третий слой повторяет укладку первого. Тогда упаковка атомов в кристалле повторяется через один слой …..АВАВАВАВ…. (рис.10.12(а)) и называется
гексагональной (ГПУ – гексагональная плотнейшая упаковка).
Если атомы третьего слоя помещены в лунки О, т.е. расположение атомов в этом слое не повторяют расположение атомов первого слоя, то тогда четвёртый слой атомов в точности расположится над первым и повторение структуры будет наблюдаться через два слоя ……..АВСАВСАВС….. (рис.10.12(б)). Такая структура называется кубической плотнейшей упаковкой (или ГЦК - гранецентрированная кубическая структура).
Рис. 10.13. Элементарные ячейки структур кристаллов металлов: а – ОЦК, б – ГЦК, в – ГПУ.
Плотность упаковки атомов в любой структуре определяется с помощью коэффициента компактности:
В ГПУ и ГЦК коэффициент компактности одинаков ( К = 74,05 %), т.е.
атомы занимают около ¾ объёма системы.
228

Атомы одинакового размера можно расположить и несколько иначе (рис. 10.14). В такой структуре атомы монослоя контактируют только с четырьмя соседними и образующиеся пустоты являются квадратными. Атомы последующего слоя располагаются в углублениях предыдущего, порядок чередования слоёв такой же как в ГПУ, однако константа компактности в данном случае несколько меньше (К = 68 %). Структура носит название кубической объёмноцентрированной (ОЦК) и, хотя не относится к плотнейшим упаковкам, но вплотную к ним приближается.
Рис.10.14 - Объемноцентрированная структура металлов. Металлические модификации простых веществ различных элементов (таблица 10.1), за исключением Mn, Ga, In, Hg, Sn, Bi, Ро и Pu, имеют одну из рассмотренных выше структур: ГПУ,ГЦК или ОЦК (при этом структуры Mn,
Ga, In и Hg являются производными от трёх основных).
229

Таблица 10.1
Структуры простых веществ элементов различных подгрупп в твёрдом состоянии
Внизу каждого столбца – форма стабильная при с.у.. А1, снизу вверх последовательность высокотемпературных модификаций. А1 – ГЦК, А2 – ОЦК, А3 – ГПУ, А3/ - разновидность ГПУ, А4 – алмазоподобная структура, α,β,γ – модификации, производные от основных; другие формы простых веществ по типам строения кристаллической решётки: К – кубическая, Т – тетрагональная, Г – гексагональная, Р – ромбоэдрическая, М – моноклинная, Тр – триклинная.
230
