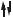
|
|
|
.. |
dγ |
|
.. .. .. |
|
|
|
+ 6 |
.. |
.. .. .. |
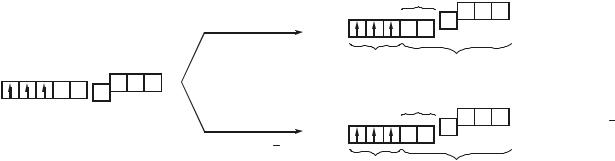
[Cr(OH2)6] 3+ |
|
|
Н2O |
|
3d |
4s |
4p |
dε |
|
d2sp3 |
|
|
|
|
|
|
|
|
dγ |
|
|
|
Cr3+ |
+..6 ..CN |
.. .. .. .. .. .. |
[Cr(CN)6] 3 |
|
|
|
|
|
|
|
|
|
dε |
|
d2sp3 |
|
Отметим, |
что из-за частичной заселенности d –орбиталей, Cr3+ |
не может |
|
|
|
|
ε |
|
|
|
проявить ни π–акцепторных свойств (в составе [Cr(ОН2)6]3+), ни π–донорных (в составе [Cr(CN)6]3–). Любопытно, что цианидные комплексы (карбонилы и другие комплексы с лигандами активными π–акцепторами) нередко проявляют высокое сродство к электрону, что позволяет в составе таких соединений стабилизировать у d-элементов аномально низкие (порой даже отрицательные) степени окисления. В частности К3[Cr(CN)6] по реакции с атомарным водородом (цинк в солянокислой среде) удается восстановить до К6[Cr(CN)6]. Причем в составе нового комплекса атом хрома принимает три дополнительных электрона на свои орбитали и, приобретая нулевую степень окисления, должен был бы, тем самым, воспроизвести электронную конфигурацию нейтрального атома [Ar]3d54s14p0 с шестью неспаренными электронами. Однако комплекс К6[Cr(CN)6] диамагнитен. Подобные факты дали основания предположить, что в комплексах с активными π–акцепторами меняется электронное строение комплексообразователя: на d-подуровне в первую очередь заселяются dε–орбитали (поначалу в соответствие с правилом Хунда, а при конфигурациях d4, d5 и d6 – попарно). Это позволяет, во-первых, сохранять (n-1)dγ–орбитали вакантными и использовать их для внутриорбитальной гибридизации и σ–связывания, а во-вторых, попарно заполненные dε–орбитали могут быть задействованы для
дополнительного πd(M)→p(L)–взаимодействия, что приводит к увеличению кратности связи комплексообразователь–лиганд. Принимая во внимание
эти рассуждения, образование комплекса [Cr(CN)6]6– с точки зрения МВС может быть схематично показано следующим образом:
3d |
|
4p |
|
|
dγ |
.. .. .. .. |
|
4s |
|
|
.. .. |
[Cr(CN) ] 6 |
|
. |
|
|
|
.. . |
|
|
6 |
|
|
+ 6 |
CN |
|
|
|
|
|
Cr0 |
|
d |
ε |
|
d2sp3 |
|
|
|
|
|
|
|
Особенность цианид-ионов в качестве лигандов подтверждает и сравнение комплексов хрома (II): при одинаковом электронном строении центрального атома (d4) магнитные моменты [Cr(CN)6]4–, с одной стороны, и [Cr(ОН2)6]2+, [CrF6]4–, [Cr(NCS)6]4–,…, с другой, отличаются:
+.6...F.. ..
Cr2+  +.6 .CN ..
+.6 .CN ..
|
dγ |
4d |
|
.. |
dγ |
.. .. .. .. |
dε |
.. |
[CrF ] 4 |
|
|
6 |
dε |
dsp3d |
|
dγ |
.. .. .. .. |
|
.. .. |
[Cr(CN)6] 4 |
dε |
d2sp3 |
|
В то же время МВС оказывается бессилен перед объяснением различий в оптических свойствах (окрашенности) и деталей пространственного строения: в отличие от цианидного комплекса все прочие, несмотря на однородный лигандный состав и равноценность участвующих в σ–связывании гибридизованных орбиталей центрального атома, характеризуются слабым тетрагональным искажением октаэдрической координации (КЧ = 4+2).
При дальнейшем повышении заряда ядра и одновременном увеличении числа электронов на валентных орбиталях наблюдается:
растущая стабилизация низких степеней окисления d–элементов;
усиление π–донорных свойств атомов (ионов) d–металлов. Соответственно постепенно ослабевает взаимодействие с лигандами σ– и π–донорами, растет предпочтение к связыванию с лигандами π–акцепторами, как следствие – комплексы становятся более разнообразными;
постепенный переход к внешнеорбитальным комплексам.
Рассмотрим некоторые комплексы Ni (II), Cu (II) и Cu (I).
..dγ.. 4d 
+..6 NH3
+.4 .Cl.. ..
..
+.4 .CN ..
dγ .. .. .. ..
dε sp3d2
dγ .. .. .. ..
dε sp3
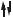

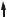 d.γ. .. .. ..
d.γ. .. .. ..
dε dsp2
dε
[Ni(NH3)6]2+
октаэдр
[NiCl4]2
тетраэдр
[Ni(CN)4]2
квадрат
Комплексы Cu (II) весьма разнообразны по лигандному составу: перечень только монодентантных лигандов, при связывании с которыми могут быть получены островные комплексы, включает в себя Н2О, OH–, Г–, NH3, SCN–, S2O32–, NO2– и т.д. Весьма разнообразна их окраска: голубые, желто-зеленые, сине-фиолетовые,… . В то же время магнитные свойства комплексов одинаковы, а их структуры сходны или родственны:
– при электронной конфигурации центрального атома d9 во всех комплексах иона Cu2+ обнаруживается один неспаренный электрон;
– в большинстве комплексов реализуется тетрагонально искаженная октаэдрическая координация (КЧ = 4+2); порой оба или один из слабо связанных лигандов полностью покидают координационную сферу (при этом
получаются или квадратные – КЧ=4 (нет тетраэдров!), или квадратнопирамидальные комплексы – КЧ=4+1):
|
КЧ = 4+2 |
КЧ = 4+1 |
КЧ = 4 |
|
(вытянутый октаэдр) |
(квадратная пирамида) |
(квадрат) |
|
|
|
|
|
[Cu(ОН2)6]2+, |
|
[CuCl4]2–, |
|
[Cu(OH)6]4–, |
|
|
[CuCl5]3–, |
[Cu(NН3)4]2+, |
|
[Cu(NН3)6]2+, |
|
[Cu(NН3)4(ОН2)]2+ |
[Cu(NО2)4]2–, |
|
[Cu(NН3)4(ОН2)2]2+, |
|
|
[Cu(OH)4]2– |
|
[Cu(SCN)6]4– |
|
|
|
|
|
|
|
|
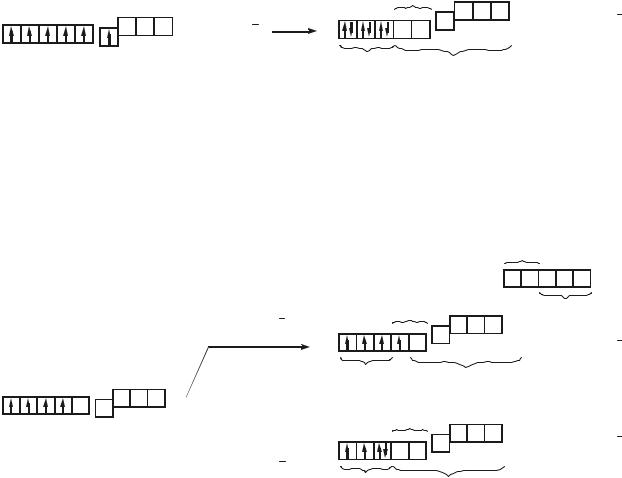
С точки зрения МВС все комплексы Cu (II) являются внешнеорбитальными:
|
|
dγ |
|
dγ .. .. .. .. |
.. .. |
|
|
dε |
sp3d2 |
|
|
dγ |
|
dγ .. .. .. .. |
.. |
|
|
dε |
sp3d |
dγ |
|
dγ |
.. |
|
|
|
.... |
|
|
.. |
|
dε sp2d
4d
dε [Cu(NH3)6]2+
удлиненный
октаэдр
4d
dε
[CuCl5]3
квадратная
4d пирамида
dε [Cr(OH)4]2
квадрат
Напомним, что для формирования электронных облаков, ориентированных к вершинам квадратной пирамиды, в гибридизацию должна вовлекаться орбиталь dx2-y2. Она же необходима для образования плоско-квадратных комплексов, в то время как рz–орбиталь из гибридизации извлекается. Кроме того, следует отметить, что, в соответствие с МВС,
в хлоридном и гидроксокомплексе возможно слабое дополнительное π–связывание (ионы Cl– являются слабыми π–донорами и π–акцепторами; ионы ОН– обладают гораздо более выраженными π–донорными свойствами, но центральный атом π–акцепторные свойства может реализовать только за счет высоколежащих 4d–орбиталей). Несмотря на объяснения способов ковалентного взаимодействия центрального атома и лигандов, МВС, попрежнему, бессилен предложить причины, как спектральной активности, так и структурных особенностей комплексов. Любопытно, что комплексы Cu (I) наоборот, в подавляющем большинстве бесцветны, но гораздо более разнообразны в структурном плане, несмотря на более низкие координационные числа (КЧ: 2, 3, 4; координационные формы: линия, треугольник, тетраэдр – нет квадратов!):
|
КЧ = 2 |
КЧ = 3 |
|
КЧ = 4 |
|
|
(линия) |
(треугольник) |
|
(тетраэдр) |
|
|
sp-гибридизация |
sp2-гибридизация |
|
sp3-гибридизация |
|
|
|
|
|
|
|
|
[Cu(NН3)2]+, |
[CuГ3]2–, |
|
[Cu(CN)4]3–, |
|
|
[CuГ2]–, |
[Cu(CN)2]– |
|
[Cu(SCN)4]3–, |
|
|
[Cu(CN)2]– |
(цепочечный |
|
[CuCl4]3– |
|
|
полимер – |
|
|
|
(островная форма) |
|
(искаж. тетр.) |
|
|
[Cu(CN)2/2(CN)]–) |
|
|
|
|
|
|
|
|
Что касается комплексов s– и р–элементов, то кратко отметим лишь |
некоторые важные закономерности: |
|
|
|
• В качестве комплексообразователей |
выступают ионы элементов |
(см. табл.4.7) с промежуточным поляризующим действием (электроотрицательностью), однако важно понимать, что у большинства рассматриваемых элементов эти характеристики заметно выше, чем у d–металлов;
• Практически все потенциальные комплексообразователи образуют только октаэдрические комплексы (у Ве2+, В3+ известны только тетраэдры;
Al3+ и Ga3+ наряду с октаэдрами тоже порой образуют тетраэдрические комплексы; Sn2+, Pb2+ имеют только тетраэдрические и тригональнопирамидальные комплексы), что требует вовлечение в гибридизацию и σ–взаимодействие ndγ-орбиталей (за счет s– и р–орбиталей может быть реализовано только КЧ=4). Это предполагает связывание с сильно электроотрицательными атомами, а также то, что за счет вакантных ndε-орбиталей потенциальные комплексообразователи являются достаточно активными π–акцепторами.
• В качестве лигандов в подавляющем большинстве случаев выступают активные σ– и π–доноры: ОН2 (только при связывании с ионами, не вызывающими сильный гидролиз, т.е. п/д, которых минимально в данном ряду элементов), ОН– (при связывании с ионами, характеризующимися промежуточным уровнем п/д в ряду данных элементов), одноатомные
лиганды: |
О2–, F–. Р–элементы VI–го, V–го и, в меньшей степени, |
IV–го |
периодов |
имеют заполненные (n-1)d10–подуровни и, поэтому |
могут |
участвовать в πd(M)→d(L)–взаимодействии. Соответственно, для таких элементов даже в водной среде могут оказаться вполне конкурентными, выгодными связи М–Cl и Cl– в качестве потенциального лиганда. В ряде случаев стабилизируются комплексы и с более крупными галогенами. Те же элементы, но гораздо реже могут образовать островные воднорастворимые комплексы с лигандами S2– и SH–.
• Все комплексы р–элементов диамагнитны и в подавляющем большинстве своем – бесцветны. Чрезвычайно редкие исключения возможны в случае комплексов с лигандами π–акцепторами.
Таблица 4.12
Составы важнейших островных воднорастворимых комплексов р–элементов
IIа |
IIIа |
IVа |
Vа |
VIа |
|
|
|
|
|
[Be(OH2)4]2+ |
[B(OH)4]– |
|
|
|
[Be(OH)4]2– |
[B4O5(OH)4]2– |
–– |
–– |
–– |
[BeF4]2– |
[BF4]– |
|
|
|
|
[Al(OH2)6]3+ |
|
|
|
2+ |
[Al(OH)4]– |
[SiO2(OH2)2]2– |
|
–– |
– |
– |
[Mg(OH2)6] |
[Al(OH)4(OH2)2] |
2– |
[PF6] |
|
[Al(OH)6]3– |
[SiF6] |
|
|
|
[AlF6]3– |
|
|
|
|
|
|
[AsF6]– |
|
|
|
[Ge(OH)4]2– |
AsO43–; |
|
|
То же, что у Al3+ |
[GеO2(OH)2]2– |
[As(OH)4]– |
–– |
|
|
[GeF6]2– |
[AsF4]– |
|
|
|
|
[AsCl4]– |
|
|
|
[Sn(OH)2(OH2)4]2+ |
[Sb(OH)6]– |
|
|
То же, что у Al3+, |
[Sn(OH)6]2– |
[SbF6]– |
|
|
кроме |
[SnF6]2– |
[SbCl6]–; |
[Te(OH)6]; |
|
гидроксокомплекса, |
[SnCl6]2–; |
[Sb(OH)2(OH2)2]+ |
[Te(OH)6]2– |
|
дополнительно |
[Sn(OH2)6]2+ |
[Sb(OH)4]– |
[TeCl6]2– |
|
[InCl4]– |
|
[InCl6]3– |
[SnCl3]– |
[Sb(OH)6]3– |
|
|
|
[Sn(OH)3]– |
[SbCl4]– |
|
|
|
[Pb(OH)6]2– |
|
[Po(OH)2(OH2)4]2+ |
|
[TlCl6]3–; |
[SnF6]2–; |
[Bi(OH2)6]3+ |
|
2+ |
[Ро(OH)6]2– |
|
[TlCl3]2– |
[Pb(OH2)6] |
[BiCl4]– |
[РоCl6]2–; |
|
– |
|
|
[PbCl3] |
|
2+ |
|
|
[Pb(OH)3]– |
|
[Ро(OH2)6] |
|
|
|
|
|
В заключение кратко обсудим применение идей МВС для объяснения состава, структуры и некоторых свойств достаточно своеобразных соединений: карбонилов и карбонильных комплексов d–элементов (известны также и полилигандные карбонилы: карбонилнитрозилы (M(CO)x(NO)y), карбонилгалогениды (M(CO)xГy), карбонилгидриды (M(CO)xHy), карбонилметаллоцены (M(CO)x(C5H5)y) и т.п., в том числе, полиядерные, содержащие

несколько атомов d–металла). Состав большинства из них подчиняется правилам, сформулированным в 20-е годы ХХв. на рубеже становления квантово-механической модели строения атома: первое и модифицированное правило Сиджвика (правило 18 электронов): наиболее стабильными являются комплексы, в составе которых центральный атом имеет полностью завершенную (n-1)d10ns2np6-конфигурацию. В расчет принимаются валентные электроны d–элемента и электроны лигандов, задействованные в связях M–L. Правило основано на предположении попарного заселения валентных орбиталей электронами центрального атома и донорноакцепторном взаимодействии комплексообразователь–лиганд (лигандырадикалы, типа NO, рассматриваются как доноры трех электронов; лиганды с протяженными π–системами являются донорами всех своих π–электронов).
Таблица 4.13 |
|
|
|
|
|
|
|
Состав известных карбонилов 3d-элементов |
|
|
|
|
|
|
VIIIв |
|
|
Vв |
VIв |
VIIв |
|
|
|
|
|
|
|
|
|
V(CO)6 |
|
|
Fe(CO)5 |
Co2(CO)8 |
|
|
"V2(CO)12" |
Cr(CO)6 |
Mn2(CO)10 |
Fe2(CO)9 |
Ni(CO)4 |
|
Co4(CO)12 |
|
очень |
|
|
Fe3(CO)9 |
|
|
нестабилен |
|
|
|
|
|
|
|
|
|
|
Объем и тематика данного учебника не позволяют выполнить анализ возможных причин, ограничивающих круг элементов, склонных к образованию карбонилов (табл.4.14). Отметим только, что с учетом родственных соединений они получены для всех d-металлов за исключением
Таблица 4.14
Круг d-элементов, входящих в состав карбонилов
Sc |
Ti |
V |
Cr |
Mn |
Fe |
Co |
Ni |
Cu |
Zn |
|
|
|
|
|
|
|
|
|
|
Y |
Zr |
Nb |
Mo |
Tc |
Ru |
Rh |
Pd |
Ag |
Cd |
|
|
|
|
|
|
|
|
|
|
La |
Hf |
Ta |
W |
Re |
Os |
Ir |
Pt |
Au |
Hg |
|
|
|
|
|
|
|
|
|
|

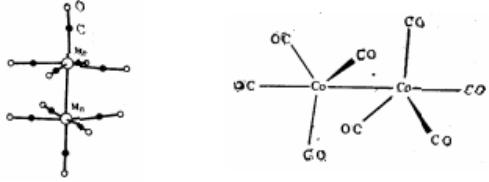
Nb, Ta, а также элементов подгрупп скандия и цинка. В то же время состав и структуры простейших карбонилов идеально согласуются с правилом Сиджвика и теорией Полинга. В частности, чередование мономерных (у Cr, Fe и Ni) и димерных молекул (у V, Mn и Со) есть результат того, что элементы нечетных групп имеют нечетное число валентных электронов, поэтому мономерные молекулы являются радикалами и способны объединяться за счет связи М–М (такие соединения принято называть
кластерами):
примеры боснование состава на основе модифицированного правила Сиджвика:
Электронная конфигурация |
Электронная конфигурация |
изолированного атома Mn: |
изолированного атома Fe: |
[Ar]3d54s24p0 |
[Ar]3d64s24p0 |
Электронная конфигурация |
Электронная конфигурация |
комплексообразователя: |
комплексообразователя: |
[Ar]3d74s04p0 |
[Ar]3d84s04p0 |
Число электронов на орбиталях |
Число электронов на орбиталях |
центрального атома |
центрального атома |
в составе комплекса: |
в составе комплекса: |
7 + 5·2(СО) + 1(Mn) = 18 |
8 + 5·2(СО) = 18 |
|
|
структуры на основе теории Полинга
КЧCr = 6 |
КЧFe = 5 |
КЧNi = 4 |
октаэдр |
тригональная |
тетраэдр |
|
бипирамида |
|
d2sр3 |
dsр3 |
sр3 |
КЧMn = 6 |
КЧСо = 4+1 |
октаэдр |
тригональная |
|
бипирамида |
d2sр3 |
dsр3 |
У Fe, Co и некоторых тяжелых d–металлов известны "сложные карбонилы". Убедительных объяснений их состава и избирательного существования, пока не выработано. В то же время особенности их структуры (наличие связей М–М, число мостиковых или концевых молекул СО, пространственное окружение) можно предвидеть, применяя теорию Сиджвика/Полинга (см., например, учебник Дж.Хьюи "Неорганическая химия. Строение вещества и реакционная способность").
4.5.2.2 Теория кристаллического поля
Впервые идеи и математический аппарат теории кристаллического поля (ТКП) были изложены немецким физиком Г.Бете в 1929г. Как и в простой ионной модели, взаимодействие комплексообразователь–лиганд подразумеваются чисто электростатическим. При этом лиганды рассматриваются как бесструктурные точечные отрицательные заряды (реже диполи). В то же время электронное строение центрального атома (теория ориентирована на анализ свойств соединений переходных элементов) анализируется подробно, в частности энергия d(или f–)–орбиталей рассчитывается с использованием уравнения Шредингера в зависимости от симметрии и напряженности электрического поля, создаваемого лигандами:
300





 +
+