
Строение атома Нестеров
.pdfкоординационные числа, возможные искажения координационных сфер), а также некоторых физико-химических (магнитные, спектральные свойства) и химических (предпочтительность связывания с теми или иными лигандами, закономерности изменения Н°обр, окислительно-восстановительная способность) свойств координационных соединений островного и полимерного строения.
Содержание
Прежде чем приступить к решению основной задачи раздела определимся с объектом изучения. Согласно определению, данному в «Химической энциклопедии» [Из. «Большая российская энциклопедия», 1992, т.3 с.52-54. абзац 95-100 ] « Металлы это вещества, обладающие в обычных условиях характерными металлическими свойствами – высокой электрической проводимостью и теплопроводностью, отрицательным температурным коэффициентом электрической проводимости, способностью хорошо отражать световые волны (блеск), пластичностью. К металлам
относятся как простые вещества, так и их сплавы, а также металлические соединения, в том числе интерметаллиды». Несмотря на то, что данное определение нельзя назвать совершенным по форме, так как сложные металлические фазы имеют несколько другую классификацию, в нем отражена основная сущность металлов как простых или сложных веществ с определённым набором свойств. В то же время Периодический закон отражает свойства элементов, т.е. атомов с определённым набором характеристик, а не свойства простых и сложных веществ. Поэтому в Периодической системе по определению не может быть «металлических» или «неметаллических» элементов, но присутствуют элементы, простые вещества которых могут быть металлами, полупроводниками, диэлектриками атомного или молекулярного типа. При этом, в ряде случаев, в зависимости от значения параметров состояния системы, атомы данного элемента могут образовывать простые вещества различных типов: например, медь, серебро золото в парах представляют собой совокупность молекул типа Ме2, а при
211
с.у. их простые вещества – металлы; олово при температуре ниже 13,2оС – полупроводник с кристаллической решёткой типа алмаза, а выше этой температуры стабильна металлическая модификация простого вещества; для фосфора известны диэлектрические, полупроводниковые и металлические модификации (последняя формируется при высоком давлении) и т.д.. Таким образом термины типа «подгруппа щелочных, щелочноземельных или редкоземельных металлов» не могут быть признаны корректными и только вносят путаницу при определении объектов исследования. С другой стороны свойства простых и сложных веществ предопределяется их качественным и количественным составом и, следовательно, строение и характеристики атома данного элемента играют важную роль в формировании простого или сложного вещества того или иного типа, предопределяя тип химического взаимодействия в системе и её строение. В связи с этим, исторически первые попытки разделения элементов по типам простых веществ основывались на анализе их расположения в Периодической системе. В частности, было установлено, что при длиннопериодном варианте данной системы, диагональ, проведённая от бора к астату разделяет элементы главных подгрупп по признаку свойств их простых веществ – в левом нижнем углу от диагонали в главных подгруппах располагаются элементы, простые вещества которых при с.у. - металлы, для элементов расположенных вблизи диагонали известны простые вещества различных типов (для большинства из них при с.у. стабильны полупроводниковые модификации), простые вещества элементов главных подгрупп, расположенных справа от диагонали (азот, кислород, сера, галогены, элементы VIII группы) во всех агрегатных состояниях представляют собой совокупность молекул или атомов, а их жидкие и твёрдые фазы – диэлектрики. Все простые вещества элементов, образующих побочные подгруппы Периодической системы, относятся к металлам. По строению валентного уровня атомов, образующих простые вещества, металлы принято делить на четыре типа: s- металлы (простые вещества элементов главных подгрупп I и II групп), p – металлы ( простые
212
вещества элементов Al, Ga, In, Tl, Sn, Pb, Bi, Po), d – металлы (простые вещества элементов побочных подгрупп) и f – металлы (простые вещества лантаноидов и актиноидов). На основании приведённых фактов, можно сделать вывод, что более 80% известных в настоящее время элементов способны образовывать простые вещества металлического типа, несмотря на различия в строении их атомов и, следовательно, причиной наличия у металлов особых свойств является отличный, от ранее рассмотренных, тип взаимодействия между атомами, входящими в состав кристаллических решёток рассматриваемых фаз.
4.1. Химическая связь в кристаллах металлов. 4.1.1 Теория «электронного газа».
Первая попытка описания химической связи в кристаллах металлов была предпринята в рамках теории ионной связи. Согласно предложенной модели при взаимодействии атомов происходит их ионизация и образующиеся катионы располагаются в узлах кристаллической решётки формирующейся фазы. «Потерянные» атомами электроны располагаются в межионном пространстве, образуя единое «электронное облако», т.е вдоль любой ортогональной оси кристалл представляет собой чередующиеся области положительного и отрицательного заряда – «сэндвич», в котором слои удерживаются друг относительно друга силами электростатического притяжения. Данная модель предопределяет такие свойства постулируемой связи как ненаправленность и ненасыщаемость. Так как справедливость любой гипотезы проверяется на практике, попытаемся объяснить свойства металлов, используя описанные выше представления.
Электропроводность: наличие в системе электронов, связанных с ионным остовом только силами электростатического притяжения предопределяет возможность направленного движения этих электронов под действием внешнего электрического поля. Теплопроводность: возможен перенос тепловой энергии как за счёт перемещающихся по системе электронов, так и за счёт колеблющихся ионов, способных передавать кинетическую энергию
213
соседним ионам (эстафетный механизм). Металлический блеск и непрозрачность металлов: межионное пространство занято движущимися по кристаллу электронами, кванты света, упруго взаимодействуя с «электронным газом» (эффект Комптона), отражаются от поверхности металла. Пластичность: при механическом воздействии на кристалл металла, образующие его слои ионов смещаются относительно друг друга, что вызывает и перераспределение в объеме системы электронного «облака» - кристалл не разрушается, а пластически деформируется. Кроме этого, теория предсказывает плотнейшую упаковку ионов в кристаллах металлов (ненаправленный и ненасыщаемый характер связи), что подтверждается экспериментальным данными. Таким образом можно сделать вывод, что на качественном уровне теория «электронного газа» позволяет интерпретировать большинство свойств металлов и предсказывает строение этих фаз. Однако попытки количественных расчётов на основе этой теории, в большинстве случаев, успехом не увенчались. Так, например, энергия электронов в «газе» должна подчиняться распределению МаксвеллаБольцмана, согласно которому каждый электрон вносит в удельную теплоёмкость металла вклад равный (3/2 kT), где k – постоянная Больцмана. Тогда полная атомная теплоёмкость должна быть приблизительно равна ( 9/2 R), где R – газовая постоянная. Полученный результат противоречит экспериментально найденному правилу Дюлонга – Пти, согласно которому атомные теплоёмкости как металлов, так и диэлектриков ( т.е. систем с локализованными электронами) приблизительно равны (6/2 R). Таким образом данные эксперимента показывают, что «электронный газ» практически ничего не вносит в величину удельной теплоёмкости, что находится в явном противоречии с основными положениями рассматриваемой теории. Аналогично можно показать, что на основе теории «электронного газа» не удаётся правильно рассчитать величину теплопроводности металлов, а по вопросу зависимости электропроводности
214
от температуры расчетные и экспериментальные данные оказались диаметрально противоположны.
С целью устранения указанных недостатков Зоммерфельд предпринял попытку решения задачи описания связи в кристаллах металлов, используя приёмы, совокупность которых впоследствии была применена в МВС. Согласно полученным расчётным данным в системе состоящей из электронов и периодически расположенных положительно заряженных ионов возникает спектр электронных уровней (орбиталей), энергия которых
0< Еу ≤ EF (рис. 10.1). n
 E
E
Рис.10.1 - Зависимость числа электронных уровней (n) от энергии в приближении Зоммерфельда.
Заполнение орбиталей электронами начинается с самых низких по энергии и продолжается до тех пор пока все валентные электроны системы не займут свои места на орбиталях в соответствии с принципом Паули (заштрихованный участок на рис 10.1). Предельная энергия заполненных электронных уровней называется энергией Ферми (EF). При абсолютном нуле все электронные уровни, расположенные ниже уровня Ферми, заполнены, а все вышележащие – свободны. С ростом температуры системы, вследствие
215
теплового возбуждения, часть электронов переходит из состояний, лежащих ниже уровня Ферми, в состояния с энергией превосходящей этот уровень (кривая на рис. 10.1 при Т > 0оК). Это приводит к «размыванию» первоначальной функции распределения электронных состояний, т.е. к постепенному расширению уровня Ферми (область пропорциональная kT на рис. 10.1) по мере увеличения температуры системы. Указанный подход позволяет понять причину неудачных попыток рассчитать характеристики металлов на основе выводов теории «электронного газа». Согласно последней кинетическая энергия «свободных» электронов быстро возрастает по мере увеличения температуры кристалла металла, тогда как расчёты Зоммерфельда показывают, что при увеличении температуры системы от 0 до ТоК изменение суммарной внутренней энергии электронов незначительно и связано с переходом небольшого числа электронов из состояния с Еу более низкого, чем EF, в состояние с энергией более высокой, чем EF (рис.10.1). Отсюда можно сделать ряд выводов, справедливость которых доказана экспериментально: а) т.к. с ростом температуры суммарная энергия валентных электронов изменяется мало, вклад электронной составляющей в теплопроводность и теплоёмкость металлов мал, по сравнению с вкладом атомной (ионной) составляющих; б) с ростом температуры уменьшается длина свободного пробега электрона в кристаллах металлов в связи с ростом амплитуды и частоты колебаний частиц, формирующих кристаллическую решётку, что при практически неизменной внутренней энергии электронов должно приводить к снижению электропроводности металлов по мере увеличения температуры.
Таким образом, Зоммерфельд показал, что понимание природы химической связи в кристаллах металлов может быть достигнута путём описания поведения большого числа электронов в объёме периодически изменяющегося электрического потенциала, обусловленного атомами (ионами), образующими кристалл. В связи с тем, что в рамках МВС решение указанной задачи в настоящее время не может быть получено, современная
216
теория химической связи кристаллических (а в ряде случаев и аморфных) фаз базируется на методе молекулярных орбиталей.
4.2 Зонная теория химической связи для кристаллов металлов, полупроводников и диэлектриков.
При описании химической связи в рамках ММО ЛКАО было показано, что при взаимодействии двух атомных орбиталей (АО) образуются две молекулярные орбитали (МО) с различной энергией (связывающая и разрыхляющая). В общем случае число МО равно числу АО, принимающих участие в формировании химической связи. В 1 см3 кристалла металла находиться 1022 – 1023 атомов, т.е. N для данных систем – величина порядка числа Авогадро, что приводит к формированию такого же числа МО, сконцентрированных в малом объёме и, следовательно, отличающихся друг от друга по энергии на ≈ 10-22эВ, т.е. на ничтожно малую величину (рис.10.2)
 число АО
число АО
Рис.10.2 - Построение энергетической зоны (совокупности многоцентровых МО) в процессе перекрывания всё возрастающего числа АО.
В связи с этим можно считать, что в процессе взаимодействия атомных орбиталей в системе возникает совокупность делокализованных МО , очень близких по энергии, которая носит название энергетической зоны. В
217

соответствии с принципом минимума энергии в образовании отдельной энергетической зоны в первую очередь принимают участие орбитали с одинаковыми значениями главного и побочного квантовых чисел, а ширина зоны зависит от межатомного расстояния в кристаллической решётке и пространственной направленности орбиталей (рис.10.3).
Рис. 10.3 - Расположение энергетических зон в кристаллах натрия, магния и алюминия.
1 – межатомное расстояние в кристалле натрия
Если расстояния между атомами в системе велико, то состояние их электронов описывается АО. При сближении атомов происходит их взаимодействие, т.е. формирование энергетических зон. На каждой МО может разместиться по два электрона с противоположным значением спиновых квантовых чисел. Следовательно, максимально возможное число электронов в зонах, возникающих за счёт перекрывания s-, p-, d- и f – атомных орбиталей (с одинаковым значением главного квантового числа), соответственно равно 2N (s-зона), 6N (р-зона), 10N (d-зона) и 14N (f –зона). Электроны заполняют орбитали зоны, начиная с самых низких по энергии.
218

В частности, энергия орбиталей 1s, 2s и 2р атомов, образующих кристалл натрия, остаются неизменными при равновесном значении межатомного расстояния в рассматриваемой системе. Орбитали же типа 3s, 3р, 4s и имеющие ещё более высокую энергию формируют зоны МО. Как видно из рис.10.3 и 10.4 зоны 3s и 3р накладываются друг на друга, образуя единую зону, имеющую 4N орбиталей (N орбиталей s-зоны и 3N орбиталей р-зоны).
Рис. 10.4 - Энергетические зоны кристалла натрия при равновесном расстоянии атомов в кристаллической решётке.
Как видно из рис.10.4, валентной зоной в кристалле натрия является половина МО орбиталей s-зоны, имеющих минимальную энергию. Это связано с тем, что N атомов натрия, входящих в состав кристалла, имеют N электронов, расположенных в исходном состоянии на 3s АО, число которых также равно N. Из орбиталей типа 3s формируются N молекулярных орбиталей s-зоны. Так как в соответствии с принципом Паули на каждой МО могут располагаться по два электрона, N/2 наиболее низких орбиталей этой зоны будут заполнены электронами при 0оК, т.е. эти МО образуют валентную
219
зону. Зона проводимости в данном случае будет представлять собой совокупность оставшихся орбиталей s-зоны и все орбитали р-зоны.
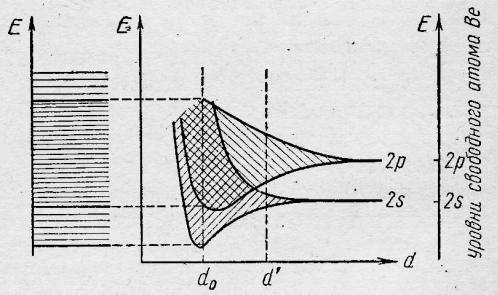
У атомов элементов главной подгруппы II группы на внешних ns – орбиталях по два электрона и, если бы р-зона не перекрывалась бы с s-зоной (рис. 10.3, 10.4, 10.5), последняя оказалась бы полностью заполненной и кристалл не имел бы выигрыша по энергии по сравнению с изолированными атомами. На рис. 10.5 видно, что 2N электронов атомов бериллия (при равновесном межатомном расстоянии d0) заполняют нижние орбитали s- и p- зон. Общее число занятых при 0оК МО орбиталей равно N, валентная зона являются sp-зоной, а зона проводимости представляет собой совокупность орбиталей верхней части sp- и р-зон.
Рис.10.5 - Расположение энергетических зон в кристалле бериллия d0– межатомное расстояние в кристалле бериллия
Из того же рисунка следует, что если бы расстояние между атомами бериллия было бы больше, чем d0 (например d1), то простоё вещество этого элемента относилось бы к полупроводникам. Аналогично кристаллу бериллия происходит заполнение МО орбиталей sp-зон в кристаллах магния и алюминия (в последнем случае электроны при 0оК занимают 1,5N МО орбиталей, имеющих минимальную энергию ).
220
