
Строение атома Нестеров
.pdfКак видно из таблицы 10.1, многие элементы имеют несколько полиморфных металлических модификаций, относительная стабильность которых зависит от параметров состояния системы. Если ограничиться только основными структурами металлов, то можно заметить что ∆Н фазовых переходов между ними не превышает 1 кДж/моль, т.е. термодинамическая стабильность полиморфных металлических модификаций данного элемента близка, а какая из них будет стабильной в тех или иных условиях, будет предопределятся структурой энергетических зон, степенью их заселённости, энергетическими характеристиками АО, принимавших участие в формировании этих зон, а также радиусами атомов, из которых образуется рассматриваемая система. В частности, формированию у металлов структуры ОЦК способствует большой радиус атома элемента и наличие у него электронов только на ns подуровне (простые вещества элементов главной подгруппы I группы, а также барий и радий). В то же время литий и натрий имеют высокотемпературные модификации с плотнейшей упаковкой, а стронций и кальций высокотемпературную модификацию типа ОЦК. Металлические модификации р-элементов, за исключением Sn, Bi и Ро, имеют структуры типа ГЦК или ГПУ (идеальные или искажённые).
Для подавляющего большинства d-металлов при с.у. характерны плотноупакованные структуры. Однако для металлов, у которых заполнение sd-зоны составляет 2,5 – 3 N молекулярных орбиталей из общего числа 6 N (простые вещества подгрупп ванадия и хрома), при с.у. стабильны модификации со структурой типа ОЦК (для V, Nb Ta модификации с другой структурой неизвестны). Отсюда следует, что если валентная зона составляет приблизительно 1/2 общего числа МО sd-зоны, то именно этот фактор является предопределяющим для формирования при с.у. структуры с более низким значением к.ч. по сравнению с плотнейшей упаковкой. У атома марганца семь электронов и, следовательно, в кристалле марганца N электронов, формально, располагается на разрыхляющих орбиталях, что
231
приводит к дестабилизации системы в целом и формированию при с.у. структуры, в которых атомы марганца имеют различные значения к.ч.. По мере роста температуры роль межэлектронного отталкивания в системе снижается и поэтому высокотемпературная модификация Mn имеет структуру близкую к ГЦК. Остаточные явления, связанные с межэлектронным отталкиванием, наблюдаются и для железа, но в связи с ростом заряда ядра, суммарная энергия sd-зоны у железа меньше, чем у Mn и поэтому в интервале температур от 0 до 1190оК у данного элемента стабильны модификации со структурой типа ОЦК, при 1190 – 1667оК фаза со структурой типа ГЦК, а выше 1667оК и вплоть до температуры плавления вновь стабильна фаза с объёмноцентрированной кубической структурой. Для простых веществ Co, Ni, Cu и Zn характерны только структуры с плотнейшей упоковкой.
Для Tc и Re sd-зона формируется из АО с большим, чем у Mn, значением главного квантового числа, т.е. имеет большую ширину (протяжённость). Одновременно с этим при переходе от Mn к Tc происходит
рост радиуса атома – оба |
фактора снижают роль межэлектронного |
отталкивания в системе, что |
предопределяет формирование у Tc и Re |
простых веществ со структурой ГПУ. Аналогичные рассуждения приводят к выводу, что простые вещества элементов второго и третьего переходных рядов ( за исключением Nb, Ta, Mo и W) будут иметь при суммарном числе электронов на (n -1)d и ns ≤ 8 низкотемпературную модификацию типа ГПУ, а при большем числе электронов на этих орбиталях – типа ГЦК ( за исключением Cd, имеющего структуру типа ГПУ).
Основываясь на выше перечисленных качественных критериях можно утверждать, что большинство простых веществ лантаноидов будут относиться к системам с плотнейшей упаковкой атомов. Аномалии структуры в этом ряду, также как в случае d-элементов, можно ожидать у простых веществ лантаноидов с fsзоной заполненной примерно наполовину
(Sm, Eu).
232
Предсказать тип структуры актиноидов тем сложнее, чем меньше период полураспада их изотопов. Это связано с тем, что радиоактивный распад атомов внутри системы неконтролируемо повышает её суммарную внутреннюю энергию и, следовательно, делает неопределёнными значения функций состояния системы.
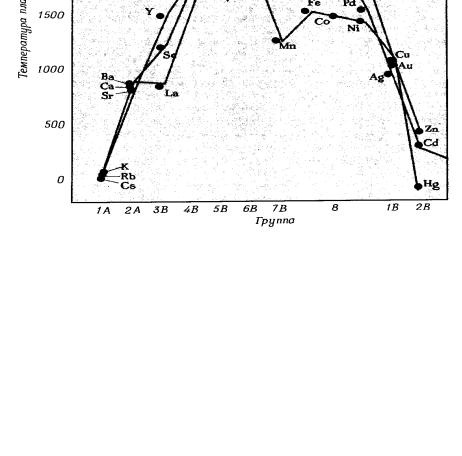
Электронное строение атомов элементов, входящих в состав кристаллов металлов, предопределяет степень и характер заполнения орбиталей энергетических зон, а, следовательно, энергию связи между атомами в кристаллах, физические, физико-химические и химические свойства рассматриваемых простых веществ. На рис.10.15 показана зависимость влияние степени заполнения sd-зоны на температуру фазового перехода типа твёрдая фаза – жидкость (т.е. на температуру, при которой кристаллическое вещество превращается в совокупность атомных кластеров).
Рис.10.15 - Зависимость температуры плавления металлов от положения элементов в больших периодах Периодической системы и числа валентных электронов.
233

Как следует из рисунка стабильность твёрдой фазы по сравнению с кластерами (при фиксированном числе молей атомов) максимальна у кристаллов, в состав которых входят атомы, имеющие по шесть валентных электронов (Cr, Mo, W). Согласно зонной теории, половина sd-зоны этих кристаллов занята электронами, т.е. все валентные электроны в этих системах формально располагаются на связывающих орбиталях. При этом, как увеличение, так и уменьшение числа валентных электронов способствует снижению стабильности твёрдой фазы по сравнению с жидкой. Это связано с тем, что дальнейшее увеличение числа электронов в системе приводит к тому, что часть электронов вынуждены размещаться на разрыхляющих орбиталях. Наибольшее влияние этот фактор, как было показано выше, оказывает на простые вещества, образованных атомами с семью валентными электронами (Mn, Tc). Если же на один атом в системе приходится меньше шести валентных электронов, то часть связывающих орбиталей свободна и суммарная энергия связей такой системы меньше чем у простых веществ элементов, атомы которых имеют по 6 валентных электронов (при фиксированном числе молей атомов).
Рис.10.16 - Зависимость энергии атомизации простых веществ от положения элементов в периодической системе.
234
Похожая картина наблюдается и для зависимости энергии атомизации простых веществ, от числа валентных электронов атомов, формирующих кристаллы металлов (рис.10.16).
Необходимо отметить, что в данном случае рассматривается сложный процесс превращения простого вещества в атомный пар и, следовательно, включающий в себя энергию необходимую для превращения твёрдой фазы в кластеры, энергию разрушения кластеров с образованием атомов или молекул и, а в последнем случае и энергию диссоциации этих молекул. В связи с этим зависимости представленные на рис. 10.15 и 10.16 описывают различные процессы и не обязаны совпадать в точности на качественном уровне. Тем не менее, приведённая выше общая картина сохраняется за исключением того, что в первом и втором переходных рядах сменяется лидер (максимальные значения Еиониз. имеют не хром и молибден, а, соответственно, ванадий и ниобий). Это свидетельствует о более высокой стабильности атомных кластеров последних элементов, по сравнению с такими же формами хрома и молибдена. Предполагается, что при высоких температурах зоны образованные из (n -1)d и ns АО расщепляются и тогда более низкая по энергии d-зона будет иметь 5 N молекулярных орбиталей. Для заполнения этой зоны на ½ потребуется 5 N электронов, что соответствует элементам побочной подгруппы V группы. По-видимому, с ростом значения главного квантового числа АО, формирующих энергетическую зону, температурный фактор оказывает всё меньшее влияние на относительную энергию d- и s-зон: разница в энергиях атомизации между Nb и Mo меньше, чем между V и Cr, а Ta по этой характеристике уже уступает W.
Таким образом, зонная теория на качественном, а в ряде случаев, и на количественном уровне удовлетворительно описывает свойства кристаллических фаз, в том числе металлов – в этом её основная ценность. Однако задача распределения и движения огромного числа электронов в периодически меняющемся поле атомов пока не может быть решена в общем
235
виде, и основные выводы данной теории основаны на различного типа приближениях. В связи с этим данную концепцию необходимо рассматривать как ещё один, несомненно, прогрессивный шаг, в понимании электронной и атомной структуры металлов, а не как истину в последней инстанции.
4.4 Координационная теория А.Вернера, современная трактовка ее основных понятий и положений 4.4.1 Предпосылки создания теории строения комплексов
Среди многочисленных неорганических соединений в XVIII веке
(например, Fe(CN)3·3KCN – 1702г., PtCl4·2KCl – 1763г., CoCl3·6NH3 – 1798г.) и, особенно, в XIX веке (например, 2PtCl2·4NH3 – 1828г., Fe(CN)3·2NaCN·NO·2H2O – 1849г., PtCl2·2CO – 1869г., Ni·4CO – 1888г.)
было получено немало веществ, состав которых к моменту становления и признания атомно-молекулярного учения (вторая половина XIXв.), в лучшем случае, удавалось представить как сочетание формул двух или большего числа хорошо известных веществ. Особенно много подобных "соединений высшего порядка" было синтезировано в виде двойных галогенидов, цианидов и аммиакатов (Например, HgJ2·2KJ, KCl·CuCl;
236

Fe(CN)2·4KCN, Fe(CN)3·Fe(CN)2·KCN; AgCl·2NH3, Cu(NO3)2·4NH3). Среди аммиакатов были выделены даже своеобразные "гомологические" ряды, гораздо более известные к тому моменту среди органических соединений:
PtCl4·nNH3 |
(n принимает целочисленные значения 0 и далее от 2 до 6) или |
CoCl3·nNH3 |
(n принимает целочисленные значения от 3 до 6). Однако |
известные на тот момент представления о строении веществ (теория химического сродства, валентности и сформировавшаяся на этом основании теория химического строения А.М.Бутлерова, которая была подробно изложена в 1864-1868гг. и прекрасно зарекомендовала себя применительно к органическим соединениям и простым неорганическим "соединениям низшего порядка") не позволяли объяснить даже состав необычных ("комплексных", т.е. составных) неорганических соединений, а тем более предсказать возможность их целенаправленного синтеза, обосновать их необычные физико-химические (разнообразную окрашенность, магнитные свойства, электропроводность растворов) и химические свойства (самые простые среди последних: изомеризованность некоторых комплексов и возможность аналитического обнаружения тех или иных составных частей, ионов).
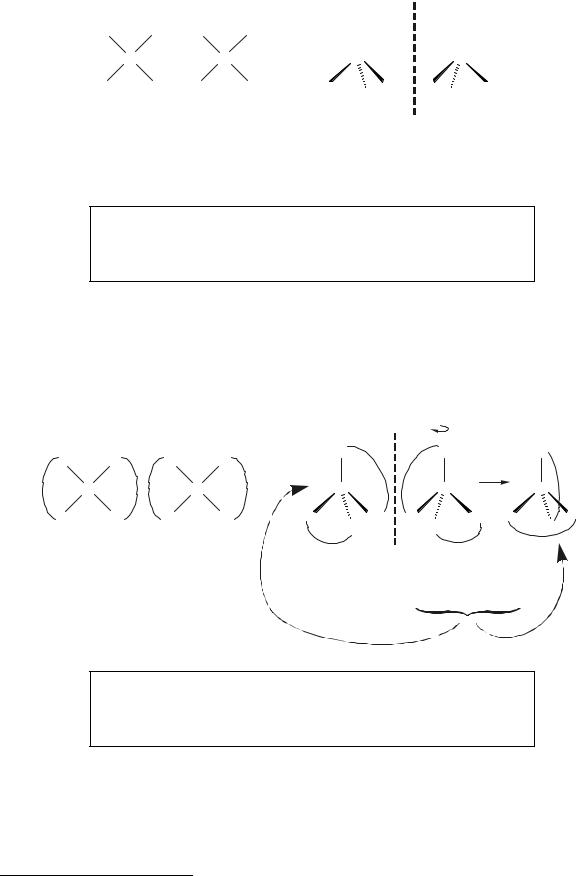
Теоретическими предпосылками создания координационной теории строения комплексов следует успехи в развитии теории Бутлерова строения органических соединений: обоснование четырехвалентности углерода и его тетраэдрического пространственного окружения в насыщенных углеводородах. Этот факт был обоснован при изучении явлений пространственной и оптической изомерии. В частности, тетраэдрическая координация атома углерода была доказана отсутствием пространственных цис/транс-изомеров C(R1)2(R2)218 (рис.4.17):
18 При условии квадратного окружения цис/транс-изомерия неизбежна. В данном случае R1 и R2 – два разных "одновалентных" радикала.
237
R1 |
R1 |
R1 |
R2 |
|
R1 |
|
R1 |
|
|||||
|
|
|
|
|
|
|
|||||||
С |
|
|
|
С |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
С |
R2 R2 |
С |
|
||||
R |
R |
2 |
R |
2 |
R |
1 |
R1 |
|
R2 |
R2 |
R1 |
||
2 |
|
|
|
|
|
|
|
||||||
цис- и транс- |
|
зеркальными изомерами |
|||||||||||
изомеры квадратного |
|
|
не являются, |
|
|||||||||
|
строения |
|
|
при повороте вокруг |
|||||||||
вертикальной оси совпадают
Рисунок 4.17Возможность возникновения изомеров среди частиц состава C(R1)2(R2)2 квадратного и тетраэдрического строения
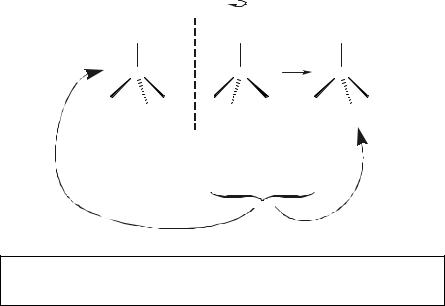
Пространственная изомерия при условии квадратного окружения была бы возможна и в случае связывания атома углерода с двумя одинаковыми крупными радикалами (RAB), каждый из которых соединяется с центральным атомом своими двумя разными – А и В (С(RAB)2):
A |
А |
B |
А |
|
А |
|
А |
|
А |
|
|
|
|
|
|
|
|
||||
С |
|
|
С |
|
С |
В В |
С |
|
С |
В |
B |
B |
A |
B |
А |
В |
В |
А А |
В |
||
|
|
|
|
|
|
|
|
|||
цис- и транс- |
зеркальные изомеры, |
|
|
|||||||
изомеры квадратного |
при повороте вокруг |
|
|
|||||||
|
строения; |
|
вертикальной оси не совпадают |
|
|
|||||
оптических изомеров нет |
|
|
|
|
|
|
|
|||
ни у одной из форм |
|
|
|
|
|
|
|
|||
Рисунок 4.18Возможность возникновения изомеров среди частиц состава C(RАВ)2 квадратного и тетраэдрического строения
В то же время, как видно из рисунка 4.18, при тетраэдрической координации соединения такого состава должны характеризоваться наличием стереохимической (оптической) изомерии.19
19 Оптические изомеры кроме некоторого отличия в физико-химических свойствах (разные Тпл, Ткип, растворимость) способны в растворах и в газовой фазе поворачивать плоскость, в которой распространяются электромагнитные колебания поляризованного света, либо по часовой, либо против движения часовой стрелки.
238
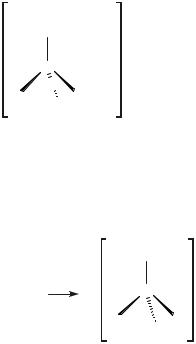
Другой более простой случай, обеспечивающий оптическую активность молекул с тетраэдрически координированным атомом углерода, - это наличие ассиметричного атома углерода, т.е. атома, окруженного четырьмя разными партнерами (другими атомами или атомными группировками):
|
|
R1 |
|
R1 |
|
|
|
R1 |
|
|
С |
|
С |
|
|
|
С |
R |
4 |
|
R2 R2 |
R |
4 |
R |
4 |
R3 |
|
R3 |
|
R3 |
|
R2 |
|||
|
|
|
|
|
|
зеркальные изомеры, при повороте вокруг вертикальной оси не совпадают
Рисунок 4.19 - Оптическая изомерия, обусловленная наличием ассиметричного атома углерода
Понимание роли ассиметричных атомов углерода в формировании оптической изомерии сыграло важную роль в развитии, как органической химии, так и теории строения комплексных соединений. Заслуга этого открытия принадлежит Я.Вант-Гоффу: в 1874г. впервые объяснены структуры оптически активных форм винной кислоты и амилового спирта, а также не имеющей стереохимических изомеров лимонной кислоты. Однако ему не удалось применить свои идеи к полученному на тот момент уже достаточно разнообразному кругу азотсодержащих органических соединений. Это объясняется ошибочным предположением (по аналогии с фосфором) о пятивалентности атома азота. В частности Вант-Гофф полагал, что в хлориде аммония атом азота непосредственно связан со всеми остальными атомами, которые в свою очередь располагаются в пяти вершинах куба. Другой точки зрения придерживался австрийский химик Альфред Вернер. Он полагал, что во многих органических соединений атом азота трехвалентен, причем "три его валентности направлены к вершинам
239
искаженного тетраэдра", а, если будут получены соединения типа NR1R2R3R4, то они должны быть оптически активны. Данное предположение вскоре нашло подтверждение. В 1891г. Ж.Ле Бель синтезировал хлористый изобутил-пропил-этил-метил-аммоний, в котором роль ассиметричного атома играл атом азота:
+
CH3
N
C4H7 
 C2H5 C3H5 .
C2H5 C3H5 .
Это окончательно убедило Вернера в том, что при взаимодействии аммиака с кислотами атом азота устанавливает дополнительную четвертую связь N–Н и в ионе аммония оказывается тетраэдрически координирован:
|
|
H |
+ |
|
|
|
|
NH3 + H+ |
H |
N |
H |
|
H |
||
|
|
||
|
|
|
4.4.2 Координационная теория А.Вернера:
состав комплексов, поведение в растворах, структура (изомерия)
Ранние модели строения комплексов, предложенные такими учеными, как Грем (1837г.), Клаус (1854г.), Бломстранд (1869г.) и Йоргенсен (1878г.) имеют в настоящее время только историческое значение. Наиболее разработанной была теория БломстрандаЙоргенсена. Ее важнейшие положения формулировались следующим образом:
1.Для некоторых элементов допускалась валентность выше, чем обычно принятая. Например, считалось, что галогенидные ионы могут быть трехвалентными, кислород – четырехвалентным, а азот – пятивалентным. Напротив, валентность центральных металлических атомов считалась традиционной.
240
