
Строение атома Нестеров
.pdf
атома Н, что обеспечивает относительную стабильность рассматриваемой молекулы.
В том случае, когда все системы атомы имеют подходящие для линейной комбинации р-орбитали, наряду с σ-МО, образуются многоцентровые связывающие, несвязывающие и разрыхляющие π-МО. Рассмотрим такие частицы на примере молекулы СО2 (рис.38.3 и 39.3).
Рис.38.3 Связывающие и разрыхляющие σ-МО молекулы СО2
Рис.39.3. Энергетическая диаграмма МО в молекуле СО2.
201
В этой молекуле σ-МО образуются при комбинации 2s и 2рх орбиталей атома углерода с 2рх орбиталями атомов кислорода. Делокализованные π-МО формируются за счёт линейной комбинации py и pz орбиталей всех атомов, входящих в состав молекулы. В результате этого образуется три пары π- МО с различной энергией: связывающие - πycвπzсв, несвязывающие - πyπz (по энергии соответствующие р-орбиталям атомов кислорода), и разрыхляющие -
πyразрπzразр.
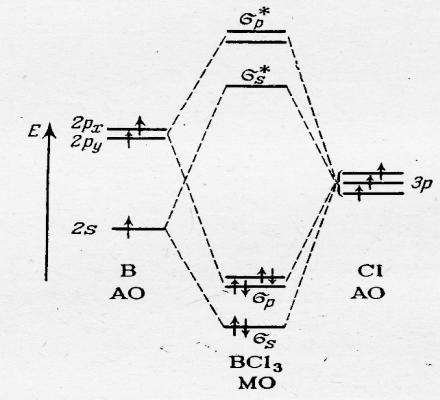
При рассмотрении молекул в рамках ММО ЛКАО часто используют сокращённые схемы описания частиц (рис.40.3). При формировании МО, например, в молекуле BCI3 достаточно указать только те АО, которые принимают реальное участие в линейной комбинации ( на рисунке не указаны одна из АО р-орбиталей бора и 6 из 9 р-орбиталей атомов хлора, линейная комбинация которых даёт несвязывающие МО)
Рис.40.3. МО в молекуле BCI3
202

Энергетическая диаграмма МО в молекуле СН4 представлена на рис.41.3.. Анализ электронного строения атома углерода показывает, что в связи с разнонаправленностью его 2р орбиталей образование в молекуле СН4 пятицентровых МО с участием этих АО невозможно по геометрически соображениям. В то же время, 2s орбиталь углерода в равной степени способна перекрываться с 1s орбиталями атомов водорода, в результате чего образуется пятицентровые σs и σs٭ МО. В случае комбинаций 2р и 1s орбиталей, число атомных функций в линейной комбинации равно только трём, т.е. энергия σ-МО в данном случае будет выше, чем у соответствующих
σs и σs٭.
Рис.41.3.. Энергетическая диаграмма МО молекулы СН4.
Различную энергию пятицентровой и трёхцентровых связывающих орбиталей подтверждают экспериментальные данные по потенциалам ионизации, которые различны для электронов удаляющихся с σs и с σx(σy. σz).
203
3.4.Cравнение МВС и ММО
Всвязи с тем, что оба обсуждаемых метода являются квантовомеханическими для них характерны общие черты в подходе к описанию химической связи:
1.Оба метода относятся к приближённым.
2.Для молекул, описание которых возможно в рамках обоих методов, МВС и ММО приходят к сходным результатам.
3.В обоих методах производится выбор волновых функций, обеспечивающих минимум энергии системы. Энергия связи в обоих методах предопределяется областями перекрывания орбиталей взаимодействующих атомов и значениями квантовых чисел этих орбиталей.
4.σ и π связи отличаются друг от друга как по способу перекрывания АО, так и по симметрии.
Указанная общность данных методов, строго говоря, распространяется лишь на двухцентровые связи, так как МВС рассматривает только такие связи (хотя на качественном уровне интерпретация делокализованных связей
вМВС допускается).
Каждый из обсуждаемых методов имеет свои достоинства и недостатки. ММО – более общий и универсальный, делокализация связей в пределах молекулы подтверждена экспериментально и, поэтому концепция этого метода не вызывает сомнения с физической точки зрения. ММО даёт возможность объяснять и предсказывать стехиометрию и геометрию молекул, на качественном и количественном уровне сравнивать энергии отдельных связей в системе и относительную стабильность форм при заданном составе частиц. При этом ММО не использует понятие «гибридизация АО», а ответы на все вопросы исходя из положения минимума на энергетической поверхности и изменения энергии системы при изменении межатомных расстояний углов и т.д.. Кроме этого ММО автоматически учитывает возбуждённое состояние частиц, что невозможно в
рамках МВС.
204
В то же время, зачастую химиков привлекает наглядность МВС, позволяющая как бы воочию представить процессы связанные с разрывом и образованием связей, с перегруппировкой атомов в системе (изомерия, конформация ит.д.). Кроме этого МВС на качественном уровне проще позволяет ориентироваться в колоссальном по объёму материале органической и неорганической химии. Но он часто уступает ММО по предсказательной способности, особенно когда необходимо оценить близкие по энергии состояния систем. Таким образом рассматриваемые методы не исключают, а очень удачно дополняют друг друга. Их нужно рассматривать как инструменты и делать между ними вывод в зависимости от задач, которые необходимо решить при выполнении конкретной работы.
Проектное задание По заданию преподавателя оцените применимость к предлагаемым
объектам : а)модели ковалентной связи по Льюису; б) МОЛЭП и его дополнений; в)МВС и г) ММО ЛКАО и сделайте вывод в каких случаях целесообразно применять ту или иную теорию.
В рамках самоподготовки по данному модулю рекомендуется обсудить следующие вопросы:
1.Является ли концепция Льюиса более общей или более частной по сравнению с теорией ионной связи?
2.Можно ли в рамках простейшего варианта теории ковалентной связи описывать химическую связь в молекулах или кристаллах соединений с преимущественно ионным характером связи?
3.Можно ли в рамках взглядов Льюиса обосновать такие свойства ковалентной связи как направленность и насыщаемость?
4.На качественном уровне, используя концепцию МВС, проанализируйте изменение длины и энергии связи в молекулах Г2 и Н – Г (Г = F, CI, Br, I) и сравните полученный результат с экспериментальными данными.
205
5.Попытайтесь выяснить причину низкой энергии активации процессов с участием фтора. Энергия активации аналогичных процессов с участием I2 будет выше или ниже? Почему?
6.На основе МВС рассмотрите механизм образования связи в молекулах типа ЭНх (Э = Li, Be, B, C, N, O, F). Как и почему меняется состав этих молекул в указанном ряду? Какие из этих молекул могут присоединять Н+? Почему?
7.Оцените возможность образования молекул NH5 , NCI5 и РCI5.
8.Молекула AsF5 стабильна, а AsH5 – не существует. Почему?
9.Опишите пространственное расположение атомов в молекулах BeCI2, BCI3,
CCI4, NCI3 и CI2O, укажите тип гибридизации орбиталей атома, соединённого с атомами хлора, его степень окисления и валентность.
10.Как и почему будет изменяться валентный угол в молекулах типа ЭН4 (Э
=C, Si, Ge, Sn, Pb)?
11.Опишите строение следующих частиц: HNO3, NO3-, CO32-, H3O+.
ТЕСТ РУБЕЖНОГО КОНТРОЛЯ № 3
1. |
Недостатком модели Льюиса является |
|
|
|
|
|
|||
1. |
Отсутствие |
обоснования |
с |
2. |
Электростатический |
характер |
|||
|
энергитической точки зрения |
|
|
концепции |
|
|
|
||
3. |
Трудности |
при |
определении |
4. |
Неопределённость |
понятия |
|||
|
состава большинства молекул |
|
|
«Связующая электронная пара» |
|
||||
2. |
По МОЛЭП геометрия молекул объясняется с точки зрения |
|
|
|
|||||
1. |
Миниминизации |
энергии |
2. |
Размеров |
центрального |
и |
|||
|
отталкивания электронных пар |
|
|
периферийных атомов |
|
|
|||
3. |
Состава молекул |
|
|
4. |
Кратности связей |
|
|
||
3. |
Роль неподелённых электронных пар в прогнозе структуры молекул заключается в том |
||||||||
что |
|
|
|
|
|
|
|
|
|
1. |
Неподелённые |
электронные |
пары |
2. |
При |
одинаковом |
|
числе |
|
|
не влияют на строение молекулы |
|
неподелённых электронных |
пар |
|||||
|
|
|
|
|
|
структуры |
молекул |
одинаковы, |
|
|
|
|
|
|
|
независимо от их состава |
|
|
|
3. |
Число неподелённых |
электронных |
4. |
Изменение |
числа неподелённых |
||||
|
пар определяет число связей в |
|
электронных пар центрального атома |
||||||
|
молекуле фиксированного состава |
|
изменяет состав молекул и значение |
||||||
|
|
|
|
|
|
валентных углов |
|
|
|
4. |
Строение в виде плоского треугольника имеет молекула |
|
|
|
|||||
1. |
SOCI2 |
|
|
2. |
|
NH3 |
|
|
|
3. |
PCI3 |
|
|
4. |
|
BF3 |
|
|
|
206
5. Возможность образование ковалентной связи по МВС объясняется
1. |
Образованием электронной пары |
2. |
Снижением энергии системы за счёт |
|
|
|
перекрывания атомных электронных |
орбиталей
3.Наличием у атомов неподелённых 3. Стремлением атомов к завершению
|
электронных пар |
|
электронного уровня по типу октета |
|||
6. По МВС геометрия молекул объясняется с точки зрения |
|
|
||||
1. |
Понятия «гибридизация атомных 2. |
Размеров |
центрального |
и |
||
|
орбиталей» с учётом значений n |
периферийных атомов |
|
|||
|
орбиталей |
валентного |
уровня |
|
|
|
|
атомов. |
|
|
|
|
|
3. |
Состава молекул |
4. |
Кратности связей |
|
||
7. |
Роль неподелённых электронных пар в прогнозе структуры молекул заключается в том |
|||||
что |
|
|
|
|
|
|
1. |
Неподелённые электронные |
пары 2. |
При |
одинаковом |
числе |
|
|
способны |
изменять угол |
между |
неподелённых электронных |
пар |
|
|
связями. |
|
|
структуры |
молекул одинаковы, |
|
|
|
|
|
независимо от их состава |
|
|
3.Число неподелённых электронных 4. Увеличение числа электронных пар
|
пар определяет число связей в |
|
центрального |
атома |
препятствует |
|||||||
|
молекуле фиксированного состава |
|
гибридизации атомных орбиталей |
|||||||||
8. |
sp2 гибридизация центрального атома во всех трёх молекулах |
|
|
|||||||||
1. |
|
O3, BeCI2, SOCI2 |
|
|
2. |
|
C2H4, H2CO, NH3 |
|||||
3. |
|
CO2, PCI3 , BCI3 |
|
|
4. |
|
SO2, BF3, SO3 |
|
||||
9. |
Величины «валентность» и «степень окисления» атома |
|
|
|
||||||||
1. |
тождествены |
|
|
|
|
2. |
отличаются по знаку и всегда равны |
|||||
|
|
|
|
|
|
|
|
|
по абсолютному значению |
|||
3. |
не сводятся друг к другу, так как |
4. |
равны номеру группы |
|
||||||||
|
относятся |
к |
разным |
теориям |
|
|
|
|
|
|||
|
химической связи |
|
|
|
|
|
|
|
|
|||
10. Принципиальное отличие ММО от МВС заключается |
|
|
|
|||||||||
1. |
В |
использования |
вариационного |
2. |
В |
отказе |
от |
локализации |
||||
|
метода |
|
|
|
|
|
|
электронной |
плотности только в |
|||
|
|
|
|
|
|
|
|
|
межъядерном пространстве |
|||
3. |
ММО |
не |
|
рассматривает |
4. |
ММО не даёт представления о |
||||||
|
перекрывание |
АО |
в |
качестве |
|
строении молекул |
|
|||||
|
причины |
образования химических |
|
|
|
|
|
|||||
|
связей |
|
|
|
|
|
|
|
|
|
|
|
11. Стабильность частиц возрастает в ряду |
|
|
|
|
|
|||||||
1. |
О2, О2-, О22- |
|
|
|
|
2. |
О22-, О2-, О2 |
|
|
|||
3. |
О2, О2+, О22+ |
|
|
|
|
4. |
О22+, О2+, О2 |
|
|
|||
12. Порядок связи в двухатомной молекуле определяется |
|
|
|
|||||||||
1. |
Разность |
чисел |
связывающих |
и |
2. |
Разность |
чисел |
электронов |
||||
|
разрыхляющих |
|
электронов, |
|
валентных уровней атомов, делённая |
|||||||
|
делённая на 2, |
|
|
|
|
|
на 2, |
|
|
|
||
3. |
Как |
сумма |
электронов |
на |
4. |
Как число электронов на σ- |
||||||
|
связывающих орбиталях, |
делённая |
|
связывающих МО |
|
|||||||
|
на 2 |
|
|
|
|
|
|
|
|
|
|
|
13.В рамках ММО ЛКАО не описываются |
|
|
|
|
|
|||||||
207
1. |
Молекулы |
ароматических |
2. |
Молекулы переходных элементов |
|
соединений |
|
|
|
3. |
Многоцентровые связи |
4. |
Никакие молекулы с использованием |
|
|
|
|
|
представлений о гибридизации |
14. В гетероатомных молекулах больший вклад в связывающие орбитали вносят |
||||
1. |
АО менее |
электроотрицательного |
2. |
АО более электроотрицательного |
|
атома |
|
|
атома |
3.АО обоих атомов в равной степени 4. АО менее электроотрицательного
|
участвуют ы формировании МО |
|
атома при формировании π-МО |
15. В каком случае все три молекулы обладают парамагнитными свойствами? |
|||
1. |
O3, О2,СО |
2. |
В2, С2, СН4 |
3. |
N2, O2 , F2 |
4. |
NO, О2, В2 |
Критерий оценки:
Задания 2,4,8,9,12 и 14 оцениваются в 2 балла Задания 1,3,5,7,10 и 11 оцениваются в 3 балла Задания 6, 13 и 15 оцениваются в 4 балла.
Оценка при выполнении теста: 20 – 28 баллов – удовлетворительно 29 – 36 баллов – хорошо 37 – 42 балла - отлично.
Список литературы:
1.Карапетьянц М.Х., Дракин С.И. Строение вещества, М., «Высшая школа»,1970, 180 с.
2.Коттон Ф., Уилкинсон Дж., Современная неорганическая химия, т.1,
М., «Мир», 1968, 225 с.
3.Дей К., Селбин Д., Теоретическая неорганическая химия, М., «Химия», 1971, 416 с.
4.Химия и периодическая таблица, под ред. К.Сайто, М., «Мир», 1982,
320с.
5.О.С. Зайцев, Общая химия, М., «Высшая школа», 1983, 248 с.
6.А. Барнард, Теоретические основы неорганической химии, М.,
«Мир», 1968, 362 с.
7. Краснов К.С., Молекулы и химическая связь, М., «Высшая школа», 1977, 280 с.
208
8. Ахметов Н.С., Общая и неорганическая химия, М., «Высшая школа»,1981, 679 с.
9.Н.Н. Рунов, Строение атомов и молекул, М.,«Просвещение»,1987,143
с.
10.Я.А.Угай «Общая химия» М., «Высшая школа», 1977, 408 с.
11.Э.Картмел, Г.В.А.Фоулс «Валентность и строение молекул», М., «Химия», 1979, 360 с.
209
Модуль №4
Теория связи в металлах и комплексных соединениях
Комплексная цель
В результате изучения данного модуля необходимо выявить зависимости между типом химической связи в металлах, их кристаллохимическим строением и свойствами, а также познакомиться с некоторыми историческими предпосылками выделения комплексных (координационных) соединений в особую группу веществ, состав, структура и свойства которых казались поначалу необычными, уникальными. Важно усвоить, как анализом их физико-химических свойств, при отсутствии структурных методов исследования была получена информация, послужившая основой для разработки координационной теории А.Вернера. Вместе с тем предстоит понять, что по мере накопления структурных данных, по мере систематизации свойств широкого круга веществ особенности собственно координационных соединений становятся все менее четкими, круг этих веществ все более переплетается с традиционными неорганическими, элементорганическими соединениями.
В заключительной части модуля предстоит познакомиться с "послевернеровскими" теориями строения комплексов, основанными как на электронной модели строения атома (простая электростатическая теория и правила Сиджвика), так и на современной квантово-механической теории: метод валентных связей (МВС), теория кристаллического поля (ТКП) и метод молекулярных орбиталей (ММО). Нужно разобраться в достоинствах и недостатках соответствующих теорий строения координационных соединений, понять границы их применимости к анализу экспериментальных фактов. Важно, не вдаваясь глубоко в математический аппарат МВС, ТКП и ММО, научиться применять итоговые качественные схемы для сопоставления структурных особенностей (предпочтительные
210
