
Строение атома Нестеров
.pdf
В первом приближении энергию отталкивания всех связующих пар можно считать одинаковой, тогда их расположение в пространстве будет симметричным ( рис.3.3).
Иную конфигурацию будут иметь молекулы, у которых центральный атом имеет неподелённые электронные пары (рис.4.3) и электрические поля которых также необходимо учитывать при расчёте минимума энергии системы. Из рис.4.3 следует, что при наличии у атома А неподелённой электронной пары, последняя занимает одну из вершин исходного полиэдра. Так как электрическое поле этой пары не скомпенсировано вторым ядром, его напряжённость выше по сравнению с напряжённостью электрического поля связующей парой выше, что приводит к сближению связующих пар в пространстве, т.е к уменьшению угла связи (рис.5.3).
Рис.4.3. Распределение в пространстве связующих и неподелённых электронных пар вокруг центрального атома А. Число неподелённых электронных пар центрального атома указано при символе Е, обозначающего одну такую пару.
151
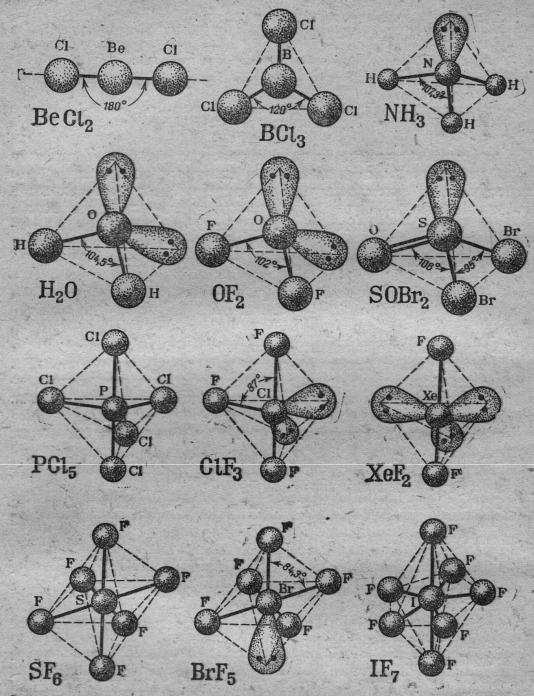
Рис.5.3. Форма молекул и углы между связями для различного числа связующих и неподелённых электронных пар у центрального атома. Неподелённые электронные пары изображены в виде вытянутой фигуры, дающей представление об области их локализации в пространстве вокруг центрального атома. Сплошными линиями обозначены связывающие эектронные пары.
152
Результаты расчёта по МОЛЭП могут быть уточнены с помощью трёх дополнений:
1.Напряжённость электрического поля в области двойной связи больше, чем в области одинарной.
2.Чем выше электоотрицательность периферийных атомов, входящих в состав молекулы, тем больше локализация неподелённых электронных пар в области центрального атома и тем больше их влияние на валентные углы в
молекуле. Например, в однотипных молекулах H2O и OF2 (рис.5.7) валентные углы равны 104,5о и 102о, соответственно.
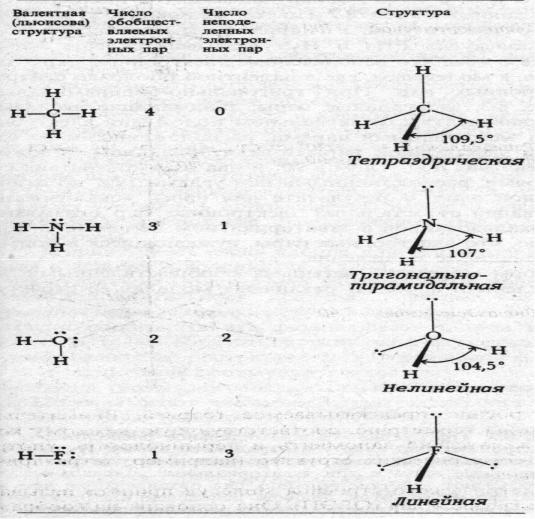
3.С ростом числа неподелённых электронных пар центрального атома их роль в системе возрастает (рис.6.3).
Рис.6.3. Структуры молекул с общим числом электронных пар у партнёров атома водорода равным четырём.
153
3.2.Основные принципы описания молекул в квантовой химии и метод валентных связей (МВС).
3.2.1. Основные принципы описания молекул в квантовой химии
Теоретическое обоснование энергетической целесообразности образования химической связи между изолированными атомами стало возможным только после того, как были разработаны способы описания движения микрочастиц, т.е. после открытия законов квантовой механики. В основе данного обоснования лежат следующие принципы квантовомеханических расчётов:
1.Решение уравнения Шредингера с использованием приближённых волновых функций.
Уравнение Шредингера, описывающее поведение электрона в атоме
водорода имеет вид: |
|
|
▼2ψ + 8π2m/h2(E – V)ψ = 0 |
|
(1.3) |
где ▼2 – оператор Лапласа и, |
следовательно, ▼2ψ = ∂ψ/∂х2 + ∂ψ/∂y2 |
+ ∂ψ/∂z2; |
Е – полная энергия системы, V – её потенциальная и (E – V) кинетическая энергия, |
||
соответственно. |
|
|
Это уравнение может быть представлено в виде: |
|
|
{ (- h2/8π2m)▼2 + V}ψ = Eψ |
или сокращённо: Ĥψ = Eψ |
(2.3) |
где Ĥ – оператор Гамильтона, определяющий операцию или последовательность операций, производимых над функцией ψ.
Если умножить обе части последнего уравнения на ψ и проинтегрировать по всему пространству ( от -∞ до +∞ по каждой из координат), то можно получить выражение, описывающее полную энергию системы:
∫ ψĤψ dv / ∫ ψ2dv = E (3.3 )
Полученное соотношение является одним из основных уравнений квантовой химии.
Так как точный вид ψ-функций известен только для одноэлектронных систем, в квантовой химии используют их приближённые выражения. При
154
этом приближённые значения функций ψ определяют с помощью вариационного метода. Оптимальную функцию в рамках этого метода находят путём последовательного приближения, постулируя, что ближе к истинному выражению будет тот вид ψ, подстановка которого в уравнение
(3.3), позволит получить минимальное значение Е. В |
подавляющем |
большинстве случаев функцию ψ выражают в виде суммы: |
|
Ψ = с1φ1 + с2φ2 + с3φ3 + ………. + сnφn |
(4.3) |
где φ – функция зависящая от координат, с- коэффициенты |
|
Коэффициенты сi подбираются с учётом основного принципа рассматриваемого метода – принципа минимальной энергии системы:
∂Е/∂с1 = 0; ∂Е/∂с2 = 0; ∂Е/∂с3 = 0; …………… ∂Е/∂сn = 0. |
(5.3 ) |
2. Расчет энергии молекул и молекулярных ионов. |
|
Изменение энергии в системе состоящей из двух ядер показано на рис.7.3 При расчете энергии в подобных случаях за нулевую принимается энергия системы, в которой невозбуждённые атомы удалены друг от друга на бесконечно большое расстояние. При сближении атомов водорода между ними возникают силы притяжения, что приводит к снижению энергии системы в целом. Изменение энергии системы наблюдается то тех пор, пока силы отталкивания (резко возрастающие при сближении ядер атомов на расстояние меньше ¾ суммы радиусов атомов) не скомпенсируют силы притяжения. Таким образом, энергия системы складывается из суммарной полной энергии электронов и потенциальной энергии взаимодействия ядер. В связи с этим зависимость энергии системы от расстояния между центрами взаимодействующих атомов имеет минимум, который характеризует наиболее стабильное состояние бинарной молекулы. В невозбуждённой молекуле при Т > 0оК ядра атомов совершают колебания относительно равновесного расстояния re (рис.7.3), что увеличивает энергию системы на некоторую величину, которую обозначим через ε0. Тогда экспериментально найденная энергия связи (количество энергии
155

выделяющейся при образовании одной связи данного типа в рассматриваемой молекуле) определяется соотношением Есвязи = Еmin - ε0.
Рис.7.3. Теоретическая кривая изменения энергии связи в молекуле Н2 в зависимости от расстояния между ядрами атомов
Рис. 8.3. Экспериментальная и теоретические кривые зависимости энергии в молекуле Н2 от расстояния между ядрами атомов. Ек – расчёт на основе модели кулоновского взаимодействия (модель Льюиса); Е и Еас. – рассчитаны с использованием симметричной и антисимметричной волновых функций, соответственно; Еэкс. – экспериментальные данные.
156
Как правило, в литературе при описании молекулярного вещества приводятся значения энергии одного моля рассматриваемых связей и значения re. Экспериментальные кривые (рис.8.3 кривая Еэкс.) определяют, используя данные молекулярных спектров.
Как отмечалось выше, квантовомеханические расчёты энергии молекулярных систем для различных значений (r) проводят с использованием уравнения (3.3). Критерием правильности такого расчёта является степень совпадения теоретической и экспериментальной кривых Е = f(r) в рассматриваемой системе.
3.2.2.Описание механизмов образования химических связей в рамках МВС
В настоящее время принято считать, что в основе одного из методов квантомеханического расчёта молекул лежат работы немецких учёных Гейтлера и Лондона, которые в 1927 году впервые применили его для расчёта энергии электронов в молекуле водорода. В дальнейшем указанный метод был развит в работах Слейтера, Ван Флека, Полинга и получил название
метода валентных связей (МВС) или локализованных электронных пар.
Рассмотрим принципы данного метода на примере описания молекулы Н2. Данная молекула представляет собой совокупность двух ядер Нa и Hb и двух электронов, пространственные координаты которых обозначим 1 и 2 (рис.9.3). Тогда потенциальная энергия для молекулы Н2 будет определятся соотношением:
V = e2/Rab + e2/r12 - e2/ra1 - e2/ra2 - e2/rb2 - e2/rb1 |
(6.3) |
В качестве волновой функции электронов молекулы водорода Гейтлер и Лондон использовали волновую функцию электрона в атоме водорода в 1s –
состоянии, т.е. функцию вида : ψ1s = e-r/a/√πa3 |
(7.3) |
где r – расстояние электрона от ядра; а – радиус первой боровской орбиты.
157

Рис.9.3. Условная схема распределения частиц в молекуле водорода по Гейтлеру и Лондону.
Обозначим волновую функцию электрона в первом изолированном атоме ψa(1), а во втором - ψb(2). Если атомы находятся на значительном расстоянии друг от друга, то состояние их электронов остаётся неизменным и волновая функция такой системы, состоящей из двух изолированных атомов, может быть записана в виде: ψ = ψa(1) ψb(2). Поскольку электроны неразличимы, то можно считать, что с равной вероятностью электрон (1) движется в поле ядра (b) , а электрон (2) в поле ядра (a), тогда волновая функция системы: ψ = ψa(2) ψb(1), т.е. получаем состояние системы с той же энергией. Обе из приведённых функций предусматривают движение каждого из электронов в поле конкретного ядра, что не отвечает концепции общей электронной пары. Так как в молекуле оба электрона должны одновременно находиться как в поле ядра (a), так и в поле ядра (b) волновая функция для молекулы, учитывающая указанное выше состояние электронов, должна быть линейной комбинацией двух ранее рассмотренных функций:
Ψм = с1 ψa(1) ψb(2) + с2ψa(2) ψb(1) |
(8.3) |
Тогда вероятность нахождения электронов в пространстве между ядрами:
(с1 ψa(1) ψb(2))2 + (с2ψa(2) ψb(1))2 + 2с1с2ψa(1) ψb(2) ψa(2) ψb(1) (9.3)
158
Т.е. в данном случае происходит не простое сложение вероятностей, а их интерференция (усиление), в результате чего электронная плотность между ядрами оказывается более высокой, чем простая сумма этих плотностей. Вариационный метод даёт два решения системы уравнений (5.3) : с1 = с2
ис1 = - с2, т.е. возможны два варианта волновой функции – симметричная ( S)
иантисимметричная (А) – ΨS и ΨA:
ΨS = сS[ ψa(1) ψb(2) |
+ ψa(2) ψb(1) ] |
(10.3) |
ΨA = сA[ ψa(1) ψb(2) |
- ψa(2) ψb(1)] |
(11.3) |
Для первой из функций электроны и ядра системы неразличимы (если их поменять местами, т.е. переставить индексы (1) и (2) или (a) и (b), то функция ΨS останется неизменной), поэтому её называют симметричной относительно координат, как ядер, так и электронов. В то же время, если провести указанную перестановку для функции ΨA произойдёт изменение её знака, т.е. функция ассиметрична по отношению координат частиц, образующих молекулу водорода.
Физический смысл симметричной и антисимметричной волновых функций становится понятным, если принять во внимание, что состояние электрона в любой системе предопределяется не только характеристиками орбитали, но и значением спинового квантового числа. В то же время при выводе функции (8.8) значение спинового квантового числа электронов не учитывалось (так же как в любых квантовомеханических расчётах по методу Шрёдингера). Тогда, учитывая принцип Паули, согласно которому в стабильной системе не могут сосуществовать два электрона с одинаковыми значениями всех четырёх квантовых чисел, можно сделать вывод о том, что электроны, образующие общую электронную пару для достижения системой минимума энергии должны иметь противоположные значениями своих спиновых квантовых чисел. Это связано с тем, что электроны этой пары располагаются в молекуле на одной орбитале (в одной и той же области пространства) и, следовательно, значения остальных квантовых чисел для них совпадают. Если же принцип Паули не выполняется, энергия системы
159

при образовании общей электронной пары из электронов с одинаковыми значениями должна повышаться по сравнению с исходным состоянием, т.е. в этом случае самопроизвольное образование химической связи невозможно. Последний вывод можно доказать математически, используя уравнение (9.3):
Ψ2S = (с1 ψa(1) ψb(2))2 + (с2ψa(2) ψb(1))2 + 2с1с2ψa(1) ψb(2) ψa(2) ψb(1) Ψ2A = (с1 ψa(1) ψb(2))2 + (с2ψa(2) ψb(1))2 - 2с1с2ψa(1) ψb(2) ψa(2) ψb(1)
Из уравнений, что симметричная волновая функция описывает состояние системы, характеризующееся увеличением электронной плотности в межядерном пространстве ( атомные волновые функции складываются) и, следовательно, электроны в общей паре имеют различные значения спиновых квантовых чисел. Как отмечалось выше электронная плотность в межядерном пространстве в этом случае больше, чем сумма электронных плотностей изолированных атомов – этот вывод описывается в виде терминов «перекрывание атомных электронных орбиталей» или «перекрывание волновых функций электронов», что указывает на изменение состояния электронов в процессе образования общей электронной пары.
Рис.10.3. Изменение электронной плотности в системе, состоящей из двух атомов водорода в процессе формирования общей электронной пары из электронов (а) – с антипараллельными и (б) – с параллельными спинами.
В то же время антисимметричная волновая функция описывает состояние системы, при котором сближение ядер атомов приводит к росту энергии системы ( отрицательный знак перед последним слагаемым ряда), т.е. между электронами, формально способными образовать химическую связь, при сближении атомных ядер возрастают силы отталкивания. Такое изменение
160
