
Строение атома Нестеров
.pdfТаблица 1.2
Связь между разрешенными значениями главного и орбитального квантовыми числами
Численное значение |
|
|
|
|
|
главного квантового числа n |
1 |
2 |
3 |
4 |
|
(номер энергетического |
|||||
|
|
|
|
||
уровня) |
|
|
|
|
|
|
|
|
|
|
|
Разрешенный набор |
s |
s, p |
s, p, d |
s, p, d, f |
|
подуровней |
|||||
|
|
|
|
||
|
|
|
|
|
|
Обозначения |
1s |
2s, 2p |
3s, 3p, |
4s, 4p, 4d, |
|
подуровней |
3d |
4f |
|||
|
|
||||
|
|
|
|||
|
|
|
|
|
– Магнитное квантовое число m может принимать целочисленные значения в интервале от –l до +l, включая ноль:
m = –l … 0 … +l.
Магнитное квантовое число входит в угловую составляющую волновой функции и влияет на расположение (ориентацию) электронного облака в пространстве. Поскольку каждое электронное облако представляет собой атомную орбиталь, то число разрешенных значений m соответствует числу возможных ориентаций электронных облаков (числу разрешенных АО).
С учетом вышесказанного можно предложить еще одно определение для атомной орбитали. Это не только "пространство, заполненное движущимся" (электронное облако), но и "квантовая возможность"
двигаться в поле данного ядра по конкретному волновому закону, определяющемуся сочетанием квантовых чисел n, l и m (эти квантовые числа полностью определяют волновую функцию электрона). Такая "квантовая возможность" подразумевает, в том числе, и такое понятие как
"пустая атомная орбиталь". |
|
Из правил квантования следует, что возможные значения |
m |
ограничены выбранным значением l, спектр которых, в свою очередь, определяются выбором главного квантового числа n.
31

Таблица 1.3
Взаимосвязь между тремя квантовыми числами
Главное |
Разрешенные значения |
|
Число |
Обозначения |
||
квантовое число |
l (энергетические |
Разрешенные |
атомных |
(названия) |
||
(энергетичес- |
подуровни) |
значения m |
орбиталей |
АО |
||
кий уровень) |
|
(АО) |
||||
|
|
|
|
|||
|
|
|
|
|
|
|
n = 1 |
l = 0 |
0 |
одна |
|
1s |
|
(1s – подуровень) |
|
|||||
|
|
|
|
|
||
|
l = 0 |
|
|
|
|
|
n = 2 |
(2s – подуровень) |
0 |
одна |
|
2s |
|
l = 1 |
–1; 0; +1 |
три |
2рx;2py;2pz |
|||
|
||||||
|
(2p – подуровень) |
|
|
|
|
|
|
l = 0 |
|
|
|
|
|
|
(3s – подуровень) |
0 |
одна |
|
3s |
|
|
l = 0 |
|
||||
n = 3 |
–1; 0; +1 |
три |
3рx; 3py; 3pz |
|||
(3p – подуровень) |
||||||
|
–2; –1; 0; +1; +2 |
пять |
3dxy; 3dxz; |
|||
|
l = 0 |
|
|
3dyz; 3dx2–y2; |
||
|
(3d – подуровень) |
|
|
3dz2 |
||
|
|
|
|
|||
|
l = 0 |
|
|
|
|
|
|
(4s – подуровень) |
|
|
|
|
|
|
l = 0 |
0 |
одна |
|
4s |
|
n = 4 |
(4p – подуровень) |
–1; 0; +1 |
три |
4рx; 4py; 4pz |
||
l = 0 |
–2; –1; 0; +1; +2 |
пять |
4dxy |
и т.п. |
||
|
||||||
|
(4d – подуровень) |
–3;–2;–1;0;1;2;3 |
семь |
4fxyz |
и т.п. |
|
|
l = 0 |
|
|
|
|
|
|
(4f – подуровень) |
|
|
|
|
|
|
|
|
|
|
|
|
Из результатов, приведенных в таблице, видно, что на s–подуровнях первого, второго и последующих уровней имеется только по одной атомной орбитали (т.к. для орбиталей s–подуровня возможно только одно значение магнитного квантового числа). Они отличаются друг от друга размерами (и числом максимумов на графиках радиального распределения электронной плотности (рис.1.6, 1.8)).
32

Рис. 1.8 – Графики радиальных составляющих волновой функции для водородоподобных орбиталей первого, второго и третьего энергетических уровней.
Из рис.1.8 следует, что, 2р-орбиталь характеризуется меньшим орбитальным радиусом, чем 2s-орбиталь. Однако на графике для радиального распределения 2s-облака имеется дополнительный внутренний максимум. Это говорит о том, что 2s-электрон довольно часто бывает вблизи ядра и за счет такого проникновения в область 1s-облака усиливает свое притяжение к ядру, 2s-орбиталь становится энергетически более выгодной. В третьем энергетическом уровне максимальный эффект проникновения, опять же, демонстрируют электроны 3s-орбитали. Хуже всего ядро атома будет удерживать электроны на непроникающих 3d-орбиталях – эти орбитали лучше заэкранированы от ядра внутренними электронными облаками и будут иметь самую высокую энергию в третьем энергетическом уровне. Более того, как будет показано при обсуждении правил В.Клечковского, 3d-орбитали оказываются более высоколежащими, чем даже 4s-орбиталь, которая за счет внутренних максимумов обеспечивает более сильное взаимодействие с ядром атома (иными словами, эффективный заряд ядра, действующий на 4s-электроны, оказывается выше, чем для 3d-электронов).
На р–подуровнях разрешены три АО: три значения m разрешают три разных ориентации р–электронных облаков в пространстве вокруг ядра. Как
33
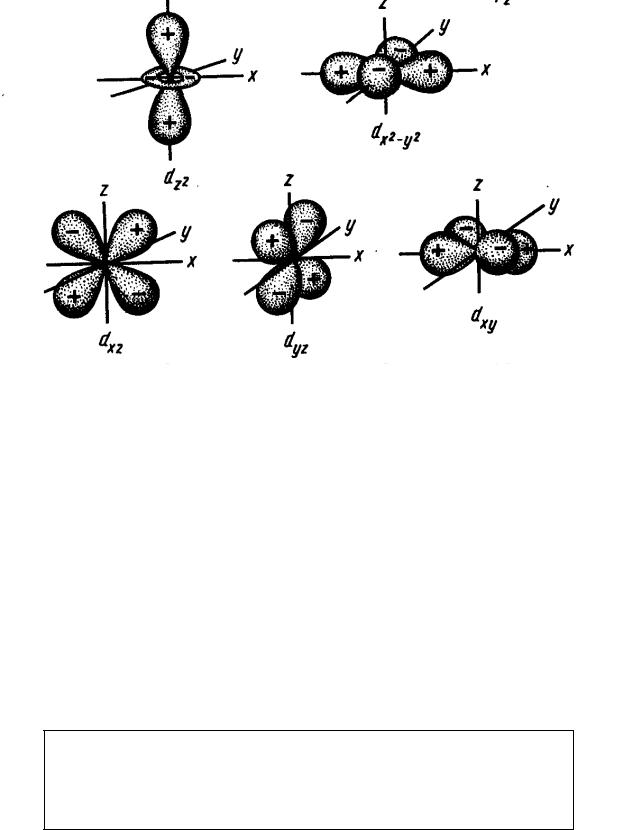
видно из их названий, они располагаются своими лепестками вдоль прямоугольных осей координат (рис.1.9).
Рис. 1.9 – Графики для квадратов угловых составляющих волновых функций, передающих форму и взаимное расположение в пространстве s-, p- и d- водородоподобных орбиталей (показаны знаки волновых функций).
На d–подуровнях разрешены пять АО. У них более сложная форма, поэтому в названиях d–орбиталей обычно приходится указывать две
34
координатных оси, лежащих в одной плоскости с лепестками орбиталей.
Орбитали ndxy |
ndx2–y2 лежат в плоскости x0y, |
но повернуты друг |
|
относительно друга на 45° (лепестки орбиталей |
ndx2–y2 |
располагаются вдоль |
|
осей координат, а |
лепестки орбиталей |
ndxy |
– по биссектрисам |
координатных углов). Так же, как и в случае s–орбиталей, с увеличением n растут размеры облаков, меняется число максимумов на графиках R2·4πr2. Напомню, что орбитальный радиус находится как расстояние от ядра до самого дальнего максимума (самого дальнего "сгустка" электронного облака).
Таким образом, сочетание разрешенных значений трех квантовых чисел (n, l, m) полностью определяют все свойства атомных орбиталей (электронных облаков). После подстановки в соответствующие формулы они формируют закон движения электрона в поле ядра и других электронов (Ψ). Однако, изучение спектральных и ряда других свойств атомов в магнитном поле привело к выводу, что электроны обладают еще одним "собственным", "внутренним" свойством, не зависящим от влияния других частиц. Это свойство имеет два неизменных значения (квантуется). Поначалу был высказано предположение, что этим свойством является способность электрона вращаться, как волчок вокруг собственной оси. Для описания такого поведения было введено спиновое квантовое число (спин – "веретено") – s (или mS): +½ и -½. Позднее было показано, что для количественного описания эффектов взаимодействия электрона с магнитным полем требовалась бы скорость вращения, превышающая скорость света. Строгое обоснование этому свойству электрона может быть дано на основе теории относительности, но представление о вращении электрона по-прежнему используется как удобный, наглядный образ.
Итак, для полного описания всех известных на настоящий момент свойств электрона, для описания электронного строения атомов необходимо использовать четыре квантовых числа: n, l, m, s.
35
1.4 Правила заполнение электронами атомных орбиталей
Применяя законы термодинамики, следует ожидать, что при низких температурах электроны будут самопроизвольно заселять АО с минимальной энергией (принцип минимума энергии для основного состояния атома). Как было показано ранее (стр.23), точно определить энергию АО в многоэлектронном атоме невозможно, но, поскольку энергия электрона зависит от главного и орбитального квантовых чисел, то были предложены эмпирические правила, которые позволяют сравнить энергии АО, не рассчитывая их (правила
В.Клечковского):
•минимальную энергию имеет атомная орбиталь с минимальной суммой n+l;
•если для нескольких атомных орбиталей эта сумма совпадает, то меньшую энергию имеет орбиталь с меньшим значением
главного квантового числа n.
Применим эти правила для сравнения атомных орбиталей первых четырех энергетических уровней.
Как видно из таблицы 1.4, в первых двух энергетических уровнях энергия атомных орбиталей меняется достаточно просто. А вот затем в конкуренцию с орбиталями третьего энергетического уровня "включается" 4s–орбиталь. Применяя правила В.Клечковского, нетрудно понять, что 4d– и 4f–орбитали реально имеют более высокую энергию, чем некоторые орбитали пятого и даже шестого энергетического уровня! (не приведены в таблице и на энергетической схеме). Все это косвенно указывает на то, что постепенно уменьшается разница между разными уровнями, но одновременно
36

Таблица 1.4
Применение правил Клечковского для определения порядка заселения АО электронами
|
Номер |
|
Название |
|
|
|
|
|
Очередность |
|||
|
энергетического |
|
|
n |
l |
|
n + l |
заселения |
||||
|
|
|
АО |
|
|
|||||||
|
уровня |
|
|
|
|
|
|
|
АО |
|||
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
первый |
|
|
1s |
|
1 |
0 |
|
1 |
|
1 |
|
|
второй |
|
|
2s |
|
2 |
0 |
|
2 |
|
2 |
|
|
|
2рx;2py;2pz |
|
2 |
1 |
|
3 |
|
3 |
|
||
|
|
|
|
|
|
|
||||||
|
|
|
|
3s |
|
3 |
0 |
|
3 |
|
4 |
|
|
|
|
3рx;3py;3pz |
|
|
|
|
|||||
|
третий |
|
|
3 |
1 |
|
4 |
|
5 |
|
||
|
3dxy; 3dxz; 3dyz; 3dx2–y2; |
|
|
|
||||||||
|
|
3 |
2 |
|
5 |
|
7 |
|
||||
|
|
|
|
3dz2 |
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4s |
|
4 |
0 |
|
4 |
|
6 |
|
|
четвертый |
|
4р–орбитали |
|
4 |
1 |
|
5 |
|
8 |
|
|
|
|
4d–орбитали |
|
4 |
2 |
|
6 |
10 |
||||
|
|
|
|
|
||||||||
|
|
|
4f–орбитали |
|
4 |
3 |
|
7 |
13/14 |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Относительная |
|
|
|
|
|
|
|
|
|
|
|
|
энергия АО |
|
усиливается |
энергетическая |
разница |
между |
||||||
|
4f |
|
||||||||||
|
|
подуровнями, |
особенно |
между |
р– |
и |
|
d– |
||||
|
|
|
|
|||||||||
|
|
|
орбиталями |
(d– |
и |
f–орбиталями) |
одного |
|||||
|
4d |
|
энергетического уровня. |
|
|
|
|
|
|
|||
|
4p |
|
|
|
|
|
|
|
|
|
|
|
|
3d |
|
|
|
|
|
|
|
|
|
|
|
|
4s |
|
|
Рис. 1.10 |
– |
Примерные |
соотношения |
|
||||
|
3p |
|
|
энергий |
подуровней |
первых |
четырех |
|
||||
|
|
|
энергетических уровней. |
|
|
|
|
|||||
|
3s |
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2p |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2s |
|
|
|
|
|
|
|
|
|
|
|
|
1s |
|
|
|
|
|
|
|
|
|
|
|
37

Следующим важным правилом, определяющим электронное строение атомов, является принцип или запрет В.Паули:
•в атоме не может быть даже двух электронов с одинаковым набором всех четырех квантовых чисел.
Обоснование принципа В.Паули выходит за рамки данного пособия, но следует иметь в виду, что данное утверждение является абсолютно категоричным, не допускающим исключения.
Из запрета В.Паули следует, что на каждой атомной орбитали
может "находиться" на более двух электронов с противоположными по знаку спиновыми квантовыми числами.2 Такие электроны называют спаренными, в отличие от одиночных (неспаренных) электронов. Часто при анализе электронного строения упоминаются и "пустые АО". Справедливость следствия из принципа В.Паули можно продемонстрировать, если, например, рассмотреть какие квантовые числа описывают движение
электронов на 2рx-орбитали:
полностью описывают АО
|
|
|
n |
l |
m |
s |
|
|
|
|
|
|
полностью |
|
|
|
|||
|
|
описывают все свойства |
|
||||||
|
|
электрона на данной АО |
|
||||||
n |
l |
m |
s |
|
|
n |
l |
m |
s |
|
|
||||||||
2 |
1 |
-1 |
+1/ |
|
|
2 |
1 |
-1 - |
1/ |
|
|
||||||||
|
|
||||||||
|
|
||||||||
квантовые числа, |
2 |
|
|
квантовые числа, |
2 |
||||
|
|
|
|
||||||
|
|
|
|
||||||
|
|
|
|
||||||
|
|
|
|
||||||
|
|
|
|
||||||
соответствующие |
|
|
|
соответствующие |
|
||||
|
|
|
|
||||||
2px -орбитали |
|
|
|
2px -орбитали |
|
||||
|
|
|
|
||||||
|
|
|
|
||||||
квантовые числа, |
|
|
квантовые числа, |
||||||
|
|
||||||||
|
|
||||||||
|
|
||||||||
|
|
||||||||
|
|
||||||||
соответствующие |
|
|
соответствующие |
||||||
|
|
||||||||
|
|
||||||||
одному из электронов |
|
|
второму |
электрону |
|||||
|
|
||||||||
на 2px -орбитали |
|
|
на 2px -орбитали |
|
|||||
|
|
|
|||||||
|
|
|
|||||||
2 Строго говоря, имеется в виду, что их движение описывается одним волновым законом, одной волновой функцией. Такая пара электронов создает одно электронное облако.
38
Схематично орбитали и электроны на них изображают следующим образом:
или
Применение принципа минимума энергии и принципа В.Паули позволяет правильно заселить только 1s- и 2s-орбитали, т.к. следом за ними по энергии идут три орбитали 2р-подуровня, которые различаются только взаимным расположением в пространстве. Очередность их заполнения определяется правилом В.Хунда:
• орбитали одного энергетического подуровня заселяются электронами так, чтобы абсолютное значение (модуль) суммы спиновых чисел был максимальным.
Т.е. подразумевается, что поначалу все 2р-орбитали равноправны (равновыгодны) и первый электрон может быть размещен на любой из них
(спиновое квантовое число может быть произвольным):
равноправные варианты размещения одного электрона на р-орбиталях
Следующий электрон из-за межэлектронного отталкивания "будет располагаться" на одной из двух вакантных орбиталей (будет создавать собственное электронное облако), причем спиновые квантовые числа двух электронов должны совпадать:
равноправные варианты размещения двух электронов на р-орбиталях
или
Для размещения трех электронов на р-орбиталях имеется только два энергетически выгодных варианта:
39
или
В обоих случаях модуль суммы спиновых квантовых чисел составляет 3/2. При этом все три орбитали вновь становятся абсолютно равноправными, и четвертый электрон может быть размещен на любой из них. Для соблюдения принципа В.Паули требуется, чтобы спиновые квантовые числа электронов на одной орбитали были различны, например:






 .
.
Из-за особых межэлектронных взаимодействий повышенной устойчивостью отличаются электронные конфигурации с полузаполненными и полностью заполненными орбиталями одного подуровня: p3, p6, d5, d10 и т.п. Ради достижения таких состояний, как мы увидим позднее, порой происходят, так называемые, "электронные провалы" или "электронные проскоки" между близкими по энергии (n-1)d– и ns–орбиталями (например, между 3d– и 4s– орбиталями в атомах хрома и меди).
1.5 Электронное строение атомов в основном состоянии. Связь электронного строения атомов и
структуры периодической системы элементов
Основным состоянием атома называют такое, когда его электронное строение удовлетворяет всем выше разобранным правилам. Если атому (электрону) сообщить некоторую дополнительную энергию, то могут быть преодолены (нарушены) или принцип минимума энергии или правило В.Хунда. При этом атом переходит в возбужденное состояние. Стабильно существовать в таком состоянии атом не может и быстро опять понижает свою энергию или, возвращаясь в основное состояние, или устанавливая химические связи с другими атомами (чуть позднее мы убедимся, что химическая связь обязательно предполагает понижение энергии, установление связи – экзотермический процесс).
40
