
Строение атома Нестеров
.pdfэнергии в рассматриваемой системе возможно только при одинаковых значениях спиновых квантовых чисел этих электронов.
Результаты расчёта энергии в молекуле водорода с использованием ΨS и ΨA представлены на рис. 2.3, а изменение электронной плотности в системе при формировании общей электронной пары с использованием электронов с антипаралельными и параллельными спинами – на рис.4.3. Энергия химической связи, вычисленная Гейтлером и Лондоном, составила 414,5 кДж/моль при значении длины связи (re) равным 0,86 Ǻ и складывается из энергии следующих взаимодействий:
Притяжение электронов и ядер …………………… - 4262,2 кДж/моль Отталкивания электронов …………………………. 1540,7 кДж/моль Отталкивание атомных ядер ………………………. 1905,1 кДж/моль Кинетическая энергия электронов ………………… 401,9 кДж/моль
∑- 414,5 кДж/моль Рассчитанные характеристики связи в молекуле Н2 отличаются от
экспериментально найденных менее чем на 10%, что свидетельствует о принципиальной применимости квантовой механики для количественной интерпретации химической связи. При этом необходимо отметить, что при уточнении вида используемых волновых функций (за счёт учета деформации исходных электронных орбиталей, минимизации энергии отталкивания электронов в паре и т.д.), расхождение между рассчитанными и экспериментальными данными можно снизить до 0,01%. Таким образом, можно считать доказанным, что ковалентная связь представляет собой взаимодействие электрически заряженных частиц, осуществляемое в условиях квантомеханической микросистемы и обеспечивающее достижение системой минимума энергии при её заданном качественном и количественном составе.
Известно несколько способов перекрывания орбиталей, приводящих к образованию химической связи. Связь типа σ образуется в результате
161

перекрывания атомных орбиталей вдоль линии, соединяющей ядра атомов
(рис.11.3).
Рис.11.3. Образование σ-связей: (а) - типа s-s, (б) - типа s-p, (в) - типа p-p.
Если в процессе образования химической связи орбитали типа p, d или f перекрываются в плоскости параллельной оси σ-связи своими боковыми частями, то образуется π-связь (рис.12.3 и 13.3).
а |
б |
в |
Рис.12.3 Образование π-связей: (а) - типа p-p, (б) - типа p-d, (в) - типа d-
d.(z – ось σ-связи).
162

Рис. 13.3 Электронное облако π-связи типа p-p (А – В – ось σ-связи).
При боковом перекрывании d или f орбиталей в плоскости перпендикулярной σ-связи образуются δ-связи (рис.14.3).
Рис. 14.3. Схема перекрывания d орбиталей при образовании δ-связи.
(z – ось σ-связи).
Одним из возможных способов образования связей согласно МВС является перекрывание одноэлектронных орбиталей валентного уровня атомов в процессе их взаимодействия. Данный вариант формирования общей электронной пары исторически принято называть «обменным» («обмен» в данном случае характеризует не природу связи, а является методом расчёта принятом в МВС). Оставаясь в рамках общепринятого термина, «обменным» будем называть способ образования ковалентной связи, при котором
163
происходит перекрывание двух валентных орбиталей различных атомов, имеющих по одному электрону. Например, атомы водорода имеют в своём составе по одному электрону в 1s состоянии. При перекрывании этих орбиталей (рис.11.3.а) образуется σ-связь, характеристики которой описаны выше. Так как электроотрицательность атомов, принимающих участие в образовании данной связи одинакова, общая электронная пара имеет наименьшую энергию в области, находящейся на равном расстоянии от центров ядер атомов, т.е. σ-связь в молекуле Н2 неполярна. Образование молекул типа Нn где n > 1 невозможно в связи с тем, что, например, при присоединении атома Н к молекуле Н2 электрон третьего атома будет совпадать по значению спина с одним из электронов, входящих в состав общей электронной пары (рис. 11.3.б). Как было показано ранее это приведёт к росту энергии системы, т.е. с энергетической точки зрения более устойчивым её состоянием будет совокупность частиц (Н2 + Н), а не молекула Н3. Способ описания молекул простых веществ других элементов представлен на рис.15.3.
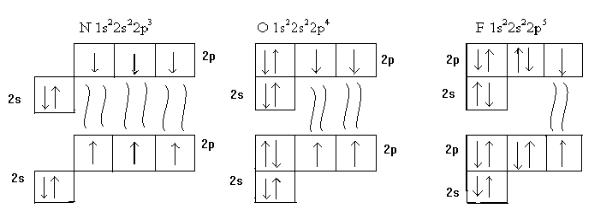
Рис.15.3. Образование связей в молекулах N2, O2 и F2
Атом фтора имеет одну 2р орбиталь с неспаренным электроном. При образовании молекулы F2 происходит перекрывание этих орбиталей с образованием σ-связи типа р-р (рис. 11.3.в). Отсутствие свободных орбиталей валентного уровня у взаимодействующих атомов предопределяет
164

невозможность образования связей по второму возможному механизму, который будет рассмотрен ниже.
Атомы кислорода имеют две одноэлектронные орбитали 2р подуровня, что делает возможным образования двух типов связей между атомами в молекуле O2: σ-связи типа р-р и π-связь, также типа р-p.
Рис.16.3. Схема химической связи в молекуле N2. σ-связь образована за счёт перекрывания рz орбиталей, π-связи – перекрыванием рx и py орбиталей
вплоскостях ху и уz, соответственно.
Уатомов азота на 2р подуровне три одноэлектронные орбитали и, следовательно, эти атомы связаны в молекуле N2 тройной связью: σ-связь
типа р-р и две π-связи типа р-p, расположенные в двух взаимно перпендикулярных плоскостях (рис.16.3.).
Наличие в молекулах связей, образованных только по «обменному» механизму, характерно для водородных соединений элементов главных подгрупп IV – VII групп, большинства органических соединений, неорганических соединений углерода, фторида азота, его оксидов и ряда других веществ. Это позволяет прогнозировать количественный состав указанных молекул, основываясь на строении атомов, из которых формируется частица. Например, исходя из строения атомов азота и фтора (рис.15.3) можно сделать вывод, что наличие у атома азота трёх одноэлектронных орбиталей предопределит возможность присоединение к
165
этому атому трёх атомов фтора, каждый из которых имеет только по одной такой орбитали, т.е состав фторида азота – NF3. Рассуждая аналогично можно показать, что азот может теоретически иметь три водородных соединения различного состава, кислород – два, а фтор – одно:
NH3, H2N – NH2 и HN = NH; H2O и HO – OH; H – F
В отличии от простых веществ, рассмотренных ранее, в молекулах сложных веществ общая электронная плотность возникшая в результате перекрывания орбиталей атомов различных элементов смещена в сторону более электроотрицательного атома, т.е. является полярной. Необходимо отметить, что в молекулах сложных веществ могут одновременно сосуществовать как полярные, так и неполярные связи. Например, в молекулах NH3, H2O, HF, H2N – NH2 и HO – OH связи водорода с азотом, кислородом и фтором полярны, тогда как связи между атомами азота в гидразине и связи между атомами кислорода в пероксиде водорода - неполярны.
Однако энергетические характеристики молекул, в состав которых входят атомы элементов третьего и последующих периодов, а также атомы бора, бериллия и лития невозможно интерпретировать в рамках только «обменной» концепции образования ковалентной связи. Кроме этого, в ряде случаев, используя только данный механизм, невозможно понять причину существования целого ряда термодинамически стабильных молекул и ионов, таких как BNF6, NH4+, AI2I6, B3N3H6 и т.д., не говоря уже о возможности предсказания существования подобных частиц.
Как было показано на примере квантовомеханической интерпретации образования связи в молекуле водорода, результирующая волновая функция, описывающая состояние общей электронной пары в молекуле, является линейной комбинацией атомных орбиталей. При этом к электронам общей пары предъявляется только два требования – они должны иметь
166
противоположные значения спиновых квантовых чисел и их исходная энергия, как максимум, должна соответствовать энергии одной из перекрывающихся орбиталей, с наибольшим значением главного квантового числа. Отсюда можно сделать вывод, что энергетически обоснованным является механизм образования ковалентной связи, заключающийся в перекрывании свободной валентной орбитали одного атома с валентной орбиталью другого атома, имеющего неподелённую электронную пару:
А: + □В = А – В
Такой механизм получил название донорно - акцептороного. Атом, предоставляющий для образования связи двухэлектронную орбиталь называется донором ( атом А), а его партнёр – акцептором (атом В). Очевидно, что механизм образования связи не влияет на её энергию, т.к. последняя предопределяется только энергетическими характеристиками перекрывающихся орбиталей. Например, как было показано выше (рис.10.8) в молекуле F2 между атомами фтора образуется только одна σ- связь. Взаимодействие же между атомами хлора, строение валентного уровня которого представлено на рис. 17.3б., может быть более многообразным: помимо образования σ- связи за счёт перекрывания одноэлектронных 3р атомов, возможно образование дополнительных π-связей за счёт перекрывания свободных 3d орбиталей одного атома с духэлектронными 3р орбиталями атома – партнёра. Такой вывод подтверждается, в частности, ростом суммарной энергией связи в молекуле при переходе от F2 к CI2. Также образованием дополнительных связей по донорно-акцепторному механизму между атомами серы (строение валентного уровня этого атома представлено на рис.17.3а.) объясняется стабильность цепочек - S – S – S - , характерных для простых веществ данного элемента и его соединений.
167

Рис.17.3 Распределение электронов по валентным орбиталям у атомов серы и хлора.
Также без учёта второго механизма образования ковалентной связи невозможно оценить суммарную энергию и полярность связи в молекуле СО, изоэлектронной молекуле N2 (рис.16.3 и 18.3). Как видно из представленной схемы связь в этой молекуле тройная: σ и одна из π-связей образованы по «обменному», а ещё одна π-связь – по донорно-акцепторному механизму. В связи с этим, формально, электронная плотность первых двух связей смещена к более электроотрицательному атому О. Одновременно этот атом выступает в роли донора при образовании третьей связи, т.е. её электронная плотность смещается от атома О к атому С, что компенсирует избыточный отрицательный заряд на атоме кислорода. В результате суммарное смещение электронной плотности относительно центра σ-связи оказывается равным нулю и, следовательно, молекула СО неполярна (так же как молекула N2).
Рис.18.3. Перекрывание орбиталей в молекуле СО Очевидно, что и значения суммарной энергии связи в молекулах N2 и СО будут близки.
168
Подводя предварительный итог рассмотрения молекул в рамках МВС можно сделать вывод, что валентность атома это число химических связей, которые образует данный атом со всеми партнёрами в рассматриваемой молекуле по «обменному» и донорно-акцепторному механизмам. Следовательно, максимальная, теоретически возможная валентность атомов равна числу их валентных орбиталей. Предлагаем читателям определить валентность атомов во всех молекулах, рассмотренных в данном модуле.
3.2.3. Описание строения молекул в рамках МВС
а)Основные характеристики ковалентной связи.
К основным параметрам связи в МВС считают её длину, энергию и направленность.
Длиной связи называется расстояние между ядрами атомов, образовавших рассматриваемую химическую связь. Эта величина является одной из важнейших характеристик любой многоатомной частицы. Точное её значение может быть определено только экспериментально, путем обработки спектральных данных. Для её приближённого расчёта можно воспользоваться системой ковалентных радиусов, равных половине экспериментально определённого расстояния между атомами в простых веществах. Тогда длина связи (d) в молекуле АВ определяется как сумма этих радиусов:
dА-В = dА-А/2 + dВ-В/2
Однако необходимо помнить, что длина связи между атомами одних и тех же элементов может значительно изменяться при изменении её кратности или при изменении состава молекулы. В частности, установлено, что длина связи уменьшается с ростом её кратности:
dС - С =154,1 ± 0,3 пм; dС=С = 133,7 ± 0,6 пм; dС≡С = 120,4 ± 0,2 пм, а длина связи, например N – H, значительно изменяется в зависимости состава частиц, непосредственно связанны с атомом азота:
169
dN – H в NH3 = 100,8 пм; dN – H в CO(NH2)2 = 103,6 пм;
dN – H в [NH4]+ = 103,4 пм; dN – H в [N2H6]+ = 107 пм; dN – H в HN3 = 102 пм; dN – H в HNCS = 101,3 пм; dN – H HNCO = 99 пм.
Используя указанные закономерности, можно по длине связи определить, например, тип рассматриваемого углеводорода (алкан, алкен, алкин или арил), а также судить об образовании дополнительных π-связей между атомами. В частности, в молекуле BF3 длина связи B - F составляет 129 пм, тогда как в ионе [BF4]- она равна 142 пм. Поскольку в данном ионе атом бора использует на образование связи все свои валентные орбитали, то можно предположить, что уменьшение длины связи в BF3 по сравнению с [BF4]- связано с образованием дополнительно четырёхцентровой шестиэлектронной делокализованной π-связи с участием 2р орбиталей бора и фтора.
Энергия связи для двухатомных частиц равна энергии разрыва связи между ними (энергии атомизации) в пересчёте на один моль этих частиц. Эта величина характеризует устойчивость изолированных молекул, ионов и радикалов. Очевидно, что чем ниже лежит точка минимума на кривой потенциальной энергии (рис. 7 и 8), тем больше энергия связи, стабильнее частица, короче межъядерное расстояние для однотипных частиц (таблица 1.8). Из представленных данных можно сделать вывод, что по прочностисвяз ионы и радикалы не уступают молекулам. Это свидетельствует об их термодинамической стабильности, которую не следует путать с химической устойчивостью: для радикала ОН, гидрида лития, молекулярного иона водорода и других частиц их состояние характеризуется только промежуточным локальным минимумом энергии для системы данного состава, поэтому термодинамически выгодны процессы их взаимодействия с другими частицами, т.е . низкая химическая устойчивость по сравнению с продуктами реакций.
Для многоатомных частиц энергия атомизации, характеризующая изменение энергии в системе в результате протекания процесса:
170
