
Строение атома Нестеров
.pdf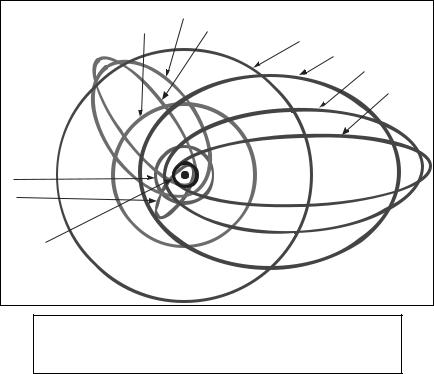
самым, проникает под экранирующую оболочку и поэтому на части своей траектории испытывает действие возрастающего заряда ядра. Отсюда следует, что сильно вытянутые эллиптические орбиты будут обладать дополнительной стабильностью, более низкой энергией.
3 |
32 |
3 |
|
|
|
3 |
|
1 |
44 |
|
|
|
|
|
43 |
|
|
|
|
|
|
4 |
|
|
|
|
|
|
2 |
|
|
|
|
|
41 |
22 |
|
|
|
|
|
21 |
|
|
|
|
|
11 |
|
|
|
|
|
Рисунок 1.5 – Схема модели строения атома |
|||||
по Бору-Зоммерфельду. |
|
|
|
||
Однако даже такого усовершенствования оказалось недостаточно, чтобы объяснить сверхтонкую структуру спектров (пришлось вводить, уже малообоснованно, понятие о третьем квантовом числе). Еще большие проблемы возникали при попытке объяснить структуру периодической системы элементов. Такие попытки предпринимались, но они, опять же, требовали введения дополнительных правил, ограничений, не вытекавших из теории. И, наконец, теории Бора, Бора-Зоммерфельда были совершенно непригодны для количественного описания межатомного взаимодействия, теории химической связи. Например, не удалось получить приемлемого совпадения с экспериментальными значениями энергии связи, межатомного расстояния не только в простейшей молекуле Н2, но и в одноэлектронной частице Н2+. Расчет по модели Н.Бора давал отрицательное значение энергии связи для молекулярного иона Н2+. Это означало, что существовать он не может. На самом деле ион такой известениэнергиясвязивнемсоставляет ~255 кДж/моль.
21
1.2 Квантово-механическое описание атомов
Современная теория строения атомов стала развиваться после того, как вначале (в работах М.Планка, 1900г., и А.Эйнштейна, 1905г.) была доказана двойственная корпускулярно-волновая природа света (корпускула – частица). На этих идеях основаны модели Н.Бора (1913г.) и Бора-Зоммерфельда (1915г.). Но качественно новое представление об устройстве атомов, не отрицающее законы классической механики и электродинамики, а опирающееся на понимание ограниченности их применимости к микрообъектам стало возможным после того, как Луи де Бройль высказал предположение (1924г.), что дуализм следует приписать не только излучению, но и телам. Причем из предложенной формулы
λ = h / m · υ (1.21)
где λ – длина волны, соответствующая частице с массой m, движущейся со скоростью υ.
вытекало, что при уменьшении массы тела волновое поведение становится все более заметным (длина волны становится соизмеримой и даже может заметно превышать размеры частицы). Вскоре волновые свойства электронов были экспериментально обнаружены в опытах К.Дэвиссона и Л.Джермера (1927г.). При отражении потока электронов с энергией 1.6·10-17Дж от поверхности никеля была получена дифракционная картина в точности соответствующая той, что наблюдается, если заменить поток электронов на рентгеновское облучение такой же энергии. Но еще до этих опытов были опубликованы работы В.Гейзенберга (1925г.) и Э.Шредингера (1926г.), в которых формулировались важнейшие положения квантовой (волновой) механики и закладывались основы новой теории строения атома. Впоследствии было показано, что оба предложенных варианта приводят к тождественным результатам. Метод Э.Шрендингера оказался более удобным для выполнения расчетов. Поэтому современная теория строения атомов и теории химической связи основываются на этом методе. Но именно
22
В.Гейзенбергу принадлежит приоритет в строгом обосновании вывода о том, что приписывать электронам в атомах конкретные траектории движения (орбиты) бессмысленно. Анализируя схему экспериментов по изучению траектории движения электрона, он доказал, что принципиально невозможно с высокой точностью одновременно определить координату и скорость его перемещения (принцип неопределенности Гейзенберга). В полученном В.Гейзенбергом выражении
х· Δυ ≥ ћ/ |
m |
(1.22) |
х |
||
х – погрешность (неопределенность) в значении |
координаты |
|
частицы вдоль оси х, Δυх – погрешность (неопределенность) в составляющей значения скорости в том же направлении.
Соответственно, чем точней мы пытаемся определить координату (чем меньше х)
Δυх ≥ ћ/ m· х , |
(1.23) |
тем больше будет ошибка в определении скорости тела, особенно микрочастицы (масса, как х находятся в знаменателе дроби). Получается, что большие значения скоростей микрочастиц мы будем находить с большими погрешностями. Такие расчеты теряют смысл. То же самое относится и к попыткам точно рассчитать координату при заранее заданной высокой точности определения скорости. Например, рассчитанная по формулам Н.Бора скорость движения электрона на первой орбите составляет примерно 2181км/с. Округлим этот результат и представим его с точностью до десятков: ~2180 км/с. Очевидно, что такое округление выглядит оправданным. При этом мы позволили себе неточность в определении скорости Δυ ≈ 1км/с. Если теперь рассчитать по уравнению В.Гейзенберга с какой погрешностью мы в состоянии контролировать местоположение электроны, то получим х ≥ 1.16·103 Ǻ, что примерно в 2000 раз превышает размер атома водорода в основном состоянии (rН ≈ 0.53 Å).
23
В то же время, чтобы гарантировать точность в определении координаты электрона ±0.001 Å ( х = 0.002 Å) мы должны смириться с тем, что точность определения скорости не будет превышать ± ~289 407км/с (Δυ ≈ 578814км/с, что примерно в 265 раз больше найденного ранее значения).
Вывод: на законах классической механики построить правдоподобную теорию движения микрочастиц нельзя.
Энергетические состояния электронов не только в атоме водорода,
но и в многоэлектронных атомах удалось описать, применяя не законы движения тел (при этом, накладывая на них необоснованные ограничения, что имело место в модели Н.Бора), а волновые законы. Волновое уравнение, предложенное Э.Шредингером для описания движения электрона в атоме, – уравнение объемной (атом трехмерен) стоячей волны (электрон его самопроизвольно не покидает и в стационарном состоянии не меняет своего поведения). Обсуждение вида этого уравнения, анализ вариантов его решения выходят за рамки данного пособия. Вкратце лишь отметим, что решением волнового уравнения является набор волновых функций Ψ (читается – пси). Причем для стационарного состояния Ψ является функцией координат (имеет разные значения в разных точках атома) и некоторых целочисленных коэффициентов (трех типов квантовых чисел):
Ψ = f (x,y,z; n,m,l). |
(1.24) |
Аналитический вид волновых функций мы также обсуждать не будем. Но с некоторыми качественными моментами необходимо познакомиться. Так вот, значение волновой функции Ψ в каждой точке имеет смысл амплитуды электронной стоячей волны. Этим словам не очень легко найти аналогию в привычном для нас макромире. А вот ее квадрат, или, строго говоря,
произведение Ψ2·dV соответствует вероятности пребывания электрона в микрообъеме (точке) атома с координатами x+dx, y+dy, z+dz.
24
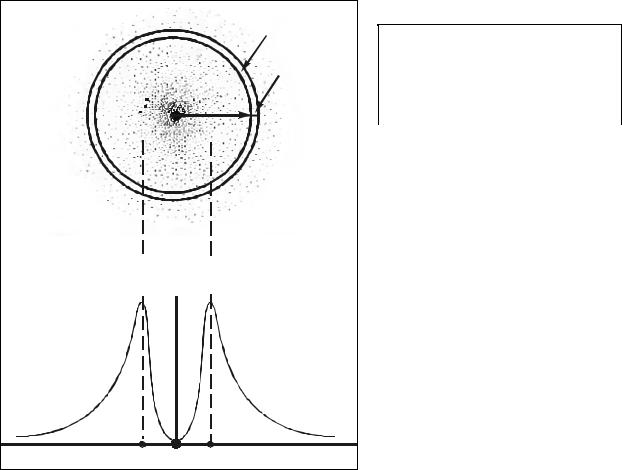
|
|
|
|
|
dV |
Рис. 1.6 – Схематичное |
||||||||
|
|
|
|
|
|
|
||||||||
|
.. |
. .... |
|
dr |
изображение |
электронного |
||||||||
|
. ... |
|
облака атома водорода и его |
|||||||||||
|
... |
|
|
|
..r |
|
вероятностное описание. |
|
||||||
|
.. |
|
|
|
.... |
|
|
|
|
|
|
|
|
|
|
. |
|
.. |
|
|
|
|
|
|
|
|
|
||
|
|
....... |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
. . |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Пояснить |
смысл |
этих |
слов |
||||
|
|
|
|
|
|
|
можно на следующем примере. |
|||||||
|
|
Ψ2.dV |
|
Представим себе, что мы |
||||||||||
|
(R2 .4πr2) |
|
могли |
бы |
выполнять |
снимки |
||||||||
|
|
|
|
|
|
|
самого простого атома – атома |
|||||||
|
|
|
|
|
|
|
водорода |
с очень |
короткими |
|||||
|
|
|
|
|
|
|
экспозициями (мгновенные). |
|||||||
|
|
|
|
|
|
r |
На |
каждом |
таком |
снимке |
||||
|
|
|
|
|
rорбитальный |
имелись бы изображения двух |
||||||||
|
|
|
|
|
частиц: ядра и электрона. Мы |
|||||||||
|
|
|
|
|
|
|
||||||||
знаем, что ядро гораздо массивней электрона, поэтому в пределах атома его |
||||||||||||||
можно считать неподвижным. По поводу движения электрона следует |
||||||||||||||
сказать (учитывая принцип неопределенности В.Гейзенберга), что поскольку |
||||||||||||||
его координату мы зафиксировали предельно точно, то о скорости, в том |
||||||||||||||
числе о направлении его перемещения в данный момент времени мы |
||||||||||||||
практически ничего сказать не можем. Поэтому, если наложить все снимки |
||||||||||||||
друг на друга так, чтобы изображения ядер на них совпали, то окажется, что |
||||||||||||||
электрон вокруг ядра оказывается в разные моменты времени в совершенно |
||||||||||||||
произвольных точках. Различаются лишь вероятности пребывания его |
||||||||||||||
пребывания в том или ином микрообъеме. Поэтому, комментируя поведение |
||||||||||||||
электрона в атоме, |
|
часто говорят о том, что движущийся электрон создает |
||||||||||||
вокруг ядра электронное облако, плотность которого зависит от |
||||||||||||||
координаты |
точки. |
|
Такое |
облако |
(рис.1.6) |
называют |
|
атомной |
||||||
(электронной) |
орбиталью (АО). |
При замене понятия орбита на понятие |
||||||||||||
|
|
|
|
|
|
25 |
|
|
|
|
|
|
|
|
орбиталь теряется привычный смысл радиуса атома. Электронное облако не имеет четких границ. Его плотность на больших расстояниях лишь постепенно устремляется к нулю. Поэтому условной характеристикой размера атома принято считать расстояние от ядра до самого плотного участка электронного облака, в более сложных атомах – до самого дальнего (основного) максимума электронной плотности. Это расстояние называют
орбитальным радиусом атома (rорб).
1.3 Правила квантования
Прежде, чем обсуждать смысл волновых функций и их зависимость от координат, разберемся в целочисленных параметрах. Напомню, что в модели Н.Бора постулировалась квантованность момента количества движения (через квантовое число n). В модернизированной теории Бора-Зоммерфельда использовались уже три квантовых числа. Но они вводились лишь из необходимости улучшить модель, чтобы иметь возможность объяснить вновь открываемые факты о тонкой структуре спектров.
В современной модели строения атома квантовые числа не навязываются, не вводятся искусственно, а появляются в ходе решения волнового уравнения движения электронов. Напомню, что решением волнового уравнения для движущегося в атоме электрона является волновая функция электрона, которая, в свою очередь, зависит от многих переменных. Ее точное решение возможно только для атома водорода и других водородоподобных частиц (He+, Li2+ и т.п.). Решение находится проще, если координаты точек задавать не в декартовой (прямоугольной) системе, а в сферической.
26

Рисунок 1.7 – Определение полярных координат (r,θ,φ) для точки Q; r – радиальная координата, θ и φ – угловые координаты. Показаны также оси прямоугольной системы координат (x,y,z). В центре рисунка находится точка отсчета, соответствующая началу координат.
В этом случае координаты точки задаются одним линейным параметром (радиус-вектором r, характеризующим расстояние от начала координат до рассматриваемой точки) и двумя угловыми (θ и φ). Основываясь на простых тригонометрических соотношениях, можно показать, что координаты в сферической и прямоугольной системах связаны
соотношениями: |
|
x = r·sinθ·cosφ, y = r·sinθ·sinφ, z = r·cosθ. |
(1.25) |
В полярных координатах решение облегчается, т.к. удается выполнить процедуру разделения переменных и представить волновую функцию, как произведение трех других, каждая из которых зависит от меньшего числа параметров:
27
Ψ = f (x,y,z; n,m,l) = R(r;n,l)·Θ(θ;l,m)·Φ(φ;m). |
(1.26) |
В полученном выражении R(r;n,l) называют радиальной составляющей волновой функции Ψ (зависит от главного и орбитального квантовых чисел, а также радиус-вектора). Два последующих сомножителя – угловые составляющие волновой функции.
Для атома водорода угловые составляющие являются константами, поэтому рис.1.6 по сути, является графиком квадрата радиальной составляющей (точнее R2·dV).
Причем, анализом соответствующих уравнений может быть показано, что квантованными (дискретно меняющимися) оказываются не только энергия электрона, но и орбитальные радиусы, а также форма и расположение в пространстве электронных облаков. Наша задача состоит в том, чтобы, не вникая подробно в методы решения волнового уравнения, а также, получаемых из него волновых функций, познакомиться с некоторыми частными итоговыми формулами и усвоить какие квантовые числа в них встречаются, как и на какие свойства электронных облаков, они влияют. Но вначале необходимо усвоить правила квантования, взаимосвязь между разрешенными (квантово-механической теорией) значениями квантовых чисел.
– Главное квантовое число n может принимать любые положительные целочисленные значения:
n = 1; 2; 3; 4; ...∞.
Главное квантовое число входит в формулы, по которым могут быть рассчитаны энергия электрона и орбитальные радиусы в одноэлектронных частицах. Они полностью совпадают с полученными ранее в рамках теории Н.Бора (1.10, 1.15 на стр. 14, 15). Для того, чтобы упростить подобные выражения, их обычно приводят не в системе СИ, а в атомных единицах:
|
|
|
z2 |
|
n |
2 |
|
|
|
Eорб. = E |
|
|
ядра |
, |
rорб = r |
|
. |
(1.27) |
|
|
|
|
|||||||
|
|
z ядра |
|||||||
|
o |
|
n2 |
o |
|
|
|||
28
Здесь Ео – энергия электрона в атоме водорода на атомной орбитали с n =1 (в основном состоянии), rо – орбитальный радиус атома водорода в основном состоянии. Причем, как видно из формулы (1.15), Ео < 0. Поэтому с ростом заряда ядра энергия становится все более отрицательной (уменьшается), а при увеличении n – менее отрицательной (растет). Соответственно, состояния электрона с разными значениями n называют энергетическими уровнями. Говорят: главное квантовое число n определяет уровень энергии электрона и размер создаваемого им электронного облака. Минимальной энергией обладает электрон на первом энергетическом уровне. При устремлении n к бесконечности энергия взаимодействия с ядром стремится к нулю, что равносильно полной потере электрона. Анализируя формулу для орбитального радиуса нетрудно сделать вывод, что при увеличении n растет размер электронного облака.
– Орбитальное квантовое число l может принимать целочисленные значения от нуля до (n-1):
l = 0; 1; 2; 3;…(n-1).
Орбитальное квантовое число (наряду с n) влияет на энергию электрона и размер электронных облаков в многоэлектронных атомах. В аналитическом (формульном) виде зависимость энергии от n и l не может быть представлена, т.к. для многоэлектронных частиц уравнение А.Шредингера не имеет точных решений. Межэлектронные взаимодействия могут быть полуколичественно учтены на основе сопоставления эффектов экранирования и проникновения электронных облаков (кратко будут разобраны позднее). Таким способом удается показать, что при одинаковых значениях n связь электронов с ядром ослабевает при увеличении l. То есть с ростом орбитального квантового числа растет и энергия электрона. Поэтому состояния электрона с разными значениями l называют энергетическими подуровнями. Причем для их обозначения обычно используют не численные значения l, а буквенные символы:
29
Таблица 1.1
Численные значения, обозначения орбитального квантового числа, форма электронных облаков
Численное |
|
|
|
|
|
значение |
0 |
1 |
2 |
3 |
4… |
орбитального |
|||||
квантового |
|
|
|
|
|
числа l |
|
|
|
|
|
|
|
|
|
|
|
Буквенное |
|
|
|
|
|
обозначение |
s |
p |
d |
f |
g… |
энергетического |
|||||
подуровня |
|
|
|
|
|
Форма |
|
объемная |
две |
три |
четыре |
сфера |
скрещенные |
скрещенные |
скрещенные |
||
электронного |
восьмерка |
гантели |
гантели |
гантели |
|
облака |
|
(гантель) |
(четыре |
(шесть |
(восемь |
|
|
|
лепестка) |
лепестков) |
лепестков)... |
|
|
|
|
|
|
Кроме того, поскольку орбитальное квантовое число входит в угловую составляющую волновой функции (см. (1.26)), оно влияет на форму электронных облаков (см. таблицу 1.1).
Рассмотрим взаимную связь главного и орбитального квантовых чисел. Из правил квантования для l следует, что его минимальное разрешенное значение равно нулю, а максимально возможное ограничено выбранным значением главного квантового числа. Например, при n = 1 орбитальное число может иметь только единственно возможное значение l = 0. Таким образом, в первом энергетическом уровне теорией разрешен только s-подуровень. При n = 2 орбитальное квантовое число может иметь уже два значения: минимальное l = 0 и максимальное l = 1. Поэтому во втором энергетическом уровне имеется два подуровня: s и р. Аналогичным образом можно показать, что в каждом следующем энергетическом уровне будут разрешены дополнительные подуровни: d, f и так далее (в порядке латинского алфавита):
30
