
- •Федеральное государственное образовательное учреждение высшего профессионального образования
- •А. А. Нестеров, э.А.Бикяшев теория химического строения и свойства веществ
- •Модуль №1
- •1 Развитие представлений о строении атома
- •Ранние модели строения атома
- •1.2 Квантово-механическое описание атомов
- •1.3 Правила квантования
- •1.4 Правила заполнение электронами атомных орбиталей
- •1.5 Электронное строение атомов в основном состоянии. Связь электронного строения атомов и структуры периодической системы элементов
- •1.6 Закономерности изменения атомных (ионных) радиусов
- •1.7 Закономерности изменения энергий (потенциалов) ионизации
- •1.8 Закономерности изменения сродства к электрону
- •1.9 Электроотрицательности атомов и закономерности их изменения
- •Модуль №2 Электростатические представления в теориях химической связи
- •2.1. Теория электрохимического дуализма
- •2.2. Теория валентности
- •2.3. Теория ионной связи
- •2.3.1. Основные положения теории ионной связи Косселя
- •2.3.2.Оценка энергии ионной связи.
- •2.3.3. Границы применимости теории ионной связи
- •2.3.4 Энергия кристаллической ионной решетки.
- •2.3.5. Ионные радиусы
- •2.3.6. Ионные структуры
- •2.3.6.1. Основные принципы модели жесткой сферы
- •2.3.6.2. Границы применимости модели жесткой сферы
- •2.3.7. Основные свойства ионной связи и её недостатки
- •2.4. Теория поляризации.
- •2.5. Межмолекулярное взаимодействие.
- •Модуль №3
- •3.1. Теория Льюиса и метод олэп.
- •3.2.Основные принципы описания молекул в квантовой химии и метод валентных связей (мвс).
- •3.2.1. Основные принципы описания молекул в квантовой химии
- •3.2.2.Описание механизмов образования химических связей в рамках мвс
- •3.2.3. Описание строения молекул в рамках мвс
- •3.2.5. Дипольный момент и полярность связей
- •3.2.6. Достоинства и недостатки мвс
- •3.3. Метод молекулярных орбиталей (ммо).
- •3.4. Cравнение мвс и ммо
- •Модуль №4 Теория связи в металлах и комплексных соединениях
- •4.1. Химическая связь в кристаллах металлов.
- •4.1.1 Теория «электронного газа».
- •4.2 Зонная теория химической связи для кристаллов металлов, полупроводников и диэлектриков.
- •4.3 Строение кристаллов металлов.
- •4.4 Координационная теория а.Вернера, современная трактовка ее основных понятий и положений
- •4.4.1 Предпосылки создания теории строения комплексов
- •4.4.2 Координационная теория а.Вернера: состав комплексов, поведение в растворах, структура (изомерия)
- •4.4.3 Современная трактовка основных понятий координационной теории
- •4.4.4 Номенклатура комплексных соединений
- •4.4.5 Классификация комплексных соединений
- •4.4.6 Изомерия комплексов
- •4.4.7 Некоторые типы реакций с участием комплексных соединений
- •4.5 Теории химической связи в комплексах
- •4.5.1 Электростатическая (ионная) теория
- •4.5.2 Квантово-механические теории описания химической связи в комплексах
- •4.5.2.1 Метод валентных связей
- •4.5.2.2 Теория кристаллического поля
- •4.5.2.3 Варианты проявления энергетического расщепления орбиталей
- •4.5.2.4 Недостатки ткп
- •4.5.3 Теория поля лигандов (метод молекулярных орбиталей)
- •Заключение
- •Оглавление
3.2.Основные принципы описания молекул в квантовой химии и метод валентных связей (мвс).
3.2.1. Основные принципы описания молекул в квантовой химии
Теоретическое обоснование энергетической целесообразности образования химической связи между изолированными атомами стало возможным только после того, как были разработаны способы описания движения микрочастиц, т.е. после открытия законов квантовой механики. В основе данного обоснования лежат следующие принципы квантовомеханических расчётов:
1.Решение уравнения Шредингера с использованием приближённых волновых функций.
Уравнение Шредингера, описывающее поведение электрона в атоме водорода имеет вид:
▼2ψ + 8π2m/h2(E – V)ψ = 0 (1.3)
где ▼2– оператор Лапласа и, следовательно, ▼2ψ = ∂ψ/∂х2+ ∂ψ/∂y2+ ∂ψ/∂z2; Е – полная энергия системы,V– её потенциальная и (E–V) кинетическая энергия, соответственно.
Это уравнение может быть представлено в виде:
{ (- h2/8π2m)▼2 + V}ψ = Eψ или сокращённо: Ĥψ = Eψ (2.3)
где Ĥ– оператор Гамильтона, определяющий операцию или последовательность операций, производимых над функцией ψ.
Если умножить обе части последнего уравнения на ψ и проинтегрировать по всему пространству ( от -∞ до +∞ по каждой из координат), то можно получить выражение, описывающее полную энергию системы:
∫ ψĤψ dv / ∫ ψ2dv = E (3.3 )
Полученное соотношение является одним из основных уравнений квантовой химии.
Так как точный вид ψ-функций известен только для одноэлектронных систем, в квантовой химии используют их приближённые выражения. При этом приближённые значения функций ψ определяют с помощью вариационного метода. Оптимальную функцию в рамках этого метода находят путём последовательного приближения, постулируя, что ближе к истинному выражению будет тот вид ψ, подстановка которого в уравнение (3.3), позволит получить минимальное значение Е. В подавляющем большинстве случаев функцию ψ выражают в виде суммы:
Ψ = с1φ1 + с2φ2 + с3φ3 + ………. + сnφn (4.3)
где φ – функция зависящая от координат,с- коэффициенты
Коэффициенты сi подбираются с учётом основного принципа рассматриваемого метода – принципа минимальной энергии системы:
∂Е/∂с1 = 0; ∂Е/∂с2 = 0; ∂Е/∂с3 = 0; …………… ∂Е/∂сn = 0. (5.3 )
2. Расчет энергии молекул и молекулярных ионов.
Изменение энергии в системе состоящей из двух ядер показано на рис.7.3 При расчете энергии в подобных случаях за нулевую принимается энергия системы, в которой невозбуждённые атомы удалены друг от друга на бесконечно большое расстояние. При сближении атомов водорода между ними возникают силы притяжения, что приводит к снижению энергии системы в целом. Изменение энергии системы наблюдается то тех пор, пока силы отталкивания (резко возрастающие при сближении ядер атомов на расстояние меньше ¾ суммы радиусов атомов) не скомпенсируют силы притяжения. Таким образом, энергия системы складывается из суммарной полной энергии электронов и потенциальной энергии взаимодействия ядер. В связи с этим зависимость энергии системы от расстояния между центрами взаимодействующих атомов имеет минимум, который характеризует наиболее стабильное состояние бинарной молекулы. В невозбуждённой молекуле при Т > 0оК ядра атомов совершают колебания относительно равновесного расстояния re (рис.7.3), что увеличивает энергию системы на некоторую величину, которую обозначим через ε0. Тогда экспериментально найденная энергия связи (количество энергии выделяющейся при образовании одной связи данного типа в рассматриваемой молекуле) определяется соотношением Есвязи = Е min - ε0.
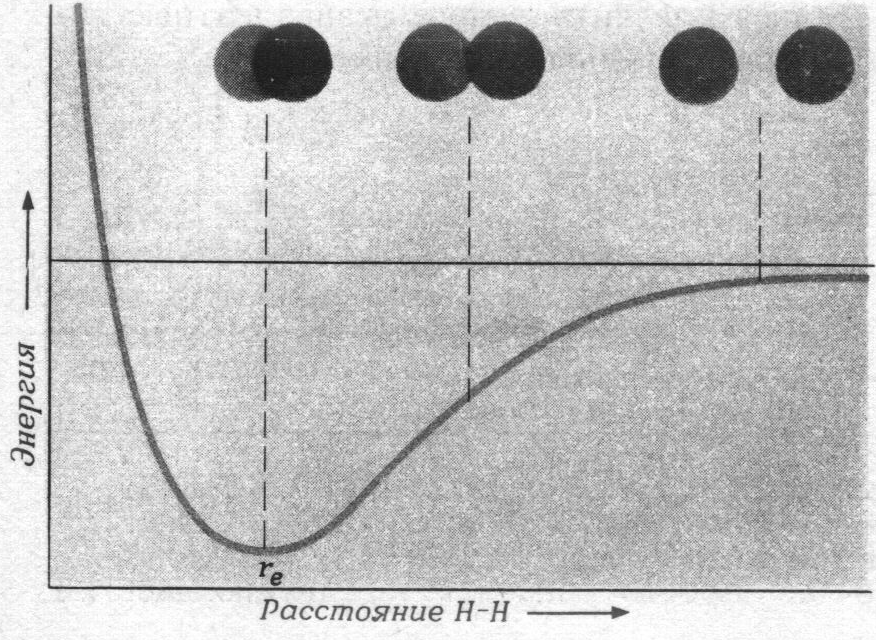
Рис.7.3. Теоретическая кривая изменения энергии связи в молекуле Н2 в зависимости от расстояния между ядрами атомов
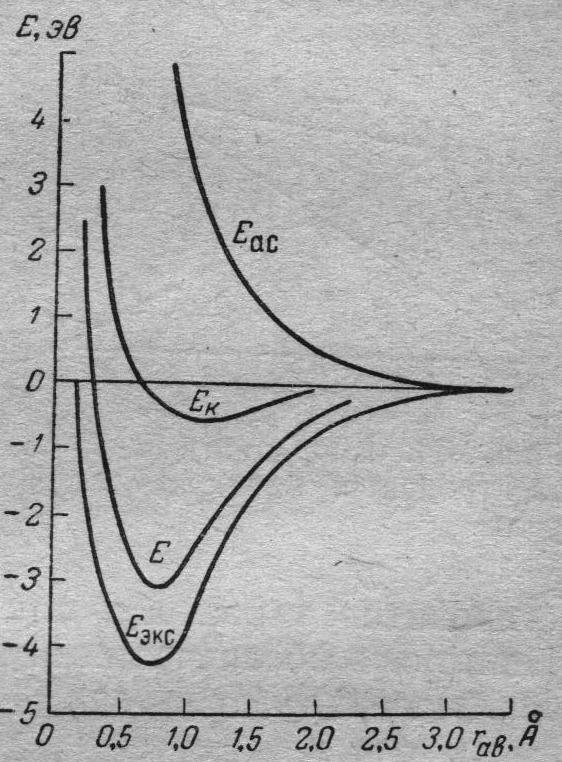
Рис. 8.3. Экспериментальная и теоретические кривые зависимости энергии в молекуле Н2 от расстояния между ядрами атомов. Ек – расчёт на основе модели кулоновского взаимодействия (модель Льюиса); Е и Еас. –рассчитаны с использованием симметричной и антисимметричной волновых функций, соответственно; Еэкс. – экспериментальные данные.
Как правило, в литературе при описании молекулярного вещества приводятся значения энергии одного моля рассматриваемых связей и значения re. Экспериментальные кривые (рис.8.3 кривая Еэкс.) определяют, используя данные молекулярных спектров.
Как отмечалось выше, квантовомеханические расчёты энергии молекулярных систем для различных значений (r) проводят с использованием уравнения (3.3). Критерием правильности такого расчёта является степень совпадения теоретической и экспериментальной кривых Е = f(r) в рассматриваемой системе.
