
Лиситсын Молекулярная физика в задачакх 2014
.pdfМИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
НАЦИОНАЛЬНЫЙ ИССЛЕДОВАТЕЛЬСКИЙ ЯДЕРНЫЙ УНИВЕРСИТЕТ «МИФИ»
Озерский технологический институт
С. Г. Лисицын
МОЛЕКУЛЯРНАЯ ФИЗИКА В ЗАДАЧАХ
Рекомендовано к изданию УМО "Ядерные физика и технологии"
Москва 2014
УДК 530.1 ББК 22.2я72 Л63
Лисицын С.Г. Молекулярная физика в задачах: Учебно-методи-
ческое пособие. М.: НИЯУ МИФИ, 2014. – 208 с.
В пособии разобраны решения задач различной сложности по всем основным темам из раздела "Молекулярная физика" курса общей физики. Пособие предназначено для студентов технических специальностей, изучающих курс общей физики и рассчитано на применение совместно с учебниками по курсуобщей физики И.В. Савельева и И.Е. Иродова.
Пособие подготовлено в рамках Программы создания и развития НИЯУ МИФИ.
Рецензенты:
В.И. Гервидс, доцент кафедры общей физики НИЯУ МИФИ, В.П. Медведев, заведующий кафедрой ХиХТ ОТИ
ISBN 978-5-7262-1983-7 |
© Национальный исследовательский |
|
ядерный университет «МИФИ», 2014 |
ОГЛАВЛЕНИЕ
ПРЕДИСЛОВИЕ............................................................................................... |
4 |
||
1. |
ОСНОВЫ МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОЙ ТЕОРИИ..................... |
6 |
|
2. |
СВОЙСТВА ИДЕАЛЬНЫХ ГАЗОВ........................................................ |
22 |
|
3. |
ОСНОВНЫЕ ПОНЯТИЯ ТЕРМОДИНАМИКИ..................................... |
28 |
|
4. |
РАСПРЕДЕЛЕНИЕ БОЛЬЦМАНА.......................................................... |
58 |
|
5. |
РАСПРЕДЕЛЕНИЕ МАКСВЕЛЛА.......................................................... |
67 |
|
6. |
ТЕПЛОВЫЕ ПРОЦЕССЫ......................................................................... |
81 |
|
7. |
ДИФФУЗИЯ.............................................................................................. |
101 |
|
8. |
ТЕПЛОПРОВОДНОСТЬ......................................................................... |
105 |
|
9. |
ВЯЗКОСТЬ ГАЗОВ И ЖИДКОСТЕЙ.................................................... |
126 |
|
10. |
ТУРБУЛЕНТНОСТЬ.............................................................................. |
144 |
|
11. |
ФАЗОВЫЕ ПЕРЕХОДЫ ....................................................................... |
151 |
|
12. |
УРАВНЕНИЕ ВАН-ДЕР-ВААЛЬСА ................................................... |
177 |
|
13. |
ПОВЕРХНОСТНОЕ НАТЯЖЕНИЕ..................................................... |
191 |
|
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ....................................... |
207 |
||
_______
3
ПРЕДИСЛОВИЕ
Пособие предназначено для студентов технических специальностей, изучающих курс общей физики. Оно создано для того, чтобы помочь студентам освоить решение задач по физике и разобраться с различными аспектами теории.
Впособии разобраны задачи различной сложности по всем основным темам раздела "Молекулярная физика". Однако просто разбирать задачи без упоминания необходимых теоретических положений – дело достаточно бессмысленное. Решить задачу можно лишь при условии вполне ясного понимания её содержания и основных законов физики, лежащих в основе решения. Раздел «Молекулярная физика» весьма насыщен многочисленными понятиями, зачастую весьма непростыми. Поэтому в данном пособии немало места отведено основам теории, необходимой для решения задач. Для того чтобы объём пособия был по возможности небольшим, изложение теории дано максимально кратко. Здесь перед автором стояла весьма деликатная задача – как добиться краткого, но достаточно полного и точного изложения теории? Поневоле пришлось опираться на существующие учебники, выбрав за основу изложения тот, который в наилучшей степени удовлетворял бы указанным требованиям. Таким учебником, на взгляд автора, является учебник Л.Д. Ландау, А.И. Ахиезера
иЕ.М. Лифшица «Курс общей физики», включающий в себя механику и молекулярную физику. Именно содержание этого учебника и составляет основу теоретических сведений в данном пособии. Чтобы не затруднять чтение текста автор позволил себе прямое цитирование (без кавычек) многих страниц этого учебника, иллюстрируя их соответствующими задачами. Разумеется, упомянутый учебник, сколь бы ни был удачен, не может заменить все книги, написанные на данную тему. Следует читать и другие учебники. Возможно, читателям они в чём-то покажутся более удачными. Небольшой список рекомендуемых учебников приведён в конце пособия.
Вбольшинстве задач требуется получить численный ответ. На взгляд автора, такого рода результаты позволяют лучше понять суть рассматриваемых явлений, оценить их масштабы. Это особенно важно, поскольку
4
многие явления из области молекулярной физики недоступны непосредственному восприятию. Поэтому оценка масштабов реальных процессов чрезвычайно полезна.
Автор также, по возможности, старался избегать задач, где требуются громоздкие вычисления или сложный анализ многочисленных частных случаев. В пособии практически нет оригинальных задач. Многие из них заимствованы из задачников, список которых приведён в конце пособия. Выбор именно этих задачников обусловлен тождеством концепций, положенных в основу как упомянутых задачников, так и данного пособия. Отличие данного пособия в том, что в упомянутых задачниках из-за ограниченности объёма часто невозможно дать подробный разбор решения задачи. Данное же пособие содержит сравнительно небольшое число задач, подробный разбор которых и составляет его основное содержание.
Задачи в каждом разделе подобраны в порядке возрастания их сложности. Первые задачи носят иллюстративный характер, демонстрируя, как работают основные понятия. Заключительные же задачи, как правило, имеют достаточно глубокое содержание, выходя за рамки простых упражнений.
5
1. ОСНОВЫ МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОЙ ТЕОРИИ
В основе молекулярно-кинетической теории (МКТ) строения вещества лежат несколько утверждений.
УТВЕРЖДЕНИЕ 1. Все тела состоят из некоторого числа простых веществ – химических элементов. Наименьшей частицей каждого элемента является его атом.
Строение атома. Атом состоит из сравнительно тяжелого положительно заряженного атомного ядра и движущихся вокруг него значительно более легких отрицательно заряженных частиц – электронов, составляющих, как говорят, электронную оболочку атома. Ядра различных атомов отличаются друг от друга, электроны же все абсолютно одинаковы. Практически вся масса атома сконцентрирована в его ядре. Наиболее легкое из ядер – ядро атома водорода, называемое протоном, примерно в 2000 раз (точнее в 1837 раз) тяжелее электрона. В единицах системы СИ масса электрона составляет
m = 0,91 10–30 кг = 0,91 10–27 г.
Размеры ядра ничтожно малы по сравнению с размерами атома. Радиусы атомов, т.е. радиусы области вокруг ядра, в которой движутся электроны, составляют порядка 10–8 см. Поэтому в качестве масштаба длины в молекулярной физике разумно взять величину размера атома, т.е. длину в 10–8 см. Эта величина называется ангс-
тремом (обозначается как Å):
1 Å = 10–8 см.
Радиусы ядер в десятки тысяч раз меньше и по порядку величины лежат между 10–13 и 10–12 см.
Атомная единица массы. Поскольку массы атомов чрезвычайно малы, то их удобнее измерять не в граммах, а в специальных единицах – атомных единицах массы (а.е.м.), в качестве которой принята 1/12 часть массы атома углерода (изотопа C12). Масса атома какого-либо элемента, выраженная в таких единицах, называется атомной массой элемента и обозначается обычно буквой А. Например, атомная масса водорода равна 1,008 а.е.м.
6

Число Авогадро. Масса атома, выраженная в граммах, пропорциональна его атомной массе. Если взять число граммов какоголибо элемента, равное его атомной массе, то содержащееся в этом количестве вещества число атомов будет одинаковым для всех элементов. Это число называется числом Авогадро и равно
NA = 6,02 1023.
Очевидно, что масса атома с атомной массой А равна mA = NАA =1,66 10−24 А (г).
Например, масса атома водорода равна
m |
|
= |
А |
= |
1 |
=1,66 10−24 (г). |
А |
|
6 1023 |
||||
|
|
NA |
|
|||
Моль – количество вещества, в котором содержится число молекул, равное числу Авогадро. Масса моля (молярная масса), выраженная в граммах, равна произведению числа Авогадро на массу одной молекулы, выраженной в атомных единицах массы:
µ = NA m.
Задача 1.1. Найдите массу молекулы воды.
Решение. Масса m молекулы воды равна сумме масс атома кислорода (А = 16 а.е.м.) и двух масс атома водорода (А = 1 а.е.м.), т.е. 18 а.е.м. Тем самым, масса моля воды равна 18 г. Поскольку µ = NAm, то масса молекулы
m = |
μ |
= |
18 |
=3 10−23 г. |
|
6 1023 |
|||
|
NA |
|
||
Задача 1.2. Оценить размеры атомов алюминия и ртути, и молекулы воды.
Решение. Поскольку жидкости практически несжимаемы, то это означает, что молекулы в них располагаются вплотную одна к другой. Найдём объём v, занимаемый одной молекулой:
v = mρ ,
где m – масса одной молекулы, ρ – плотность жидкости. Поскольку m =μ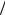 NA , то для объёма v молекулы найдём:
NA , то для объёма v молекулы найдём:
7
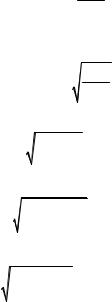
v = ρNμA .
Размер молекулы а можно оценить как кубический корень из этого объёма:
a = 3 ρNμA .
Для воды (Н2О) µ = 18 г/моль, ρ = 1 г/см3, откуда:
a |
= 3 |
18 |
|
~ 3 10−8 см ~ 3Å. |
|||
|
|
||||||
воды |
|
1 6 1023 |
|
|
|
||
Для ртути µ = 200 г/моль, ρ = 13,6 г/см3, откуда |
|||||||
aHg = |
3 |
|
200 |
|
~ 3 10 |
−8 |
см ~ 3Å. |
13,6 6 1023 |
|
||||||
Для алюминия µ = 27 г/моль, ρ = 2,5 г/см3, откуда
27 |
|
−8 |
|
|
aAl = 3 |
|
~ 2,6 10 |
|
см ~ 2,6Å. |
2,7 6 1023 |
|
|||
В пределах точности нашей оценки размеры молекулы воды и атома ртути одинаковы. Близкими к найденным значениям оказываются размеры атомов большинства других веществ. Заметим, что размеры молекул более чем в 1000 раз меньше длин волн видимого нами света. Этот факт означает невозможность наблюдать такие объекты с помощью различных оптических приборов, так как размеры предметов, которые можно увидеть с помощью микроскопов, не могут быть меньше длины световой волны. Причина этого в волновой природе света.
Задача 1.3. Найдите концентрацию молекул, т.е. их число в единице объёма тела, выразив его через плотность тела и молярную массу вещества.
Решение. Плотность тела ρ равна массе единицы объёма тела, поэтому её можно записать как произведение массы т одной молекулы на их число п в единице объёма:
ρ = т п,
откуда найдём
8

n = mρ = ρNμA .
Так для воды в жидком состоянии
п ~ 3 1022 см –3.
Такой же порядок п и у других веществ, если те находятся в твёрдом или жидком состоянии. Например:
• алюминий – |
молярная масса µ = 2,7 г/моль, плотность |
ρ = 2,7 г/см3, откуда |
n ≈ 6 1022 см−3 ; |
• уран – молярная масса µ = 238 г/моль, плотность ρ = 19 г/см3, откуда n ≈ 5 1022 см−3 .
Задача 1.4. Оценить молярную массу воздуха.
Решение. Воздух содержит большое число различных газов, но главные его компоненты – азот и кислород. Молекулы обоих газов двухатомные. Азота в воздухе содержится около 78 %, а кислорода
– 21 %. Ещё около 0,9 % приходится на аргон, все остальные газы содержатся в очень малом количестве, и в наших оценках мы их учитывать не будем.
Молярная масса азота μN2 = 28 г/моль, кислорода μO2 =
= 32 г/моль, аргона µAr = 40 г/моль. В одном моле воздуха по определению содержится NA молекул. Пусть из этого числа на азот, кислород и аргон приходится соответственно N1, N2, N3 молекул. Тогда масса моля воздуха будет равна:
µ |
|
|
= m N + m N |
|
+ m N |
|
= |
|
μN |
2 |
N + |
μO |
2 |
N |
|
+ |
μ |
Ar |
N |
|
= |
|||||||
возд |
2 |
3 |
|
|
|
|
|
2 |
|
|
3 |
|||||||||||||||||
|
|
N 2 |
1 O 2 |
|
Ar |
|
|
|
NA |
1 |
NA |
|
|
NA |
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
= μ |
|
N1 |
+μ |
|
N2 |
+μ |
|
N3 |
|
= 28 |
0,79 +32 0,21+ 40 0,01 = |
|||||||||||||||||
|
|
|
Ar NA |
|||||||||||||||||||||||||
|
|
N2 |
NA |
O2 NA |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
= 28,88 ≈ 29 (г/моль).
Масштабы энергии в задачах молекулярной физики. Для из-
мерения энергий в атомных явлениях джоуль является слишком большой величиной. В молекулярной физике применяется единица энергии, называемая электрон-вольтом (эВ), она равна энергии, приобретаемой электроном при прохождении им в электрическом поле разности потенциалов в один вольт. Поскольку производимая электрическим полем работа, равна произведению величины заряда
9
на разность потенциалов, пройденную этим зарядом, а заряд элек-
трона е составляет 1,6 10-19 кулон, то электрон-вольт составляет
1 эВ = 1,60 10–19 Дж.
Энергия ионизации атома. Атом не является неделимой частицей вещества. От атома можно оторвать один или большее число электронов. Этот процесс возможен, например, при столкновении атомов друг с другом или с пучком быстро движущихся электронов. Энергия, которая необходима, чтобы оторвать от атома один электрон, называется энергией ионизации атома (другое название – ионизационный потенциал). Величина энергии ионизации колеблется в пределах от наименьшего примерно 3 эВ для атома франция до наибольшего 24,6 эВ для атома гелия. Энергия ионизации атома водорода равна 13,6 эВ.
Энергия ионизации атома как функция его атомного номера оказывается периодической функцией. Она более или менее монотонно возрастает в каждом периоде таблицы Менделеева, достигая наибольшего значения в атоме благородного (инертного) газа, и затем резко падает к началу следующего периода. Это является одним из главных проявлений периодических свойств атомов, которые дали таблице атомов название периодической системы.
УТВЕРЖДЕНИЕ 2. Атомы вещества взаимодействуют между собой. Атомы различных элементов могут соединяться друг с другом, образуя молекулы. Простейшей молекулой является двухатомная молекула, состоящая из двух одинаковых или разных атомов. Взаимодействие атомов, приводящее к образованию такой молекулы, характеризуется потенциальной энергией, график которой изображен на рис. 1.1. На этом графике отложена потенциальная энергия U взаимодействия двух атомов как функция от расстояния r между ними (точнее, расстояния между ядрами атомов). Эта функция имеет довольно глубокий и резкий минимум при некотором значении r = r0. На меньших расстояниях кривая очень круто поднимается вверх (примерно как 1/ r12 ); эта область соответствует сильному отталкиванию атомов, возникающему при перекрытии и взаимной деформации их электронных оболочек. На больших же расстояниях атомы притягиваются. Расстояние r0 отвечает устойчивому равновесному взаимному положению ядер в молекуле. В
10
