
- •1. Стабильность Si-c-связей, влияние заместителей в связанном с атомом кремния остатке.
- •2. Реакция Пудовика. Исходные соединения, связь с реакцией Кабачника—Филдса в варианте с основаниями Шиффа.
- •3. Реакционная способность и стабильность металлорганических соединений. Основные способы получения металлорганических соединений.
- •4. Способы получения и химические свойства литийорганических соединений.
- •5. Получение алкиларсиновых кислот по реакции Мейера, получение ариларсиновых кислот по реакции Барта.
- •6. Реакции литий- и магнийорганических соединений с альдегидами, кетонами, сложными эфирами, ортоэфирами и нитрилами.
- •7. Номенклатура фосфорорганических соединений и органических производных серы.
- •8. Роль растворителей при получении литий- и магнийорганических соединений.
- •9. Исходные продукты для получения тиофосфатов с инсектицидной активностью (хлортиофосфаты и дитиофосфаты), получение фоксима и карбофоса.
- •10. Способы получения, токсические характеристики и практическое использование органических производных свинца
- •11. Гидролиз и ацидолиз эфиров кислот фосфора. Получение триметилсилильных эфиров кислот фосфора, реакция МакКенны.
- •12. Реакции ацидолиза эфиров кислот фосфора, ацидолиз при получении диалкилфосфитов, условия перегонки реакционных масс. Окисление и галогенирование диалкилфосфитов.
- •13. Получение кремнийорганических аналогов биологически активных веществ, получение силамепробамата. Эффект замены атома углерода на атом кремния в биоактивных соединениях.
- •1) Получение:
- •2) Получение силамепробамата
- •3) Эффект замены
- •14. Метаболизм кремнийорганических соединений.
- •15. Способы получении и свойства алюминийорганических соединений. Применение в производстве полимеров
- •16. Жидкость Кадэ. Хлорвинилхлорарсины, получение, токсические характеристики, механизм действия, антидоты.
- •17. Получение эфиров арилбороновых кислот и использование их в реакции Сузуки.
- •18. Взаимодействие α-галогензамещеных кетонов с триалкилфосфитами (реакция Перкова и Михаэлиса-Арбузова). Винилфосфаты в качестве ингибиторов холинэстеразы.
- •19. Механизм гербицидной активности глюфосината (фосфинотрицина), способы его получения. Токсичность и побочные эффекты для теплокровных.
- •20. Получение кремнийорганических соединений
- •21. Получение силиконовых полимеров, регуляция молекулярной массы, вулканизация. Их практическое использование.
- •22. Реакции Барта и Несмеянова.
- •23. Способы получения диэфиров фосфористой кислоты.
- •24. Примеры фосфорорганических соединений с инсектицидной активностью, получение диалкилхлортиофосфатов. Механизм выработки резистентности на примере карбофоса.
- •25.Реакция Вюрца-Фиттига, механизм избирательности в варианте Фиттига. Промежуточные продукты в реакциях арилхлоридов с хлоридами элементов и металлическим натрием.
- •27. Способы получения и свойства цинкорганических соединений, использование их в реакции Реформатского и для получения карбонильных соединений.
- •28. Ртутьорганические соединения. Способы получения и химические свойства. Гранозан (этилмеркурхлорид), токсичность органических производных ртути.
- •29. Превращения функционализированных по β-положению кремнийорганических соединений.
- •30. Ингибирование холинэстеразы соединениями с ацилирующей способностью, особенности ингибирования производными кислот фосфора, формула Шрадера.
- •31. Способ получения и биологическая активность силатранов
- •32. Способы получения и биологическая активность органических производных германия, герматраны.
- •33. Получение триариловых и триалкиловых эфиров фосфористой кислоты.
- •34. Способы получения и практическое использование оловоорганических соединений.
- •35. Механизм реакции Михаэлиса-Арбузова, реакционная способность исходных соединений, побочная реакция.
- •36. Способы получения мышьякорганических соединений, Реакция Бешама. Сальварсан
- •37. Механизм реакции Михаэлиса-Беккера, получение натриевой соли диалкилфосфористой кислоты, ее реакционная способность, побочные продукты в реакции Михаэлиса- Беккера.
- •38. Биологическая активность бисфосфонатов. Примеры и способы получения бисфосфонатных средств для лечения остеопороза
- •39. Способы получения и свойства борорганических соединений.
- •40. Реакция диалкилфосфитов с изоцианатами, побочная реакция. Получение кренайта, механизм биологической активности.
- •41. Получение илидных соединений из диалкилсульфидов и диметилсульфоксида, синтез на их основе оксиранов и циклопропанов.
- •43. Реактивация ацилированной фосфорорганическими соединениями холинэстеразы производными гидроксиламина, оксимы в качестве антидотов и фоксим.
- •44.Синтез и свойства тиольных соединений алифатического ряда
- •46. Гербицидная активность фосфонометилглицина (глифосата). Способы его получения. Экологические последствия использования глифосата.
- •47. Синтез и свойства тиольных соединений ароматического ряда.
- •48. Три возможных направления использования кремнийорганических соединений в химии биологически активных соединений, привести примеры.
- •49. Получение арсоновых и арсиновых кислот по реакциям Барта и Мейера.
- •50. Зависимость токсичности от строения для фосфорорганических соединений, эмпирическая формула Шрадера.
- •51. Фосфорорганические соединения с противовирусной активностью. Получение фосфонуксусной кислоты и тринатриевой соли фосфонкарбоновой кислоты. Механизм противовирусной активности.
- •52.Взаимодействие трихлорида мышьяка с ароматическими соединениями и с ацетиленом, токсичность α-, β- и γ-льюизита, дифенилхлорарсин и фенарсазинхлорид.
- •53. Зависимость токсичности от строения в ряду нитрофениловых эфиров фосфорной и тиофосфорной кислоты. Получение о-метил-о-этилового эфира хлорангидрида тиофосфорной кислоты.
- •54. Способы получения и свойства тиофосфорных и тиофосфористых кислот. Правило жмко в реакции их солей с органическими галогенидами
- •55. Получение трифенилфосфина, образование илидов трифенилфосфония, механизм реакции Виттига. Синтез сквалена по реакции Виттига.
- •56. Реакция Хорнера-Вадсворта-Эммонса, синтез фосфонацетатов по реакции Михаэлиса-Арбузова и по реакции Михаэлиса-Беккера.
- •57. Способы получения и свойства сульфокислот алифатического и ароматического ряда.
- •58.Биологическая активность синтетических селенорганических соединений. Получение и антиоксидантная активность эбселена.
- •59.Получение и химические свойства диметилсульфоксида в качестве растворителя и реагента
- •60.Роль серосодержащих аминокислот в составе белков и в метаболизме. Биосинтез цистеина.
4. Способы получения и химические свойства литийорганических соединений.
1)Реакция металлического лития с соответствующим галогенидом – основной способ получения литийорганических соединений
Нельзя использовать для получения литийорганических соединений алкилиодиды, поскольку они реагируют с литием по реакции Вюрца.
В соответствии с этим для увеличения выхода и для получения свободных от галогенидов лития растворов литийорганических соединений лучше всего использовать в качестве исходных соединений хлорпроизводные в алифатическом ряду и бромпроизводные в ароматическом.
При этом следует отметить, что по схеме реакции Вюрца с металлическим литием реагируют и реакционноспособные органические хлориды, например, аллил- или бензилхлориды.
2)Некоторые простые эфиры реагируют с металлическим литием так же, как и алкил- или арилгалогениды. Так, например, бензиллитий может быть получен с хорошим выходом из бензилалкиловых эфиров в тетрагидрофуране, например, по реакции:

3)В метилале СН2(ОСН3)2 действием лития на хлорметиловый эфир можно получить метоксиметиллитий:

4)Определённое значение имеет способ получения литийорганических соединений в соответствии с общей схемой:

Равновесие в этой реакции сдвинуто в сторону образования литийорганического соединения, органическая составляющая которого лучше воспринимает состояние с частичным анионным статусом.
Хорошие результаты получаются, когда в этой обменной реакции галоген представлен атомом брома, но при использовании в качестве литиирующего реагента бутиллития побочным продуктом реакции становится достаточно реакционноспособный бутилбромид. При повышении температуры он может реагировать с образовавшимся литийорганическим соединением или вступать в реакцию с продуктом его дальнейшего превращения. Если присутствие бутилбромида в реакционной массе нежелательно, то для реакции литиирования берут два эквивалента третбутиллития. В этом случае образовавшийся третбутилбромид реагирует с избытком третбутиллития с образованием изобутена, изобутана и бромида лития:

5)Литийорганические соединения можно также получать из реактивов Гриньяра. В качестве примера можно привести реакцию бензилмагнийхлорида с металлическим литием:
![]()
6)Ещё один способ получения литийорганических соединений представлен замещением литием атома водорода. Особенно легко эти реакции протекают на активированных СН-связях, например, при взаимодействии бутиллития с ацетиленом и с монозамещенными ацетиленами, а также с трифенилметанами. Ароматические соединения с электронодонорными заместителями также могут вступать в реакции обмена атома водорода на литий. В качестве примера можно привести реакцию фениллития с диметиловым эфиром резорцина:
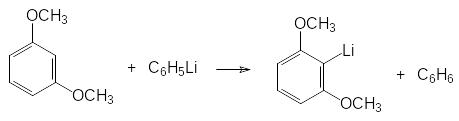
Высокая нуклеофильность литийорганических соединений не позволяет проводить по этой схеме реакции обмена атома водорода на атом лития на соединениях с электрофильными функциональными группами. В этом случае в качестве литиирующего реагента используют диизопропиламид лития ([(CH3)2CH]2NLi, LDA) или 2,2,6,6-тетраметил-пиперидид лития, анионы которых проявляют исключительно основные свойства. В отдельных случаях можно использовать в реакция литиирования и менее основный гексаметилдисилазид лития [(CH3)3Si]2NLi.
Синтезы с участием литийорганических соединений во многом аналогичны превращениям, в которых участвуют представленные ниже реактивы реактивы Гриньяра*, но более высокая реакционная способность органических производных лития позволяет проводить с их участием и специфические превращения.
1)К ним относятся, например, реакции присоединения к двойным азот-углеродным связям в составе гетероциклических соединений. В качестве примера приводится реакция получения 2-фенилпиридина:
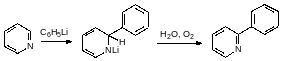
Взаимодействие пиридина с фениллитием протекает при температуре 110°С. В соответствии с этим в инертной атмосфере к раствору фениллития в эфире прибавляют раствор сухого пиридина в толуоле, отгоняют эфир и нагревают реакционную массу с обратным холодильником в течение 8 часов. После разложения образовавшегося продукта присоединения водой окисление образующегося 2‑фенилдигидропиридина идёт кислородом воздуха.
2)Определённое препаративное значение имеют также реакции литийорганических соединений, протекающие с образованием азот-углеродных связей. В их основе лежит замещение уходящей группы связанным с атомом лития остатком или присоединение литийорганического соединения по кратной связи между атомами азота, например:

*Реакции, аналогичные превращениям с реактивами Гриньяра
3)Магнийорганические соединения могут вступать в реакции с реакционноспособными органическими галогенидами с образованием С‑С‑связей по типу реакции Вюрца–Фиттига. Так, например, фенилмагнийбромид реагирует с аллилхлоридом с образованием аллилбензола:
![]()
По схеме гетеросочетания реактивы Гриньяра реагируют и с другими органическими галогенидами с активными атомами галогена (например, с α‑хлорзамещёнными простыми эфирами).
Заметное различие в реакционной способности магний- и литий- органических соединений демонстрируется в реакциях гетеросочетания с такими третичными галогенидами, как третбутилбромид. Литийорганическое соединение, представляющее собой сильное основание, реагирует с третбутилбромидом с отщеплением бромистого водорода, тогда как реактив Гриньяра реагирует с этим галогенидом, замещая атом брома по механизму SN1:


Много внимания уделяется реакциям гетеросочетания реактивов Гриньяра с алкинильными, алкенильными и арильными галогенидами. Выходы в этих реакциях могут быть значительно повышены добавлением таких катализаторов, как соли меди, серебра, железа или никеля в стехиометрическом или в каталитическом количестве. В качестве примера можно привести реакцию (S)-(4-метилциклогексилиден)-бромметана с метилмагнийбромидом:

В присутствии никелевых и кобальтовых катализаторов эта реакция протекает с сохранением хиральности, тогда как катализаторы с ионами серебра приводят к полной рацемизации продукта реакции.
основная область применения магнийорганических соединений представлена реакциями с образованием С–С-связей в результате их присоединения к карбонильным группам в составе альдегидов, кетонов или сложных эфиров, а также в результате присоединения к иминам, нитрилам и диоксиду углерода.
4)Взаимодействие реактива Гриньяра с карбонильной группой представляет собой восстановительный процесс, поскольку образование новой С–С-связи приводит к превращению карбонильной группы в спиртовую:
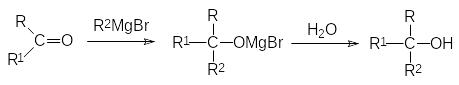
Если в этой реакции R1 означает атом водорода, то продуктом реакции становится вторичный спирт, а взаимодействие с реактивом Гриньяра кетона (R1 означает органический остаток) приводит к третичному спирту.
Литийорганические соединения реагируют с кетонами так же, как и магнийорганические соединения. Однако они более реакционноспособны, что позволяет использовать их в тех случаях, когда реактивы Гриньяра с кетонами не реагируют. В соответствии с этим реакции по карбонильным группам стерически затруднённых кетонов лучше проводить с литийорганическими соединениями. Так, например, для получения триизопропилкарбинола проводят взаимодействие диизопропилкетона с изопропиллитием:
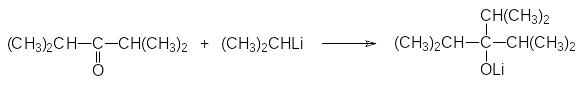
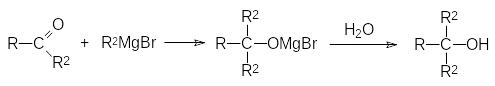
5)Действие реактивов Гриньяра на сложные эфиры (в приведенном выше общем уравнении R означает алкоксильную группу) также приводит к образованию третичных спиртов, поскольку образующиеся в результате первичного присоединения магнийорганического соединения аддукты разлагаются на алкоголят и кетон:
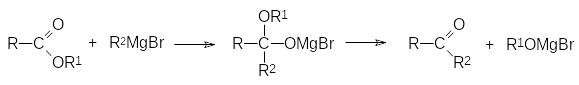
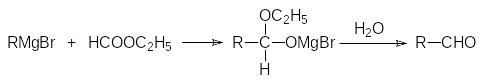
На первой стадии реакцию можно остановить только с эфирами муравьиной кислоты. В соответствии с этим 6)гидролиз продуктов присоединения реактивов Гриньяра к формиатам приводит к альдегидам:
7)Гладко реагируют с реактивами Гриньяра ортоэфиры карбоновых кислот:
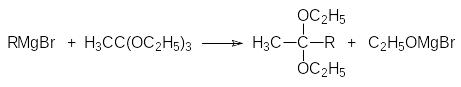
Образующиеся при этом кетали можно перевести в кетоны действием водных растворов сильных кислот.
8)Взаимодействие реактивов Гриньяра с триэтилортоформиатом можно использовать для получения альдегидов. Так, например, из полученного на основе 2-бромтиофена магнийорганического соединения и триэтилортоформиата получают 2‑формилтиофен:
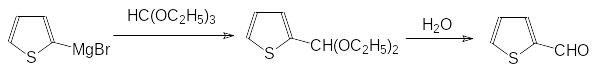
9)С низкой скоростью идёт взаимодействие реактивов Гриньяра с нитрилами. При длительном кипячении в эфире или при нагревании в растворителях с более высокой температурой кипения в этой реакции образуются соли кетиминов, гидролиз которых приводит к кетонам:
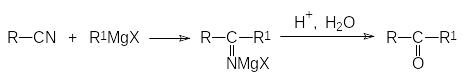
При пониженных температурах и при интенсивном перемешивании проводят 9)реакцию реактивов Гриньяра с диоксидом углерода, протекающую с образованием солей соответствующих карбоновых кислот:
![]()
Поддерживая температуру от 10 до –10 °С, при перемешивании пропускают диоксид углерода над эфирным раствором реактива Гриньяра. Такой способ введения в реакцию диоксида углерода нужен для того, чтобы осадок образующей соли карбоновой кислоты не забивал трубку для подачи СО2. Можно также приливать раствор магнийорганического соединения к измельченной твёрдой углекислоте. Для протекания реакции с некоторыми магнийорганическими соединениями, полученными из третичных галогенидов, требуется повышенное давление СО2.
10)Реактивы Гриньяра присоединяются также к кратным связям с участием других гетероатомов, например, к С=S-связям в тиоэфирах или к кратным СN‑связям в иминах или в карбодиимидах.
11)Реактивы Гриньяра реагируют с алкиленоксидами с раскрытием оксиранового цикла, например, по схеме:
![]()
В результате реакции с этиленоксидом образуется первичный спирт, с увеличенной на две метиленовых группы углеводородной цепью. При взаимодействии с замещёнными оксиранами органический остаток в составе реактива Гриньяра присоединяется к наименее стерически затрудненному атому углерода:

По аналогичной схеме реагируют с магнийорганическими соединениями оксетаны. При этом продуктами реакции становятся спирты с углеводородной цепью, удлиненной на три атома углерода:
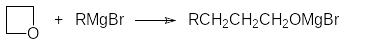
Общая картина превращений, протекающих с использованием реактивов Гриньяра, представлена схемой, в которой в качестве исходного соединения используется метилмагнийбромид:

12)В отдельных случаях стерически затрудненные карбонильные соединения или стерически затрудненные реактивы Гриньяра реагируют с образованием енольных производных. Чаще всего енолизация при действии стерически затрудненных магнийорганических соединений протекает с СН-кислотами, представленными β-дикарбонильными соединениями:

В некоторых случаях реактивы Гриньяра с атомами водорода в β‑положении восстанавливают карбонильные соединения вместо того, чтобы присоединяться по двойной связи:

13)Взаимодействие алкильных магнийорганических соединений с α,β‑ненасыщенными карбонильными соединениями протекает обычно с образованием смеси продуктов 1,2- и 1,4-присоединения, например:

В реакции циклогексен-3-она с этилмагнийбромидом 3-гидрокси-3-этилциклогексен (продукт 1,2-присоединения) образуется с выходом 52 %, выход продукта 1,4-присоединения (3-этилциклогексанона) составляет 24 %, а третбутилмагнийхлорид реагирует с циклогексен-3-оном только по схеме 1,4‑присоединения с образованием 3-третбутилциклогексанона с выходом до 70 %. В отличие от этого аллильные и ароматические магнийорганические соединения всегда реагируют с ненасыщенными кетонами по схеме 1,2‑присоединения.
14)Магнийорганические соединения, полученные из третичных алкилгалогенидов или арилгалогенидов, реагируют с бромидом серебра, хлоридом или бромидом меди(II) по схеме реакции Вюрца, например, по реакции:
![]()
2. ЭОС Литий, натрий.docx
