
- •1. Стабильность Si-c-связей, влияние заместителей в связанном с атомом кремния остатке.
- •2. Реакция Пудовика. Исходные соединения, связь с реакцией Кабачника—Филдса в варианте с основаниями Шиффа.
- •3. Реакционная способность и стабильность металлорганических соединений. Основные способы получения металлорганических соединений.
- •4. Способы получения и химические свойства литийорганических соединений.
- •5. Получение алкиларсиновых кислот по реакции Мейера, получение ариларсиновых кислот по реакции Барта.
- •6. Реакции литий- и магнийорганических соединений с альдегидами, кетонами, сложными эфирами, ортоэфирами и нитрилами.
- •7. Номенклатура фосфорорганических соединений и органических производных серы.
- •8. Роль растворителей при получении литий- и магнийорганических соединений.
- •9. Исходные продукты для получения тиофосфатов с инсектицидной активностью (хлортиофосфаты и дитиофосфаты), получение фоксима и карбофоса.
- •10. Способы получения, токсические характеристики и практическое использование органических производных свинца
- •11. Гидролиз и ацидолиз эфиров кислот фосфора. Получение триметилсилильных эфиров кислот фосфора, реакция МакКенны.
- •12. Реакции ацидолиза эфиров кислот фосфора, ацидолиз при получении диалкилфосфитов, условия перегонки реакционных масс. Окисление и галогенирование диалкилфосфитов.
- •13. Получение кремнийорганических аналогов биологически активных веществ, получение силамепробамата. Эффект замены атома углерода на атом кремния в биоактивных соединениях.
- •1) Получение:
- •2) Получение силамепробамата
- •3) Эффект замены
- •14. Метаболизм кремнийорганических соединений.
- •15. Способы получении и свойства алюминийорганических соединений. Применение в производстве полимеров
- •16. Жидкость Кадэ. Хлорвинилхлорарсины, получение, токсические характеристики, механизм действия, антидоты.
- •17. Получение эфиров арилбороновых кислот и использование их в реакции Сузуки.
- •18. Взаимодействие α-галогензамещеных кетонов с триалкилфосфитами (реакция Перкова и Михаэлиса-Арбузова). Винилфосфаты в качестве ингибиторов холинэстеразы.
- •19. Механизм гербицидной активности глюфосината (фосфинотрицина), способы его получения. Токсичность и побочные эффекты для теплокровных.
- •20. Получение кремнийорганических соединений
- •21. Получение силиконовых полимеров, регуляция молекулярной массы, вулканизация. Их практическое использование.
- •22. Реакции Барта и Несмеянова.
- •23. Способы получения диэфиров фосфористой кислоты.
- •24. Примеры фосфорорганических соединений с инсектицидной активностью, получение диалкилхлортиофосфатов. Механизм выработки резистентности на примере карбофоса.
- •25.Реакция Вюрца-Фиттига, механизм избирательности в варианте Фиттига. Промежуточные продукты в реакциях арилхлоридов с хлоридами элементов и металлическим натрием.
- •27. Способы получения и свойства цинкорганических соединений, использование их в реакции Реформатского и для получения карбонильных соединений.
- •28. Ртутьорганические соединения. Способы получения и химические свойства. Гранозан (этилмеркурхлорид), токсичность органических производных ртути.
- •29. Превращения функционализированных по β-положению кремнийорганических соединений.
- •30. Ингибирование холинэстеразы соединениями с ацилирующей способностью, особенности ингибирования производными кислот фосфора, формула Шрадера.
- •31. Способ получения и биологическая активность силатранов
- •32. Способы получения и биологическая активность органических производных германия, герматраны.
- •33. Получение триариловых и триалкиловых эфиров фосфористой кислоты.
- •34. Способы получения и практическое использование оловоорганических соединений.
- •35. Механизм реакции Михаэлиса-Арбузова, реакционная способность исходных соединений, побочная реакция.
- •36. Способы получения мышьякорганических соединений, Реакция Бешама. Сальварсан
- •37. Механизм реакции Михаэлиса-Беккера, получение натриевой соли диалкилфосфористой кислоты, ее реакционная способность, побочные продукты в реакции Михаэлиса- Беккера.
- •38. Биологическая активность бисфосфонатов. Примеры и способы получения бисфосфонатных средств для лечения остеопороза
- •39. Способы получения и свойства борорганических соединений.
- •40. Реакция диалкилфосфитов с изоцианатами, побочная реакция. Получение кренайта, механизм биологической активности.
- •41. Получение илидных соединений из диалкилсульфидов и диметилсульфоксида, синтез на их основе оксиранов и циклопропанов.
- •43. Реактивация ацилированной фосфорорганическими соединениями холинэстеразы производными гидроксиламина, оксимы в качестве антидотов и фоксим.
- •44.Синтез и свойства тиольных соединений алифатического ряда
- •46. Гербицидная активность фосфонометилглицина (глифосата). Способы его получения. Экологические последствия использования глифосата.
- •47. Синтез и свойства тиольных соединений ароматического ряда.
- •48. Три возможных направления использования кремнийорганических соединений в химии биологически активных соединений, привести примеры.
- •49. Получение арсоновых и арсиновых кислот по реакциям Барта и Мейера.
- •50. Зависимость токсичности от строения для фосфорорганических соединений, эмпирическая формула Шрадера.
- •51. Фосфорорганические соединения с противовирусной активностью. Получение фосфонуксусной кислоты и тринатриевой соли фосфонкарбоновой кислоты. Механизм противовирусной активности.
- •52.Взаимодействие трихлорида мышьяка с ароматическими соединениями и с ацетиленом, токсичность α-, β- и γ-льюизита, дифенилхлорарсин и фенарсазинхлорид.
- •53. Зависимость токсичности от строения в ряду нитрофениловых эфиров фосфорной и тиофосфорной кислоты. Получение о-метил-о-этилового эфира хлорангидрида тиофосфорной кислоты.
- •54. Способы получения и свойства тиофосфорных и тиофосфористых кислот. Правило жмко в реакции их солей с органическими галогенидами
- •55. Получение трифенилфосфина, образование илидов трифенилфосфония, механизм реакции Виттига. Синтез сквалена по реакции Виттига.
- •56. Реакция Хорнера-Вадсворта-Эммонса, синтез фосфонацетатов по реакции Михаэлиса-Арбузова и по реакции Михаэлиса-Беккера.
- •57. Способы получения и свойства сульфокислот алифатического и ароматического ряда.
- •58.Биологическая активность синтетических селенорганических соединений. Получение и антиоксидантная активность эбселена.
- •59.Получение и химические свойства диметилсульфоксида в качестве растворителя и реагента
- •60.Роль серосодержащих аминокислот в составе белков и в метаболизме. Биосинтез цистеина.
27. Способы получения и свойства цинкорганических соединений, использование их в реакции Реформатского и для получения карбонильных соединений.
Получение:
1) основной способ – реакция металлического натрия с первичными и вторичными алкилиодидами, при этом используют цинк, активированный медью. Получаемые по этой реакции алкилцинкиодиды представляют собой белые кристаллические вещества и при нагревании разлагаются на иодид цинка и диалкильные производные цинка:
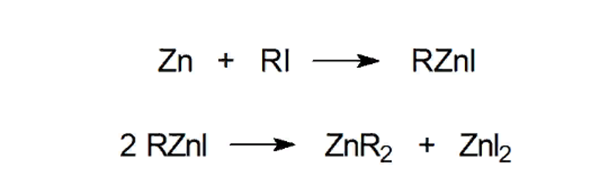
алкилцинкиодиды представляют собой белые кристаллические вещества .
2) Диалкильные и диарильные производные цинка, а также соответствующие органические цинкгалогениды можно получать действием растворов реактивов Гриньяра в эфире на безводный хлорид цинка:

Диалкильные производные цинка представляют собой стабильные в бескислородной атмосфере соединения, которые можно перегонять при температурах до 200 °С.
Этот способ можно также использовать для получения дивинилцинка и диаллилцинка.
3) Реакция диалкильных производных ртути с металлическим цинком. Чистые диарильные производные цинка лучше всего получаются по этой реакции при нагревании диарилртути и цинка в кипящем ксилоле или по реакции хлорида цинка с ариллитием.
4) Действием азометана на хлорид цинка можно получать хлорметильные производные цинка:
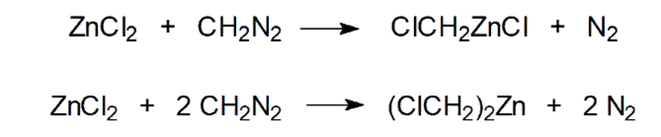
Использование: Цинкорганические соединения не имеют такого препаративного значения, как реактивы Гриньяра и литийорганические соединения. Их используют в тех случаях, когда есть необходимость в проведении реакции с участием металлорганического соединения с пониженной реакционной способностью.
Свойства
1) в реакции цинкорганических соединений с хлорангидридами карбоновых кислот образуются кетоны:

Взаимодействие хлорангидридов кислот с реактивами Гриньяра привело бы к образованию третичных спиртов в качестве основных продуктов реакции, а с цинкорганическими соединениями реакция останавливается на стадии образования кетона.
2) Реакция Реформатского – из кетонов, металлического цинка и α галогенированных сложных эфиров образуются эфиры β гидроксизамещённых сложных эфиров по схеме:
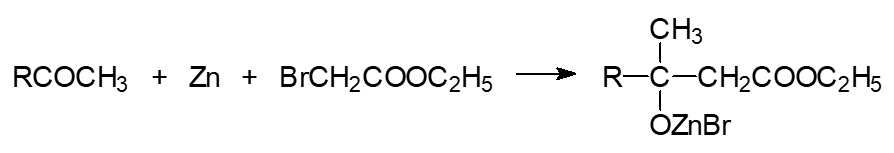
28. Ртутьорганические соединения. Способы получения и химические свойства. Гранозан (этилмеркурхлорид), токсичность органических производных ртути.
Химические свойства:
Ртутьорганические соединения достаточно инертны. В нормальных условиях они не реагируют с кислородом воздуха и с водой, поэтому работать с ними проще, чем с реакционноспособными органическими производными других металлов. Данные соединения также обладает высокой токсичностью, чаще всего превышающую токсичность элементной ртути, заставляет предпринимать особые меры предосторожности при работе с ними. Особенно опасны летучие алкильные производные ртути.
Способы получения:
1) Общий способ – реакция алкил- или арилгалогенидов или же алкилсульфатов с амальгамой натрия с получением диалкильных и диарильных производных ртути:
![]()
2) В лабораторных условиях диалкильные и диарильные производные ртути можно получать по реакции дихлорида ртути с реактивами Гриньяра или с другими реакционноспособными металлорганическими соединениями:
![]()
3) Диспропоционирование:
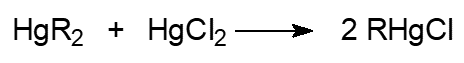
4) Несимметричные диарильные, диалкильные и алкиларильные ртутьорганические соединения получают взаимодействием соответствующих органических меркургалогенидов с реактивами Гриньяра, например:
![]()
5) Реакция Несмеянова – двойные соли арилдиазония и дихлорида ртути разлагают в присутствии порошкообразной меди в холодном ацетоне или в воде с образованием солей арилртути:
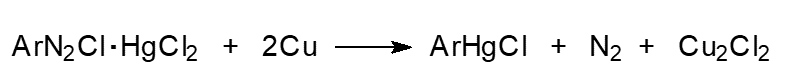
6) Прямое меркурирование ароматических соединений солями ртути - замещение водорода атомом ртути:
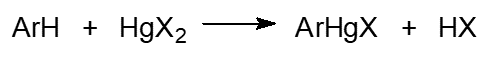
7) Соли ртути присоединяются по двойным связям олефинов, например, при пропускании этилена в водный раствор ацетата ртути образуется 2‑гидроксиэтилмеркурацетат:

Ртутьорганические соединения в ограниченном масштабе применяются в составе протравителей семян. Чаще всего для этого используют этилмеркурхлорид (гранозан) с острой токсичностью (ЛД50) 30–50 мг/кг. У этого кристаллического вещества неожиданно высокое для солей давление паров и высокая кожно-резорбтивная активность, что делает его очень опасным.
Производство гранозана основано на реакциях:
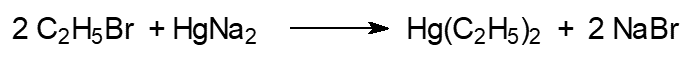
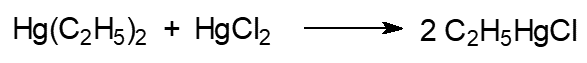
Сначала действием этилбромида на амальгаму натрия получают диэтилртуть, которая по реакции с сулемой превращается в этилмеркурхлорид. Попадающие в организм соединения ртути выводятся очень медленно, поэтому при регулярном употреблении пищи или воды даже с минимальными концентрациями ртути происходит её накопление с самыми серьёзными последствиями для здоровья.
