
- •Часть 1
- •Введение
- •Методические указания
- •Контрольная работа по физике №1
- •Студента группы рк-001
- •Шифр 257320
- •Иванова Петра Ивановича
- •1. Механика
- •Кинематика материальной точки и поступательного движения абсолютно твёрдого тела
- •1.2. Динамика материальной точки и поступательного движения абсолютно твердого тела
- •1.3.Кинематика вращательного движения абсолютно твёрдого тела
- •1.4. Динамика вращательного движения
- •1.4.1. Момент инерции и момент импульса
- •1.4.2. Момент силы. Основной закон динамики вращательного движения
- •1.5.Механическая энергия, работа и мощность
- •1.5.1 Механическая работа при поступательном движении
- •1.5.2. Кинетическая и потенциальная энергия
- •1.5.3. Работа и мощность при вращательном движении
- •1.6. Законы сохранения
- •1.6.1. Закон сохранения импульса
- •1.6.2. Закон сохранения момента импульса
- •1.6.3. Закон сохранения механической энергии
- •1.7. Механика жидкостей и газов
- •1.7.1. Идеальная жидкость. Уравнение неразрывности. Уравнение Бернулли
- •1.7.2. Вязкость. Ламинарный и турбулентный режимы течения жидкостей
- •1.8. Механика деформируемых тел
- •1.8.1. Идеально упругое тело. Упругие напряжения
- •1.8.2 Одноосное растяжение и сжатие
- •1.8.3. Сдвиг
- •1.8.4. Кручение
- •1.9. Примеры решения задач
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Задача № 6
- •Решение.
- •Решение
- •Решение
- •Решение
- •1.10. Задачи для контрольных заданий
- •2. Основы молекулярно - кинетической теории
- •2.1. Идеальный газ. Уравнение состояния. Основное уравнение молекулярно - кинетической теории
- •2.2. Распределение молекул по скоростям
- •2.3. Идеальный газ в поле сил тяжести. Распределение Больцмана
- •2.4. Эффективный диаметр и средняя длина свободного пробега молекул
- •2.5. Внутренняя энергия идеального газа. Теплота и работа. Первое начало термодинамики
- •2.6. Изопроцессы. Применение первого начала термодинамики к различным процессам. Адиабатный процесс
- •2.7. Круговые процессы. Цикл Карно. Второе начало
- •2.8. Энтропия
- •2.9. Примеры решения задач
- •Решение
- •Решение.
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Р ешение
- •Решение
- •2.10 Задачи для контрольных заданий
- •2.16. Азот находится при нормальных условиях. Найти:
- •3. Электростатика
- •3.1. Электрический заряд. Закон сохранения электрического заряда. Закон Кулона
- •Электростатическое поле. Напряженность электростатического поля. Принцип суперпозиции полей
- •3.3. Линии напряжённости. Поток вектора напряжённости. Теорема Гаусса
- •3.4. Работа сил электрического поля. Потенциал
- •3.5. Эквипотенциальные поверхности. Связь между напряженностью и потенциалом
- •3.6. Проводники в электрическом поле
- •3.7. Диэлектрики в электрическом поле
- •3.8. Электроемкость уединенного проводника.
- •3.9. Энергия электрического поля
- •3.10. Примеры решения задач
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •3.11. Задачи для контрольных заданий
- •4. Законы постоянного тока
- •4.1. Сила и плотность тока. Сторонние силы, эдс и напряжение
- •4.2 Обобщённый закон Ома. Дифференциальная форма закона Ома
- •4.3. Работа тока. Закон Джоуля - Ленца
- •4.4. Правила Кирхгофа и их применение к расчёту электрических цепей
- •4.5. Примеры решения задач.
- •Решение
- •Подставляя это выражение в (1), получим
- •Решение Из условия равномерности возрастания тока следует
- •Решение
- •4.6. Задачи для контрольных заданий
- •5. Варианты контрольных заданий
- •П. 1. Скалярное произведение двух векторов
- •П. 1. Векторное произведение двух векторов
- •Приложение 2
- •П. 2. Таблица простейших производных.
- •Приложение 3 Элементы интегрального исчисления Интегрирование– действие обратное дифференцированию
- •Неопределенный интеграл
- •Приложение 4
- •Приложение 5 Некоторые астрономические величины
- •Приложение 6 Основные физические постоянные
- •Приложение 7 Плотности ρ твёрдых тел, жидкостей и газов
- •Приложение 8 Диэлектрическая проницаемость ε
- •Удельное сопротивление ρ и температурный коэффициент α проводимости
- •Заключение
- •Библиографический список
- •Оглавление Введение…………………………………………………………..3
- •Кинематика материальной точки и поступательного движения абсолютно твёрдого тела……………….….5
- •1.2. Динамика материальной точки и поступательного
- •2.5. Внутренняя энергия идеального газа. Теплота и работа.
- •Часть 1 механика, молекулярная физика, термодинамика и электродинамика
- •394026 Воронеж, Московский просп.,14
- •Часть 1
2.9. Примеры решения задач
Задача 1. В сосуде объёмом V=5 л находится азот массой m=1,4 г при температуре Т=1800 К. Найти давление газа, имея в виду, что при этой температуре =30% молекул диссоциировано на атомы.
Решение
Так как часть молекул диссоциирована на атомы, то в сосуде находится смесь двух газов с молярными массами М1=28 г и М2 = М1/2 =14 г. Уравнения состояния обоих газов имеют вид:
![]() (1)
(1)
![]() (2)
(2)
где P1 и P2 – парциальные давления молекулярного (N2) и атомарного (N1) азота. Давление смеси газов подчиняется закону Дальтона:
![]()
Сложим уравнения (1) и (2):
![]()
![]()
Так как m1+m2=m (масса газа), то
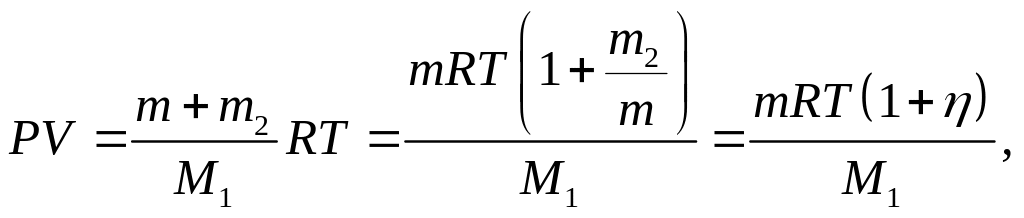
Отсюда,
![]()
Ответ:
![]()
Задача 2. Какая часть молекул водорода, находящегося при температуре Т=900 К, обладает скоростями, отличающи- мися от наиболее вероятной скорости не более, чем на 5 м/с?
Решение.
Для решения задачи удобно воспользоваться распределе- нием молекул по относительным скоростям u:
![]()
где
![]() Так как часть молекул обладает
скоростями превышающими vв,
а часть меньшими, чем νв,
то
Так как часть молекул обладает
скоростями превышающими vв,
а часть меньшими, чем νв,
то
![]()
Наиболее вероятная скорость при Т=900 К
![]()
![]()
![]()
![]()
Ответ: 0,3 % молекул.
Задача 3. На какой высоте давление воздуха составляет 60 % от давления на уровне моря? Считать температуру воздуха везде одинаковой и равной 10О С.
Решение
Зависимость давления от высоты имеет вид:
![]()
На уровне
моря h0=0, поэтому
![]()
Прологарифмируем обе части
![]()
Отсюда,
![]()
Ответ:
![]() .
.
Задача
4. Найти среднюю продолжительность
![]() свободного пробега молекул кислорода
при температуре Т=250 К и давлении
P=100 Па.
свободного пробега молекул кислорода
при температуре Т=250 К и давлении
P=100 Па.
Решение
Средняя продолжительность свободного пробега молекул – величина, обратная среднему числу столкновений, происходящих за 1 секунду:
![]()
Так как
![]() то
то
![]() .
.
Здесь
![]() - средняя арифметическая скорость
молекул кислорода
- средняя арифметическая скорость
молекул кислорода
![]()
где n – концентрация молекул кислорода.
Из уравнения состояния идеального газа
![]()
![]()
Эффективный
диаметр молекул кислорода (величина
справочная) d = 0,36 нм =
![]() .
.
![]()
Ответ:
![]()
Задача
5. Идеальный
газ с =1,4
расширяется изотерми- чески от объёма
V1 = 0,1 м3 до объёма
V2 = 0,3 м3.
Конечное давление газа
![]() Па. Определить приращение внутрен-
ней энергии газа, совершённую газом
работу и количество теплоты, полученное
газом.
Па. Определить приращение внутрен-
ней энергии газа, совершённую газом
работу и количество теплоты, полученное
газом.
Решение
Так как температура газа не изменится, то приращение его внутренней энергии U=0. Тогда первое начало термо- динамики запишется в виде:
![]()
Работа при
изотермическом процессе
![]()
Значение
vRT найдём из уравнения состояния
идеального газа
![]()
Тогда
![]() .
.
![]()
Ответ:
![]()
![]()
Задача 6. Определить отношение удельных тепло- ёмкостей для смеси газов, содержащей гелий массой m1=8 г и водород массой m2 = 2 г.
Решение
Для
нагревания смеси газов массой
![]() на T при
постоянном объёме ей необходимо сообщить
количество теплоты
на T при
постоянном объёме ей необходимо сообщить
количество теплоты
![]() где
где
![]() -
удельная теплоёмкость смеси.
-
удельная теплоёмкость смеси.
Часть этого
количества теплоты,
![]() пойдёт на нагревание гелия, другая часть
пойдёт на нагревание гелия, другая часть
![]() - на нагревание водорода.
Тогда
- на нагревание водорода.
Тогда
![]() ,
,
![]()
Отсюда
![]() .
.
Аналогично находим ср смеси:
![]() .
.
Здесь
![]() ,
,![]() и
и
![]() ,
,![]() -
удельные теплоёмкости гелия и водорода
соответственно:
-
удельные теплоёмкости гелия и водорода
соответственно:
![]()
Так как гелий – газ одноатомный, то i1=3, водород – газ двухатомный, следовательно, i2=5.
Отношение удельных теплоёмкостей:
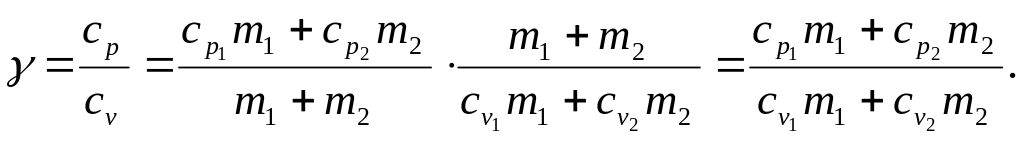
Подставляя выражение для удельных теплоёмкостей, получим:
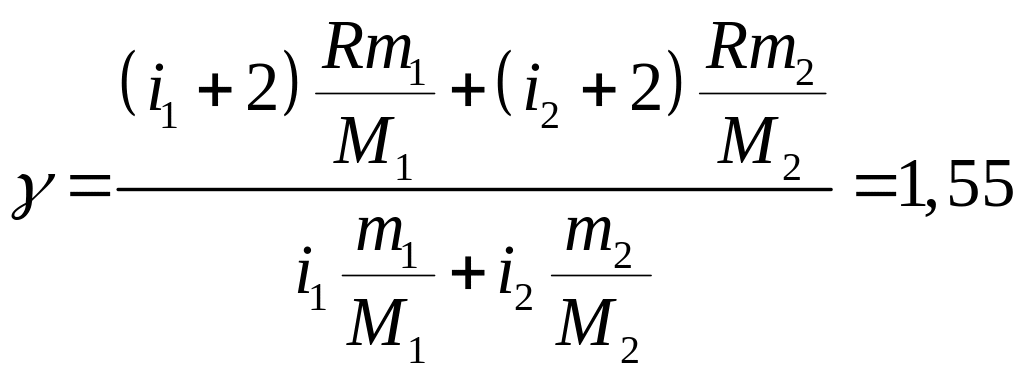 .
.
Ответ:
![]()
Задача 7. При адиабатном расширении (v = 2 моль) кислорода, находящегося при нормальных условиях, его объём увеличился в n = 3 раза. Определить изменение внутренней энергии газа и работу расширения газа.
