
- •Часть 1
- •Введение
- •Методические указания
- •Контрольная работа по физике №1
- •Студента группы рк-001
- •Шифр 257320
- •Иванова Петра Ивановича
- •1. Механика
- •Кинематика материальной точки и поступательного движения абсолютно твёрдого тела
- •1.2. Динамика материальной точки и поступательного движения абсолютно твердого тела
- •1.3.Кинематика вращательного движения абсолютно твёрдого тела
- •1.4. Динамика вращательного движения
- •1.4.1. Момент инерции и момент импульса
- •1.4.2. Момент силы. Основной закон динамики вращательного движения
- •1.5.Механическая энергия, работа и мощность
- •1.5.1 Механическая работа при поступательном движении
- •1.5.2. Кинетическая и потенциальная энергия
- •1.5.3. Работа и мощность при вращательном движении
- •1.6. Законы сохранения
- •1.6.1. Закон сохранения импульса
- •1.6.2. Закон сохранения момента импульса
- •1.6.3. Закон сохранения механической энергии
- •1.7. Механика жидкостей и газов
- •1.7.1. Идеальная жидкость. Уравнение неразрывности. Уравнение Бернулли
- •1.7.2. Вязкость. Ламинарный и турбулентный режимы течения жидкостей
- •1.8. Механика деформируемых тел
- •1.8.1. Идеально упругое тело. Упругие напряжения
- •1.8.2 Одноосное растяжение и сжатие
- •1.8.3. Сдвиг
- •1.8.4. Кручение
- •1.9. Примеры решения задач
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Задача № 6
- •Решение.
- •Решение
- •Решение
- •Решение
- •1.10. Задачи для контрольных заданий
- •2. Основы молекулярно - кинетической теории
- •2.1. Идеальный газ. Уравнение состояния. Основное уравнение молекулярно - кинетической теории
- •2.2. Распределение молекул по скоростям
- •2.3. Идеальный газ в поле сил тяжести. Распределение Больцмана
- •2.4. Эффективный диаметр и средняя длина свободного пробега молекул
- •2.5. Внутренняя энергия идеального газа. Теплота и работа. Первое начало термодинамики
- •2.6. Изопроцессы. Применение первого начала термодинамики к различным процессам. Адиабатный процесс
- •2.7. Круговые процессы. Цикл Карно. Второе начало
- •2.8. Энтропия
- •2.9. Примеры решения задач
- •Решение
- •Решение.
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Р ешение
- •Решение
- •2.10 Задачи для контрольных заданий
- •2.16. Азот находится при нормальных условиях. Найти:
- •3. Электростатика
- •3.1. Электрический заряд. Закон сохранения электрического заряда. Закон Кулона
- •Электростатическое поле. Напряженность электростатического поля. Принцип суперпозиции полей
- •3.3. Линии напряжённости. Поток вектора напряжённости. Теорема Гаусса
- •3.4. Работа сил электрического поля. Потенциал
- •3.5. Эквипотенциальные поверхности. Связь между напряженностью и потенциалом
- •3.6. Проводники в электрическом поле
- •3.7. Диэлектрики в электрическом поле
- •3.8. Электроемкость уединенного проводника.
- •3.9. Энергия электрического поля
- •3.10. Примеры решения задач
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •3.11. Задачи для контрольных заданий
- •4. Законы постоянного тока
- •4.1. Сила и плотность тока. Сторонние силы, эдс и напряжение
- •4.2 Обобщённый закон Ома. Дифференциальная форма закона Ома
- •4.3. Работа тока. Закон Джоуля - Ленца
- •4.4. Правила Кирхгофа и их применение к расчёту электрических цепей
- •4.5. Примеры решения задач.
- •Решение
- •Подставляя это выражение в (1), получим
- •Решение Из условия равномерности возрастания тока следует
- •Решение
- •4.6. Задачи для контрольных заданий
- •5. Варианты контрольных заданий
- •П. 1. Скалярное произведение двух векторов
- •П. 1. Векторное произведение двух векторов
- •Приложение 2
- •П. 2. Таблица простейших производных.
- •Приложение 3 Элементы интегрального исчисления Интегрирование– действие обратное дифференцированию
- •Неопределенный интеграл
- •Приложение 4
- •Приложение 5 Некоторые астрономические величины
- •Приложение 6 Основные физические постоянные
- •Приложение 7 Плотности ρ твёрдых тел, жидкостей и газов
- •Приложение 8 Диэлектрическая проницаемость ε
- •Удельное сопротивление ρ и температурный коэффициент α проводимости
- •Заключение
- •Библиографический список
- •Оглавление Введение…………………………………………………………..3
- •Кинематика материальной точки и поступательного движения абсолютно твёрдого тела……………….….5
- •1.2. Динамика материальной точки и поступательного
- •2.5. Внутренняя энергия идеального газа. Теплота и работа.
- •Часть 1 механика, молекулярная физика, термодинамика и электродинамика
- •394026 Воронеж, Московский просп.,14
- •Часть 1
2.2. Распределение молекул по скоростям
Беспорядочное движение молекул в газах даёт возможность при их исследовании пользоваться статистиче- скими методами.
Пусть скорости dN молекул попадают в интервал от до +d. Доля молекул, имеющих скорость в указанном интервале, по отношению к общему числу молекул равна вероятности P того, что молекулы имеют скорость ( +d):
![]() .
.
Вероятность P, отнесённая к ширине
интервала d,
называется плотностью вероятности
f():
![]() .
.
Зависимость плотности вероятности (доли) случайной величины от её значения называется функцией распределе- ния этой случайной величины.
Функция распределения скоростей молекул газа была получена Максвеллом и имеет следующий вид:
![]() (2.6)
(2.6)
Здесь N-общее число молекул, m-масса отдельной молекулы. Тогда число молекул, скорости которых заключены в пределах от до +d, определяется выражением
![]() .
(2.7)
.
(2.7)
График функции f(v) представлен на рис. 2.1.
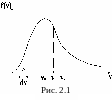
Площадь заштрихованного участка
![]() равна доле молекул, скорости которых
лежат в интервале от
до +d.
Площадь под всей кривой равна доле
молекул, скорости которых лежат в
интервале от 0 до
равна доле молекул, скорости которых
лежат в интервале от
до +d.
Площадь под всей кривой равна доле
молекул, скорости которых лежат в
интервале от 0 до
![]() ,
а это все молекулы, поэтому такая площадь
равна 1:
,
а это все молекулы, поэтому такая площадь
равна 1:
![]() .
.
Максвелловское распределение не меняется во времени, оно стационарно. Для данного газа оно зависит только от абсолютной температуры. На рис.2.2 приведены функции распределения скоростей для двух различных температур T1 и T2 (T2T1).
Рис. 2.2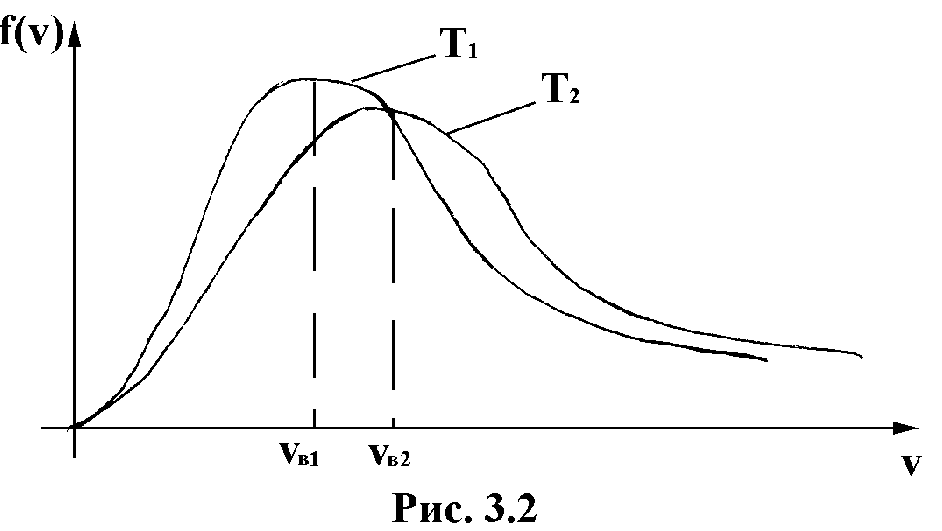
С ростом
температуры увеличивается доля молекул,
имеющих большую скорость. Скорость при
которой функция f(v)
достигает максимума называется наиболее
вероятной скоростью. Этой и близкой
к ней скоростью обладает наибольшее
число молекул. Значение наиболее
вероятной скорости можно найти из
условия
![]() .
.
![]() ,
(2.8)
,
(2.8)
где m - масса молекулы, М - молярная масса.
Наряду с наиболее вероятной скоростью в молекулярно-кинетической теории пользуются понятием средней арифметической и средней квадратичной скоростью.
Средняя арифметическая скорость молекул газа
![]() .
(2.9)
.
(2.9)
Эта скорость
не совпадает с наиболее вероятной (рис.
2.1), т. к. функция распределения скоростей
![]() несимметрична.
несимметрична.
Средняя квадратичная скорость молекул газа
![]() .
(2.10)
.
(2.10)
Она совпадает со значением, найденным из уравнения
![]()
2.3. Идеальный газ в поле сил тяжести. Распределение Больцмана
Если идеальный газ находится в поле
тяжести, то на каждую молекулу действует
сила
![]() .
Выделим в газе элементарный объём dV
высотой dh с единичной
площадью основания. Условие равновесия
этого объёма:
.
Выделим в газе элементарный объём dV
высотой dh с единичной
площадью основания. Условие равновесия
этого объёма:
Р1=Р2+ nmgdh,
где Р2-давление у верхнего основания объёма dV, P1-у нижнего, m-масса молекулы газа, n-концентрация молекул. Отсюда dP = P2 - P1 = -nmgdh . Согласно уравнению (2.2) dP =kTdn. Тогда
k T dn= - n m g dh . (2.11)
Решение дифференциального уравнения (2.11) имеет вид:
![]() .
(2.12)
.
(2.12)
Эта функция называется функцией распределения Больцмана и характеризует зависимость концентрации молекул от высоты для случая, когда молекулы находятся в поле тяжести (т. е. от их потенциальной энергии). При этом начальный уровень h =0 может быть выбран произвольно. Воспользовавшись уравнением (2.2), получим зависимость давления от высоты (барометрическую формулу):
![]() . (2.13)
. (2.13)
