
- •Часть 1
- •Введение
- •Методические указания
- •Контрольная работа по физике №1
- •Студента группы рк-001
- •Шифр 257320
- •Иванова Петра Ивановича
- •1. Механика
- •Кинематика материальной точки и поступательного движения абсолютно твёрдого тела
- •1.2. Динамика материальной точки и поступательного движения абсолютно твердого тела
- •1.3.Кинематика вращательного движения абсолютно твёрдого тела
- •1.4. Динамика вращательного движения
- •1.4.1. Момент инерции и момент импульса
- •1.4.2. Момент силы. Основной закон динамики вращательного движения
- •1.5.Механическая энергия, работа и мощность
- •1.5.1 Механическая работа при поступательном движении
- •1.5.2. Кинетическая и потенциальная энергия
- •1.5.3. Работа и мощность при вращательном движении
- •1.6. Законы сохранения
- •1.6.1. Закон сохранения импульса
- •1.6.2. Закон сохранения момента импульса
- •1.6.3. Закон сохранения механической энергии
- •1.7. Механика жидкостей и газов
- •1.7.1. Идеальная жидкость. Уравнение неразрывности. Уравнение Бернулли
- •1.7.2. Вязкость. Ламинарный и турбулентный режимы течения жидкостей
- •1.8. Механика деформируемых тел
- •1.8.1. Идеально упругое тело. Упругие напряжения
- •1.8.2 Одноосное растяжение и сжатие
- •1.8.3. Сдвиг
- •1.8.4. Кручение
- •1.9. Примеры решения задач
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Задача № 6
- •Решение.
- •Решение
- •Решение
- •Решение
- •1.10. Задачи для контрольных заданий
- •2. Основы молекулярно - кинетической теории
- •2.1. Идеальный газ. Уравнение состояния. Основное уравнение молекулярно - кинетической теории
- •2.2. Распределение молекул по скоростям
- •2.3. Идеальный газ в поле сил тяжести. Распределение Больцмана
- •2.4. Эффективный диаметр и средняя длина свободного пробега молекул
- •2.5. Внутренняя энергия идеального газа. Теплота и работа. Первое начало термодинамики
- •2.6. Изопроцессы. Применение первого начала термодинамики к различным процессам. Адиабатный процесс
- •2.7. Круговые процессы. Цикл Карно. Второе начало
- •2.8. Энтропия
- •2.9. Примеры решения задач
- •Решение
- •Решение.
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Р ешение
- •Решение
- •2.10 Задачи для контрольных заданий
- •2.16. Азот находится при нормальных условиях. Найти:
- •3. Электростатика
- •3.1. Электрический заряд. Закон сохранения электрического заряда. Закон Кулона
- •Электростатическое поле. Напряженность электростатического поля. Принцип суперпозиции полей
- •3.3. Линии напряжённости. Поток вектора напряжённости. Теорема Гаусса
- •3.4. Работа сил электрического поля. Потенциал
- •3.5. Эквипотенциальные поверхности. Связь между напряженностью и потенциалом
- •3.6. Проводники в электрическом поле
- •3.7. Диэлектрики в электрическом поле
- •3.8. Электроемкость уединенного проводника.
- •3.9. Энергия электрического поля
- •3.10. Примеры решения задач
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •Решение
- •3.11. Задачи для контрольных заданий
- •4. Законы постоянного тока
- •4.1. Сила и плотность тока. Сторонние силы, эдс и напряжение
- •4.2 Обобщённый закон Ома. Дифференциальная форма закона Ома
- •4.3. Работа тока. Закон Джоуля - Ленца
- •4.4. Правила Кирхгофа и их применение к расчёту электрических цепей
- •4.5. Примеры решения задач.
- •Решение
- •Подставляя это выражение в (1), получим
- •Решение Из условия равномерности возрастания тока следует
- •Решение
- •4.6. Задачи для контрольных заданий
- •5. Варианты контрольных заданий
- •П. 1. Скалярное произведение двух векторов
- •П. 1. Векторное произведение двух векторов
- •Приложение 2
- •П. 2. Таблица простейших производных.
- •Приложение 3 Элементы интегрального исчисления Интегрирование– действие обратное дифференцированию
- •Неопределенный интеграл
- •Приложение 4
- •Приложение 5 Некоторые астрономические величины
- •Приложение 6 Основные физические постоянные
- •Приложение 7 Плотности ρ твёрдых тел, жидкостей и газов
- •Приложение 8 Диэлектрическая проницаемость ε
- •Удельное сопротивление ρ и температурный коэффициент α проводимости
- •Заключение
- •Библиографический список
- •Оглавление Введение…………………………………………………………..3
- •Кинематика материальной точки и поступательного движения абсолютно твёрдого тела……………….….5
- •1.2. Динамика материальной точки и поступательного
- •2.5. Внутренняя энергия идеального газа. Теплота и работа.
- •Часть 1 механика, молекулярная физика, термодинамика и электродинамика
- •394026 Воронеж, Московский просп.,14
- •Часть 1
2.5. Внутренняя энергия идеального газа. Теплота и работа. Первое начало термодинамики
Внутренняя энергия системы - энергия, зависящая только от её внутреннего состояния; она складывается из кинетической энергии хаотического движения атомов или молекул, потенциальной энергии межмолекулярных взаимодействий и энергии внутриатомных движений и взаимодействий. Поскольку в модели идеального газа потенциальная энергия межмолекулярных взаимодействий полагается равной нулю, то внутренняя энергия идеального газа определяется кинетической энергией теплового движения его молекул:
![]() ,
,
где N
- число молекул,
![]() - средняя энергия
одной молекулы.
- средняя энергия
одной молекулы.
Учитывая, что
![]() и
и
![]() ,
получим
,
получим
выражение для внутренней энергии идеального газа:
![]() , (2.22)
, (2.22)
и для её изменения
![]() . (2.23)
. (2.23)
Таким образом, внутренняя энергия зависит от состояния системы (от её абсолютной температуры), изменяется при изменении состоянии системы и не зависит от того пути, по которому система пришла в это состояние. Поэтому внутреннюю энергию называют функцией состояния.
Внутренняя энергия системы (её микроскопические параметры) может быть изменена только в результате взаимодействия системы с внешней средой. Такое взаимодей- ствие может происходить двумя способами: путём теплообмена и путём совершения механической работы.
Теплообмен - самопроизвольный необратимый процесс передачи энергии, происходящий в неоднородном температурном поле.
Существуют следующие способы теплообмена:
а) кондуктивный (теплопроводность) - передача внутренней энергии от одних тел к другим при их соприкосновении, обусловленная тепловым движением атомов (молекул);
б) конвективный - перенос энергии, происходящий при перемешивании неодинаково нагретых слоев газа или жидкости под действием силы тяжести и выталкивающей силы;
в) излучение - передача внутренней энергии без участия промежуточной среды путём испускания и поглощения электромагнитного излучения.
Мерой энергии, передаваемой системе при теплообмене, служит количество теплоты Q. Элементарное приращение количества теплоты dQ > 0, если оно передаётся системе, и dQ < 0, если система отдаёт энергию. Отношение элементарного количества теплоты dQ, сообщаемого системе при бесконечно малом изменении её состояния в каком-либо процессе, к соответствующему изменению dT её абсолютной температуры, называется теплоёмкостью системы:
![]()
![]() ;
. .
;
. .
Таким образом, теплоёмкость системы численно равна количеству теплоты, которое необходимо сообщить системе, для её нагревания на 1 К. Удельная теплоёмкость - физическая величина, равная количеству теплоты, которое необходимо сообщить 1 кг вещества для нагревания на 1 К:
![]()
![]()
; .
![]()
![]() Молярная теплоёмкость -
теплоёмкость одного моля вещества:
Молярная теплоёмкость -
теплоёмкость одного моля вещества:
.
Следует различать теплоёмкости cр , СР и cv, CV. Первые характеризуют теплообмен при постоянном давлении, а вторые - при постоянном объёме.
Так
как количество теплоты Q
не является параметром состояния
термодинамической системы, то малое
изменение количества теплоты
является не полным дифференциалом,
поэтому его обозначают
![]() Q
(сравните: внутренняя энергия системы
- функция состояния; малое изменение
внутренней энергии
- полный дифференциал dU).
Q
(сравните: внутренняя энергия системы
- функция состояния; малое изменение
внутренней энергии
- полный дифференциал dU).
Но состояние системы можно изменить и другим способом, совершая над системой работу или давая ей возможность самой совершать работу, то есть путём изменения макроскопических параметров системы.
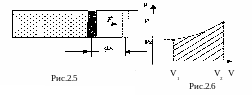 В качестве системы рассмотрим
идеальный газ в сосуде с подвижным
поршнем (рис 2.5).
В качестве системы рассмотрим
идеальный газ в сосуде с подвижным
поршнем (рис 2.5).
Если под действием силы
![]() ,
с которой газ действует на поршень,
последний переместился на расстояние
dx,
то газ совершил
работу
,
с которой газ действует на поршень,
последний переместился на расстояние
dx,
то газ совершил
работу
![]() ,
,
где P - давление газа, S - площадь поршня, dV = S dx -приращение объёма газа.
Элементарное
приращение работы
![]() -
не полный
дифференциал, так как работа зависит
не только от начального
и конечного состояния системы, но и от
формы пути, по которому система переходит
из одного состояния в другое,
а значит А
не является функцией состояния.
Если газ расширяется, то dV>0
и, совершаемая им работа
А
> 0, если сжимается - газ совершает
отрицательную работу,
А
< 0.
-
не полный
дифференциал, так как работа зависит
не только от начального
и конечного состояния системы, но и от
формы пути, по которому система переходит
из одного состояния в другое,
а значит А
не является функцией состояния.
Если газ расширяется, то dV>0
и, совершаемая им работа
А
> 0, если сжимается - газ совершает
отрицательную работу,
А
< 0.
При расширении (сжатии) газа может изменяться не только объём, но и его давление. Поэтому, чтобы найти работу при конечном изменении объёма, нужно знать зависимость р(V). Тогда работа определяется интегралом
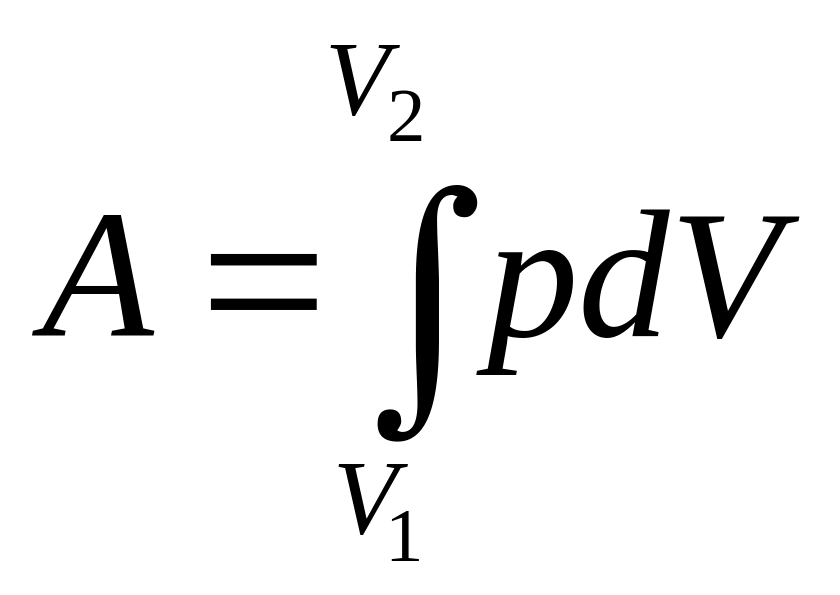 , (2.24)
, (2.24)
который численно равен площади заштрихованной фигуры (рис.2.6).
Закон сохранения энергии в области тепловых явлений называется первым началом термодинамики: теплота, сообщаемая системе, затрачивается на увеличение внутренней энергии системы и на работу, которую система совершает над внешней средой
![]() .
(2.25)
.
(2.25)
