
Лекции / Kurs_lektsiy_po_patofiziologii_Ch_3_2018
.pdf4.Количество факторов свертывания лимфы зависит от региональной специфики и физиологической активности дренируемой ткани. Оно различно в доузловой и послеузловой лимфе. В последней снижается количество фибриногена, противосвертывающих факторов, протромбинового комплекса; увеличивается содержание продуктов деградации фибрина.
5.Фибринолитическая активность лимфы значительно выше
фибринолитической активности крови, что предопределено отсутствием ингибиторов фибринолиза.
6.Ретракция сгустка лимфы из-за малого содержания в ней фиб-
риногена выражена слабо и может затягиваться на сутки и более.
Причинами прижизненного свертывания лимфы, как и крови мо-
гут быть травма, шок, воспаление, гипоксия, аллергия, дискинезия, эндо- и экзотоксикоз, некроз тканей, атеросклероз и другие заболевания и патологические процессы.
Пусковыми механизмами повышения свертывания лимфы являются:
−превалирование количества и активности факторов свертывания над факторами антисвертывания и фибринолиза;
−замедление или прекращение лимфообразования и транспорта лимфы;
−повреждение стенок лимфатических сосудов и внесосудистых тканей;
−проникновение в лимфу тромбоцитов, эритроцитов, продуктов некробиоза, бактериальных токсинов, тканевого тромбопластина, гистамина и других факторов, усиливающих процесс свертывания лимфы;
−недостаточное поступление антикоагулянтов в лимфу;
−снижение фибринолитической активности лимфы.
Действие этих механизмов «запускает» процесс лимфотромбоза. В лимфатических сосудах вокруг местного патологического процесса (например, воспаления, инфаркта, кровоизлияния, размозжения
тканей и др.) обычно развивается лимфотромбоз.
Лимфотромбоз рассматривают как эволюционно сформировавшуюся местную защитную реакцию противодействия лимфогенной диссеминации продуктов некробиоза, патогенных микроорганизмов, опухолевых клеток. Суть этой реакции состоит в защите «здоровых» органов, систем и всего организма. «Обратная сторона медали»
228
лимфотромбоза расширение зоны локального патологического процесса, инициируемого задержкой и накоплением токсичных патогенных факторов. При некоторых заболеваниях, например злокачественном новообразовании, необходимы меры с целью уменьшения лимфатического дренажа, таящего угрозу лимфогенного распространения злокачественных клеток. В ряде патологических ситуаций такая задержка оказывается более опасной, чем ее отсутствие. Например, при инфаркте миокарда лимфотромбоз, ведущий к блокаде лимфатического дренажа и задержке продуктов некробиоза, вызывает гибель жизнеспособных миоцитов и увеличение массы некроза.
Лимфокоагуляция может быть не только локальной, но и диссе-
минированной. Последнюю, по аналогии с синдромом диссеминированного внутрисосудистого свертывания крови (ДВС-синдром), обо-
значают как синдром диссеминированного внутрисосудистого свер-
тывания лимфы (ДВСЛ-синдром). Эти синдромы, как правило, развиваются параллельно, осложняют течение циркуляторных расстройств. Следовательно, терапию ДВС-синдрома необходимо проводить совместно с терапией ДВСЛ-синдрома.
6. ЛИМФАТИЧЕСКИЙ ОТЕК (ЛИМФЕДЕМА)
Лимфедема отек, обусловленный недостаточностью транспортной функции лимфатической системы. При нормальной лимфодренажной системе клапан открыт (рис. 7), при нарушенной лимфо дренажной системе клапан закрыт (рис. 8).
Выраженная степень такого нарушения – лимфатический отек, который может быть первичным и вторичным, острым и хроническим.
Первичная лимфедема возникает в результате врожденной дисплазии лимфатических сосудов.
Вторичная лимфедема развивается вследствие обструкции лимфатических путей, вызванной следующими причинами: 1) хирургическое удаление лимфатических сосудов и узлов; 2) эмболия лимфатических сосудов (опухолевыми клетками, конгломератами лимфоцитов, сгустками свернувшейся лимфы); 3) парез лимфатических сосудов после механического или радиационного повреждения.
229
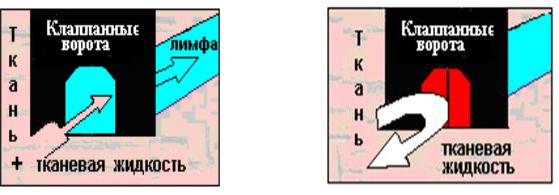
Рис. 7. Нормальная лимфодре- |
Рис. 8. Нарушенная лимфодре- |
нажная система |
нажная система |
Лимфедема нижних конечностей, нередко сочетающаяся с венозной недостаточностью, осложняется трофическими нарушениями и рожистым воспалением. Весьма серьезным осложнением лимфедемы является слоновость.
Слоновость заболевание, вызванное стабильным застоем тканевой жидкости и лимфы. Последнее приводит к разрастанию богатой коллагеном соединительной ткани и жировой клетчатки при минимальном представительстве нервных волокон, лимфатических и кровеносных сосудов. Слоновость может быть первичной (врожденной) и вторичной (приобретенной).
Первичная слоновость обычно возникает вследствие врожденной дисплазии лимфатических сосудов.
Вторичная слоновость развивается в результате осложнения хронического, чаще обструктивного, лимфостаза.
7. НАРУШЕНИЯ ФУНКЦИЙ ЛИМФАТИЧЕСКИХ УЗЛОВ
Оттекающая от органа или ткани лимфа, как правило, проходит хотя бы через один лимфатический узел, но чаще – через два и более, подвергаясь в них так называемой «физиологической обработке». При перфузии сыворотки, содержащей в 1 мл 600 млн колоний стрептококков, лимфатический узел задерживает 99 % вводимого их количества. Когда же количество поступающих в лимфатический узел токсичных метаболитов, метастазирующих клеток опухоли, продуктов некробиоза и других чужеродных веществ превышает физиологические пределы его барьерной способности, происходит их массовый прорыв в послеузловую лимфу и с ней через грудной проток в
230
кровь, со всеми вытекающими из-за этого негативными последствиями для организма.
При разнообразной патологии лимфатических узлов, вызванной как внешними, так и внутренними (по отношению к лимфатическому узлу) патогенными факторами, могут нарушаться следующие его основные функции: 1) барьерно-таможенная; 2) участие в лимфопоэзе; 3) обеспечение местного и системного иммунитета; 4) фагоцитирование поступивших с лимфой инородных тел; 5) синтез антител и др.
8. СОСТОЯНИЕ И РОЛЬ ЛИМФАТИЧЕСКОЙ СИСТЕМЫ И ТКАНЕВОГО ГУМОРАЛЬНОГО ТРАНСПОРТА ПРИ РАЗЛИЧНЫХ ВИДАХ ПАТОЛОГИИ
Нарушения функций лимфатической системы (ЛС) происходят под влиянием самых различных патогенных факторов. Сдвиги в ЛС и ТГТ при различных травмирующих внешних воздействиях носят типический характер
8.1. Влияние перегревания организма на лимфатическую систему
Воздействие повышенной внешней температуры, сопровождающееся увеличением температуры тела до 38,5-39,0°С, приводит к незначительным расстройствам микроциркуляции, ТГТ и лимфососудистого транспорта. Более выраженное перегревание ведет к метаболическим, и деструктивным расстройствам. Показано, что изменения ТГТ, ЛД и транспорта в лимфатических сосудах при общей гипертермии носят фазовый характер, развивающийся в три стадии: компенсации, декомпенсации и комы (рис. 9).
Первая стадия гипертермии организма характеризуется активацией лимфообразования и транспорта лимфы.
Вторая стадия проявляется нарастающим их угнетением. Третья стадия характеризуется развитием лимфостаза.
По мере развития недостаточности лимфатического дренажа в организме нарастают явления интоксикации.
231
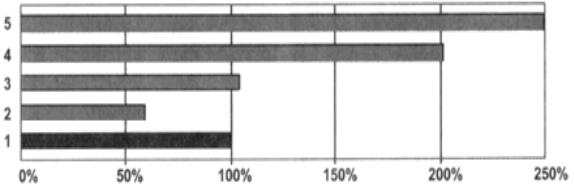
Рис. 9. Влияние внешнего перегревания на время удаления в лимфатическую систему метки, введенной в ткани брыжейки тонкой кишки наркотизированной мыши: 1 контроль, нормальная температура (время удаления метки принято за 100 %); 2-5 сроки перегревания: 2-5 мин; 3-10 мин, 4-15 мин, 5-20 мин)
8.2. Влияние переохлаждения организма на лимфатическую систему
Развитие гипотермии, так же, как и гипертермии (перегревания), принято делить на три стадии.
Первая стадия (компенсации) характеризуется активизацией движения интерстициальной жидкости, лимфообразования и лимфатического дренажа.
Вторая стадия (декомпенсации) нарастающим их угнетением. Третья стадия развитием лимфостаза.
Длительность и выраженность первой стадии могут колебаться в широких пределах, что зависит от интенсивности холодового воздействия и реактивности организма. При глубоком наркозе, шоке, коллапсе, тяжёлом отравлении эта стадия может отсутствовать. Длительность и выраженность второй стадии определяются скоростью и степенью срыва механизмов компенсации, а третьей стадии – интенсивностью охлаждения головного мозга.
Вышеотмеченный стадийный процесс характерен и для других видов патологий (переутомление, нервно-психический стресс и др.
8.3. Роль лимфатической системы в патогенезе воспаления
В развитии воспаления, наряду с кровеносной системой, важную, нередко решающую роль играет лимфатическая система.
232
Альтерация. Дистрофические процессы, охватывая морфологические элементы очага воспаления, коренным образом меняют условия интерстициального гуморального транспорта, образования первичной лимфы и её эвакуации. Основной причиной нарушения транспорта жидкости становится накопление электролитов, а также продуктов нарушенного белкового, жирового и углеводного обмена. Наблюдается деполимеризация белково-гликозаминогликановых комплексов, разрушение коллагеновых волокон, фибриноидное набухание, накопление рибонуклеиновой кислоты, мукоидоз. Разрушительную роль играют лизосомальные ферменты. Источником их высвобождения оказываются не только распавшиеся клетки охваченного воспалением клеточных структур органа, но и наводняющие воспалённую ткань разрушающиеся микрофаги (гранулоциты, особенно нейтрофилы, эпителиоциты и др.) и макрофаги (моноциты, гистиофаги и др.).
В реакции лимфатических сосудов при воспалении важную роль играют клеточные и плазменные низко- и высокомолекулярные медиаторы воспаления, особенно гистамин, серотонин, простагландины, интерлейкины, лейкотриены, факторы системы комплемента, аденозинтрифосфорная и адениловая кислоты и др.
Распавшиеся клетки, лежащие на поверхности выводных протоков (желёз, слизистых бронхов, трахеи, желудка, кишечника, мочевыводящих путей) и около них могут отторгаться, как в их просвет, так
ив лимфатические каналы. Ведущий путь очищения очага воспаления, локализованного вдали от выводных протоков, лимфатическое русло. На первом этапе воспаления в оттекающей от воспалительного очага лимфе увеличивается концентрация белков, липидов, липопротеидов, энзимов, повышается количество гранулоцитов, моноцитов, лимфоцитов, тромбоцитов и даже эритроцитов. Поступившие в лимфу в большом количестве продукты перекисного окисления липидов
ираспада клеточно-тканевых структур, а также экзо- и эндотоксинов, медиаторов воспаления и других ФАВ приводят к чрезвычайной токсичности лимфы.
Уконтрольных животных (1) скорость лимфатического дренажа (время выведения маркёра из ткани брыжейки) составляет меньше 40 мин. Центральная лимфа при её внутривенном введении в неразведённом виде (1 : 1) белым мышам с блокированной антитоксической системой не вызывала токсической реакции, все животные оставались живыми (рис. 10).
233
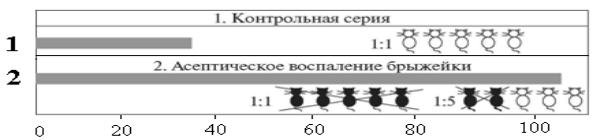
В отличие от этого при воспалении (2) лимфатический дренаж резко замедляется (рис. 10). Лимфа становится токсичной: её внутривенное введение в неразбавленном виде (1 : 1) мышам с блокированной защитной системой приводит к гибели всех мышей. И только при разведении в 5 раз в/в введение лимфы лишь у части (40 %) подопытных животных приводило к летальному исходу.
Рис. 10. Скорость лимфатического дренажа при асептическом воспалении в брыжейке тонкой кишки наркотизированных белых мышей
Очень скоро лимфатические пути в зоне воспаления оказываются частично разрушенными, частично парализованными или блокированными. Блокада окружающих патологический очаг лимфатических сосудов может быть охарактеризована как конфликт между интересами органа, в котором локализован патологический процесс, и интересами всего организма. Предупреждая диссеминацию патогенных микроорганизмов и продуктов распада, такая блокада защищает здоровые ткани. С другой стороны, она обусловливает их концентрирование в зоне повреждения, формируя и усиливая вторичную альтерацию.
Экссудация, вызванная альтерацией, в дальнейшем сама становятся важным фактором инициации патологических сдвигов в очаге воспаления. Активация гликолиза и аэробного окисления, распад клеток и белков приводят к повышению содержания притягивающих и удерживающих воду мелких молекул. Повышение онкотического и осмотического давления в очаге воспаления ведёт к набуханию и отёку клеточно-тканевых структур. Особое место в развитии тканевого отёка занимает муколитический энзим гиалуронидаза, при воспалении её количество и активность в тканях резко возрастает. Она осуществляет гидролиз гиалуроновой кислоты одного из полисахаридов основного вещества промежуточной ткани, что становится существенной причиной его гидратации. Воспалительный отёк может со-
234
храняться достаточно долго, чему способствует разрушение лимфатических капилляров и сосудов в очаге воспаления и их блокада в окружающих тканях.
Существенный элемент экссудации эмиграция лейкоцитов (лейкодиапедез), осуществляемый с участием находящихся в лейкоцитах протеолитических и гликолитических ферментов. Накопившиеся в огромном количестве в очаге воспаления эти клетки часто там распадаются, усугубляя местную интоксикацию. Задерживаясь в лимфатических сосудах, принимающих лимфу от очага воспаления, распадающиеся лейкоциты расплавляют их стенки, провоцируя диссеминированный мелкоочаговый лимфотромбоз.
Пролиферация (размножение элементов подвергнутой воспалению ткани) характеризуется интенсивным синтезом в клетках РНК, ДНК, ферментов, основного вещества. Определённое место в пролиферативном процессе занимает новообразование лимфатических капилляров и сосудов. Сначала пролиферируют соединительнотканные структуры, позже кровеносные и лимфатические капилляры, ещё позже специализированные клетки органа. Особенно выражено соединительнотканное перерождение в стазированных лимфатических сосудах в условиях хронического воспаления. Пролиферация соединительнотканных элементов опережает пролиферацию сосудов и специализированных клеток органа, требующих более благоприятных условий.
Важнейшей задачей патогенетической терапии воспаления яв-
ляется активизация и более раннее восстановление интерстициального гуморального транспорта и лимфатического дренажа.
8.4. Роль лимфатической системы в патогенезе атеросклероза
Как известно, две трети толщины стенки артерий не имеют vasa vasorum, что определяет особую уязвимость массопереноса в этом отделе гуморального транспорта. На интерстициальном гуморальном транспорте и лимфатическом дренаже артериальной стенки лежит значительная нагрузка по продвижению и выведению липопротеидов, холестерина и различных метаболитов. Развитию атеросклероза предшествуют нарушения в системе регионарного интерстициального гуморального транспорта и лимфатического дренажа, инициирующие накопление холестерина, атерогенных липопротеидов, солей кальция и формирование бляшек. О том, что затруднение лимфоттока
235
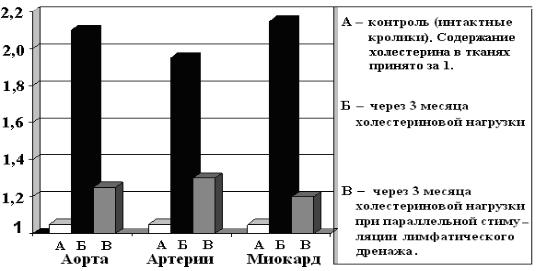
стимулирует развитие атеросклеротических изменений стенки аорты, артериальных сосудов и миокарда свидетельствуют следующие экспериментальные данные (рис. 11).
Рис. 11. Содержание холестерина в тканях контрольных (А) и подопытных (Б, В) кроликов (нормальное количество принято за единицу)
Кроликам в пищу добавляли холестерин и ограничивали отток лимфы от этих органов (путём локальной электрокоагуляции лимфатических сосудов). Уже через 2-3 месяца, при сравнении с интактными животными, в аорте, артериях и миокарде регистрировали существенное накопление холестерина. В условиях стимуляции лимфатического дренажа соответствующими препаратами холестерин накапливался значительно меньше. Одновременно обнаруживалось снижение содержания в крови свободного, эстерифицированного и общего холестерина, НЭЖК (и их комплексов с альбуминами), фосфолипидов, общих липидов и хиломикронов. Приведённые данные свидетельствуют о том, что активизация интерстициального гуморального транспорта и лимфатического дренажа в целях лечения атеросклероза патогенетически обоснована.
8.5. Роль лимфатической системы в патогенезе опухолевого процесса
Лимфатическая система играет ключевую роль в ограничении распространения различных опухолевых клеток по организму и образовании в нём метастазов.
236
Процесс метастазирования включает три этапа:
1.Преимущественное проникновение клеток первичной опухоли в ЛС, что для организма является более благоприятным, чем их поступление в кровь.
2.Фиксация в лимфатическом узле и уничтожение задержанных опухолевых клеток. Если этого не происходит, то в ЛС образуются метастазы.
3.При недостаточности барьерной функции лимфатических узлов мигрирующие клетки опухоли через грудной проток попадают в кровь, разносятся по организму и могут образовывать метастазы.
Вначальной стадии опухолевого процесса в регионарных лимфати-
ческих узлах возникают сдвиги, свидетельствующие о напряжении защитных функций. Происходит гиперплазия лимфоидной ткани, ретикулярных клеточных элементов, увеличивается содержание РНК и т.д.
При прогрессировании опухолевого процесса защитная функция лимфоидной ткани, лимфатических узлов постепенно снижается. На это влияют многие факторы: злокачественность первичной опухоли, количество поступающих в лимфатический узел опухолевых клеток, реактивное состояние лимфатического узла и всего организма, выраженность возрастной инволюции лимфатической системы, состояние иммунитета и др.
Защитную роль лимфатической системы при опухолевом процессе иллюстрируют следующие эксперименты.
При внутривенном введении кроликам клеток асцитной карциномы все животные погибали на 20-26-й день. При эндолимфатическом введении погибала в те же сроки лишь половина животных. У выживших животных злокачественные клетки фиксировались в лимфатических узлах. Если через 35 дней после эндолимфатического введения опухолевых клеток удалить регионарные (к месту введения) лимфатические узлы, примерно у трети животных отдалённые метастазы не обнаруживались.
Вопытах на собаках в периферический лимфатический сосуд вводили опухолевые клетки, меченные радиоактивной меткой. Когда их было немного, они практически все задерживались в лимфатических узлах. При увеличении количества вводимых клеток часть поступала с лимфой грудного протока в кровь.
Таким образом, способность лимфатических узлов задерживать опухолевые клетки зависит от количества наводняющих эти узлы злокачественных клеток. Между моментом проникновения опухоле-
237
