
Лекции / Kurs_lektsiy_po_patofiziologii_Ch_3_2018
.pdfдела ДЦ (расположенного в верхней трети моста АЦ) и апнейстического центра. Экспериментально апнейстическое дыхание можно вызвать путём перерезки мозгового ствола в средней трети (между пневмотаксическим и апнейстическим отделами ДЦ). Апнейстическое дыхание появляется при хронических анемиях, гипоксии и интоксикации ЦНС (например, при ботулизме, передозировке наркотиков, отравлении фосфорорганическими соединениями).
5.2. Нарушение эфферентных путей (VIII на рис. 19)
Нарушения эфферентных путей – прерывание путей, связывающих ДЦ с дыхательными мышцами, может приводить к грубым нарушениям деятельности дыхательных мышц (главным образом межрёберных и диафрагмы), сопровождающимся развитием альвеолярной гиповентиляции.
Известно, что повреждения шейного отдела спинного мозга, прерывающие связь ДЦ с мотонейронами межрёберных мышц, не вызывают значительных изменений характера дыхания. Если же прерываются проводящие пути, связывающие ДЦ с диафрагмальными мотонейронами, дыхание утрачивает автоматизм. Больной в таком случае дышит только произвольно: дыхание становится неравномерным, а при засыпании прекращается (так называемый синдром «проклятия Ундины»). Причинами развития этого синдрома могут быть сирингомиелия, рассеянный склероз, полиомиелит, травмы или нарушения кровообращения спинного мозга.
Миогенные расстройства дыхания (IХ на рис. 19)
Возникают не только при поражениях проводящих путей спинного мозга, мотонейронов и нервов, иннервирующих респираторные мышцы, но так же при расстройствах нервно-мышечной проводи-
мости. Типичный пример такой патологии – миастения, характеризующаяся стойким снижением лабильности нервно-мышечных синапсов. Развивающиеся при этом слабость и патологическая утомляемость респираторных мышц приводят к снижению газообменной функции внешнего дыхания и могут приобрести угрожающий для жизни характер. Альвеолярная гиповентиляция и даже прекращение дыхания из-за блокады нервно-мышечных синапсов развиваются как осложнения в период после оперативных вмешательств, проведённых с использованием миорелаксантов.
278
Альвеолярную гиповентиляцию миогенного происхождения можно обнаружить даже у практически здоровых людей с недостаточно развитой дыхательной мускулатурой в условиях выполнения ими значительной физической нагрузки. Утомление дыхательных мышц наступает при болезнях мышечной системы (например, при мышечной дистрофии Дюшенна).
Тяжёлая степень альвеолярной гиповентиляции может возникать при воспалительных процессах в дыхательных мышцах, сопровождающихся мышечной слабостью и миалгией. Самостоятельное значение в возникновении альвеолярной гиповентиляции иногда имеют врождённая или приобретённая атрофия, пороки развития, опухоли и кисты диафрагмальной мышцы.
Различные нарушения перечисленных выше нервных структур (афферентных, центральных, эфферентных) как самостоятельно, так и при разном их сочетании приводят к развитию в организме таких расстройств: 1) характера (частоты, глубины, ритмичности) дыхания; фаз дыхательного цикла; 2) просвета верхних или нижних дыхательных путей; 3) регуляторных рефлексов (Геринга-Брейера и др.); 4) защитных рефлексов (возникновения и длительности апноэ, препятствующего поступлению в лёгкие воздуха, содержащего раздражающие и повреждающие вещества); 5) оборонительных рефлексов (формирования кашля и чиханья); 6) обонятельных рефлексов (формирования принюхивания, активизирующего РФ и другие структуры ЦНС); 7) устной речи; 8) соответствия дыхания изменению поведенческой активности организма и др.
6. НАРУШЕНИЯ ПЕРФУЗИОННОЙ СПОСОБНОСТИ ЛЁГКИХ (ПАТОЛОГИЯ ЛЁГОЧНОГО КРОВОТОКА)
Движущая сила лёгочного кровотока (перфузии лёгких) – различие давления в правом желудочке и левом предсердии, а главный регулирующий механизм – лёгочное сосудистое сопротивление.
Патогенетическими факторами, изменяющими лёгочной кровоток являются: 1) объём циркулирующей крови; 2) работа правого желудочка; 3) кровенаполнение левого предсердия;4) лёгочное сосудистое сопротивление, регулируемое баро- и хеморецепторами; 5) внутриальвеолярное давление; 6) действие силы тяжести (силы земного притяжения).
279
Все названные факторы тесно взаимосвязаны. Серьёзные изменения любого из них могут стать основой возникновения патологии дыхания. Нарушения перфузии в лёгких возникают, главным образом, при нарушениях кровотока, осуществляемого через малый круг кровообращения (99-98 %), и частично (1-2 %) – через большой круг с участием бронхиальных сосудов.
Нарушения капиллярного кровотока в лёгких могут возникать как при гипертензии, так и при гипотензии в малом круге кровообращения.
6.1. Лёгочная гипертензия
Лёгочная гипертензия (АД более 20 / 8 мм рт.ст.) бывает прекапиллярной и посткапиллярной.
Прекапиллярная форма лёгочной гипертензии обусловлена как спазмом, так и эмболией ветвей лёгочной артерии.
Возможными причинами спазма артериол являются: 1) стресс,
эмоциональные нагрузки; 2) вдыханием холодного воздуха; 3) рефлекс фон Эйлера-Лильестранда (констрикторная реакция лёгочных сосудов, возникающая в ответ на снижение рО2 в альвеолярном воздухе); 4) гипоксия.
Возможными причинами эмболии ветвей лёгочной артерии счи-
таются: 1) тромбофлебит; 2) нарушения ритма сердца; 3) гиперкоагуляция крови; 4) полицитемия.
Лёгочная гипертензия усиливается при: 1) снижении температу-
ры воздуха; 2) активизации САС; 3) полицитемии; 4) повышении вязкости крови; 5) приступах кашля или хроническом кашле.
Посткапиллярная форма лёгочной гипертензии обусловлена снижением оттока крови по системе лёгочных вен. Характеризуется застойными явлениями в лёгких, возникающими и усиливающимися при сдавлении лёгочных вен опухолью, соединительнотканными рубцами, а также при различных заболеваниях, сопровождающихся левожелудочковой сердечной недостаточностью (митральном стенозе, гипертонической болезни, инфаркте миокарда, кардиосклерозе и др.).
Лёгочная гипотензия развивается при гиповолемии, вызванной кровопотерей, коллапсом, шоком, пороками сердца (со сбросом крови справа налево). Последнее, например, возникает при тетраде Фалло, когда значительная часть венозной малооксигенированной крови по-
280
ступает в артерии большого круга, минуя лёгочные сосуды, в том числе минуя обменные капилляры лёгких. Это приводит к развитию хронической гипоксии и вторичных расстройств дыхания.
В этих условиях, сопровождающихся шунтированием лёгочного кровотока, ингаляция кислорода не улучшает процесс оксигенации крови, гипоксемия сохраняется. Таким образом, эта функциональная проба – простой и надёжный диагностический тест выявления данного вида нарушения лёгочного кровотока.
7. НАРУШЕНИЕ ВЕНТИЛЯЦИОННО-ПЕРФУЗИОННОГО ОТНОШЕНИЯ
Внорме величина вентиляционно-перфузионного отношения (ВПО) равна 0,8-1,0.
У здоровых людей этот показатель отражает адекватность минутного объёма альвеолярной вентиляции (V) минутному объёму кровотока (Q) в лёгких, то есть V/Q = 0,8-1,0.
Вусловиях патологии лёгочная вентиляция может не соответствовать лёгочной гемодинамике, как на уровне целого лёгкого, так и на уровне долей, сегментов, долек или групп альвеол.
Это различие усиливается при изменении сил гравитации, анатомических и биохимических особенностей отдельных функциональных лёгочных единиц – ацинусов (одна единица, состоящая примерно из 100 альвеолярных ходов и 2 000 альвеол, включает объём лёгких, равный около 20 мкл), а также при изменении транспульмонального давления.
Вгиповентилируемых участках лёгких кровоток обычно уменьшается вследствие возникающей в них гипоксической и гиперкапнической вазоконстрикции. В участках со сниженным (по отношению к вентиляции) кровотоком гипокапническая бронхоконстрикция вызывает уменьшение вентиляции (рис. 21).
281
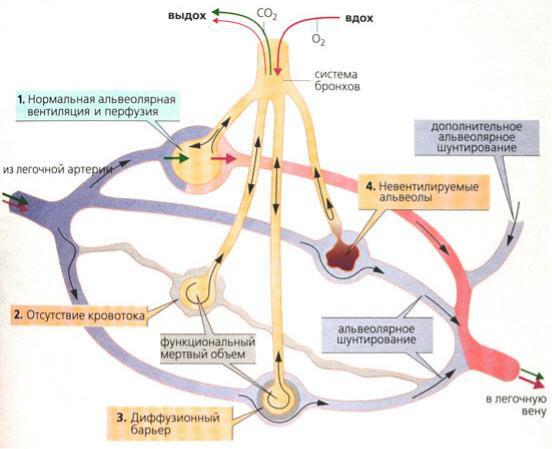
Рис. 21. Механизмы возникновения неравномерности вентиляции и перфузии лёгких
Уменьшение ВПО <0,8 обнаруживают при локальной альвеолярной гиповентиляции, вызванной такими причинами: 1) расстройства обструктивного типа (закупорка дыхательных путей); 2) нарушения эластичности лёгочной ткани; 3) деформация грудной клетки; 4) лё- гочно-плевральные сращения; 5) односторонний паралич диафрагмальной мышцы; 6) парадоксальное или маятникообразное дыхание и т.д.
Увеличение ВПО >1,0 отмечают при усиленном выведении из организма СО2, завершающемся развитием гипокапнии. Это происхо-
дит в таких ситуациях: 1) сужение, закупорка тромбами, эмболами, облитерация и/или спазм сосудов системы лёгочной артерии; 2) уменьшение кровотока через метаболические (обменные) капилляры; 3) увеличение кровотока через внутрилёгочные шунтовые (артерио- ло-венульные) сосуды.
Большое значение имеет гравитационная неравномерность вентиляции и перфузии на основаниях и верхушках лёгких: 1) вентиляция на основании незначительно выше, чем на верхушке; 2) кровоток на основании значительно превышает верхушечный; 3) V/Q на верхушке
282
значительно выше, чем на основании; 4) содержание О2 в альвеолах верхушки выше, чем на основании; 5) содержание СО2 в альвеолах основания выше, чем на верхушке.
L
P2
P1
S |
V |
Рис. 22. Механизмы диффузии газов через лёгочную мембра-
ну
283
8. НАРУШЕНИЯ ДИФФУЗИИ ГАЗОВ ЧЕРЕЗ АЛЬВЕОЛЯРНОКАПИЛЛЯРНЫЕ МЕМБРАНЫ
8.1. Введение
Наряду с механическими свойствами воздухоносных путей и лёгочной паренхимы, определяющими движение газа в альвеолы и обратно, решающий процесс для обеспечения тканевого метаболизма – газообмен через альвеолярно-капиллярную мембрану, т.е. диффузи-
онная способность лёгких (скорость, с которой газ проходит через эту мембрану).
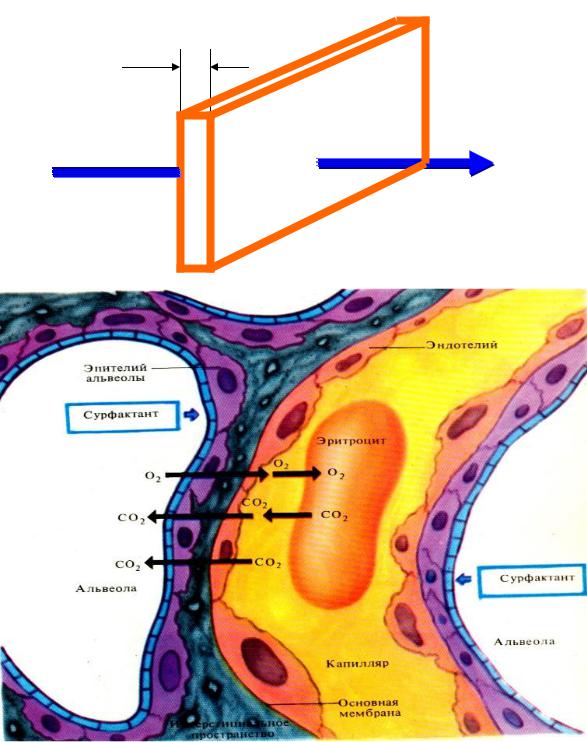
Движение газа через альвеолярно-капиллярную мембрану происходит путём диффузии (рис. 22).
Согласно закону Фика, объем диффузионного потока (V) прямо пропорционален разности парциальных давлений газа ( Р) по обе стороны альвеолокапиллярной мембраны, площади этой мембраны и обратно пропорционален толщине мембраны.
Таким образом, V = (ΔР × S × D) / L,
где D – константа диффузии, равная отношению растворимости газа к корню квадратному его молекулярной массы, V – диффузионный поток, Р – разность парциальных давлений по обе стороны мембраны (ΔР = Р1 – Р2), L – толщина мембраны, S – площадь мембраны.
Из уравнения Фика следует, что объем диффузии газа через аль- веолярно-капиллярную мембрану возрастает: 1) с увеличением площади поверхности мембраны (в норме диффузионная поверхность лёгких составляет 50-100 м2); 2) растворимости и градиента давления газа по обе стороны мембраны; 3) с уменьшением толщины мембраны и молекулярной массы газа.
8.2. Факторы, влияющие на диффузионную способность лёгких
Диффузионная способность лёгких возрастает при: 1) увеличе-
нии размеров тела (веса, роста, площади поверхности); 2) увеличении объёма лёгких; 3) физической нагрузки; 4) увеличении альвеолярного рСО2; 5) взрослении организма (до 20-летнего возраста); 6) положении тела лёжа на спине.
Диффузионная способность лёгких снижается при: 1) увеличе-
нии альвеолярного рО2; 2) увеличении возраста человека (после 20
284
лет); 3) увеличении толщины альвеолярно-капиллярной мембраны; 4) увеличении молекулярной массы газа; 5) хронических обструктивных заболеваниях лёгких (это снижение связано с уменьшением как площади поверхности альвеолярно-капиллярного контакта, так и объёма капиллярной крови); 6) рестриктивных заболеваниях лёгких, обусловленных интерстициальным отёком, фиброзом лёгких и деструкцией их капилляров и т.д.; 7) других заболеваниях лёгких, которые также приводят к увеличению диффузионного расстояния, к утрате капилляров и снижению объёма капиллярной крови, т.е. – к нарушению баланса между процессами альвеолярно-капиллярной диффузии и капиллярной перфузии.
9. ДЫХАТЕЛЬНАЯ НЕДОСТАТОЧНОСТЬ. ПОНЯТИЕ. КЛАССИФИКАЦИЯ. ХАРАКТЕРИСТИКА
Патологические изменения любого из функциональных компонентов дыхательной системы (паренхимы лёгких, грудной клетки с дыхательными мышцами, альвеолярно-капиллярной мембраны, лёгочного кровообращения, нервной или гуморальной регуляции дыхания) могут привести к развитию дыхательной недостаточности.
Дыхательная недостаточность (ДН) – такое состояние системы дыхания, при котором нарушен газовый гомеостаз или его поддержание обеспечено постоянным напряжением системы внешнего дыхания.
В зависимости от величины парциального давления газов в артериальной крови выделяют следующие виды ДН: 1) гипоксемическая, паренхиматозная, лёгочная, или ДН I типа (при которой РаО2 менее нижнего предела нормы – 55 мм рт.ст.); 2) гиперкапническая, вентиляционная, насосная, или ДН II типа (при которой РаСО2 превышает верхний предел нормы – 45 мм рт.ст).
Гипоксемическая ДН характеризуется выраженной артериальной гипоксемией, трудно корригируемой при помощи кислородотера-
пии. Обычно эта форма ДН, как следует из названия, возникает при тяжёлых паренхиматозных заболеваниях лёгких, таких как пневмония, ателектаз или отёк лёгких, а также некоторых заболеваниях нижних дыхательных путей (ХОБЛ, бронхиальная астма и др.).
Артериальная гипоксемия в основном развивается в результате нарушения регионарного вентиляционно-перфузионного соотношения в лёгких или усиления внутрилёгочного шунтирования крови.
285
Основные механизмы развития гипоксемии: 1) снижение парци-
ального давления кислорода во вдыхаемом воздухе; 2) общая гиповентиляция лёгких; 3) нарушения диффузии газов через альвеолярнокапиллярную мембрану; 4) регионарное нарушение вентиляционноперфузионных отношений; 5) шунт (прямой сброс венозной крови в артериальную систему кровообращения); 6) снижение парциального напряжения кислорода в смешанной венозной крови.
Гиперкапническая ДН обусловлена первичным уменьшением эффективной лёгочной вентиляции (альвеолярная гиповентиляция), что нарушает выведение СО2 и нередко приводит к серьёзным нарушениям кислотно-основного состояния. При этом степень гиперкапнии прямо пропорциональна степени уменьшения альвеолярной вентиляции.
Основные механизмы развития гиперкапнии: 1) повышение обра-
зования углекислоты; 2) снижение минутной вентиляции лёгких (гиповентиляция); 3) увеличение объёма физиологического мёртвого пространства.
Взависимости от механизмов, лежащих в основе развития ДН
выделяют следующие её виды:
Вентиляционная ДН (при нарушении процесса вентиляции в лёгких), имеет следующие варианты: 1) центрогенная (при заболеваниях ЦНС); 2) нейромышечная (при нейромышечной патологии); 3) «каркасная» (при болезнях грудной клетки и др.).
Диффузионная ДН (при нарушении процесса диффузии в лёгких) (рис. 10).
Перфузионная ДН (при нарушении процесса перфузии в лёгких). Смешанная ДН (при разных их сочетаниях).
Взависимости от состояния механизмов компенсации ДН подразделяют на компенсированную (если нормальный газовый со-
став вытекающей из лёгких крови обеспечен напряжением компенсаторных механизмов) и декомпенсированную (если из сосудов лёгких вытекает кровь, не соответствующая по составу артериальной).
По скорости развития ДН бывает острой (минуты, часы), подострой (сутки, недели), хронической (месяцы, годы).
При развитии острой дыхательной недостаточности (ОДН) показано проведение интенсивной терапии, так как ОДН может представлять непосредственную угрозу жизни больного. При быстром развитии ДН не успевают включиться компенсаторные механизмы со стороны других органов и систем организма (например, сердце, поч-
286
ки и др.). Наиболее характерный признак ОДН – нарушение кислот- но-основного состояния в сторону развития респираторного как алкалоза, так и ацидоза. При ДН I типа (вследствие избыточного выведения углекислоты) развивается респираторный алкалоз. При ДН II типа (в результате задержки выведения углекислоты) развивается респираторный ацидоз.
Кроме того, ОДН практически всегда сопровождается выраженными нарушениями функционирования сердечно-сосудистой систе-
мы. Не случайно острейшая форма ОДН носит название асфиксии
(от греч. аsрhyхiа – без пульса), при ее возникновении необходима экстренная квалифицированная медицинская помощь.
Лечение ОДН (независимо от её типа) направлено на: 1) ликви-
дацию основного заболевания, вызвавшего ДН, путём восстановления нарушенных процессов вентиляции, диффузии, перфузии, либо различного их сочетания; 2) устранение гипоксии (в целях повышения рО2) и/или ликвидация гиперкапнии (в целях снижения рСО2) в артериальной крови и тканях; 3) нормализацию рН в крови и тканях.
Для этого назначают кислородотерапию или механическую вентиляцию лёгких, а также средства, восстанавливающие рН внутренних сред организма.
Рекомендуют различные мероприятия, способы и средства, восстанавливающие функционирование не только дыхательной, но и других жизнеобеспечивающих как регуляторных (нервной, гуморальной, эндокринной, иммунной), так и исполнительных (кровообращения, выделения, детоксикации и др.) систем организма.
Хроническая дыхательная недостаточность (ХДН) развивается в течение нескольких месяцев или лет. Начало её может быть посте-
пенным, хотя она может развиться и при неполном восстановлении после ОДН. При ХДН происходит активация компенсаторных механизмов, направленных на улучшение доставки (транспорта) кислорода к тканям: углубление и/или учащение дыхания, нормализация КОС (главным образом за счёт почечных механизмов его регуляции), рост периферического кровотока (в результате тахикардии и повышения сердечного выброса), увеличение массы эритроцитов и гемоглобина крови (вследствие повышенного синтеза эритропоэтина, особенно почками), активизация диссоциации оксигемоглобина, замедление тканевого метаболизма и др.
287
