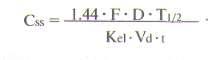- •Содержание
- •Глава 1
- •Номенклатура лекарственных средств
- •Классификация современных лекарственных средств
- •I. Средства, действующие преимущественно на центральную нервную систему
- •II. Средства, действующие преимущественно на периферические нейромедиаторные системы
- •III. Средства, действующие преимущественно в области чувствительных нервных окончаний
- •IV. Средства, действующие на сердечно-сосудистую систему
- •V. Средства, усиливающие выделительную функцию почек
- •VI. Желчегонные средства
- •VII. Средства, влияющие на мускулатуру матки
- •VIII. Средства, влияющие на процессы обмена веществ
- •IX. Препараты, модулирующие процессы иммунитета (иммуномодуляторы)
- •X. Препараты различных фармакологических групп
- •XI. Противомикробные, противопаразитарные и противовирусные средства
- •XII. Препараты, применяемые для лечения злокачественных новообразований
- •XIII. Диагностические средства
- •Виды фармакотерапии
- •Глава 2 вопросы деонтологии
- •Глава 3
- •Глава 4 разработка, испытания и регистрация новых лекарственных средств
- •Доклинические исследования
- •Плацебо в клинической практике и при испытаниях новых лекарств
- •Глава 5 основные вопросы фармакодинамики определние фармодинамики
- •Избирательность действия лекарственных средств
- •Дозировка лекарственных средств
- •Клиническая оценка действия лекарственных средств
- •Лекарства и качество жизни
- •Глава 6 основные вопросы фармакокинетики
- •Всасывание лекарственных средств
- •Основные пути введения лекарственных средств
- •Энтеральный путь
- •Парентеральный путь
- •Распределение лекарственных веществ в организме
- •Связывание лекарственных веществ с белками крови и тканей
- •Биотрансформация лекарственных средств Понятие и механизмы биотрансформации
- •Микросомальная биотрансформация
- •Немикросомальная биотрансформация
- •Выведение лекарственных веществ из организма Основные пути выведения лекарств из организма
- •Выведение с мочой
- •Выведение с желчью
- •Выведение с молоком
- •Моделирование фармакокинетических процессов
- •Биодоступность лекарственных средств
- •Сердечные гликозиды
- •Анальгезирующие и противовоспалительные средства
- •Теофиллин
- •Противосудорожные препараты
- •Антибиотики
- •Цитостатики
- •Антиаритмические средства
- •Психотропные средства
- •Фармакокинетические процессы и клинико-фармакологический эффект
- •Глава 7 фармакогенетика предмет и задачи фармакогенетики
- •Наследственные дефекты ферментных систем
- •Атипичная псевдохолинэстераза
- •Недостаточность глюкозо-6-фосфатдегидрогеназы
- •Недостаточность ацетилтрансферазы
- •Недостаточность каталазы
- •Атипичные реакции на лекарственные средства при наследственных нарушениях обмена веществ
- •Врожденная метгемоглобинемия
- •Порфирии
- •Наследственные негемолитические желтухи
- •Глава 8 влияние различных факторов на действие лекарственных средств беременность и кормление
- •Возраст плода и токсическое действие лекарственных средств
- •Фармакокинетика лекарственных препаратов в системе мать — плацента — плод
- •Влияние на плод и новорожденного препаратов, применяемых во время родов
- •Разделение лекарств по степени тератогенности (сша)
- •Выведение лекарственных веществ с грудным молоком
- •Детский возраст
- •Всасывание лекарственных веществ
- •Всасывание в желудочно-кишечном тракте
- •Чрескожное всасывание
- •Ректальное всасывание
- •Связывание с белками и распределение лекарственных веществ
- •Биотрансформация лекарственных веществ
- •Выведение лекарственных средств
- •Сердечные гликозиды
- •Метилксантины
- •Индометацин
- •Фенитоин
- •Фенобарбитал
- •Аминогликозиды
- •Фуросемид
- •Фармакодинамика лекарственных средств
- •Пожилой возраст
- •Алкоголь и курение
- •Глава 9 взаимодействие лекарственных средств фармакокинетическое взаимодействие
- •Всасывание
- •Распределение
- •Связывание с белками плазмы крови и тканями
- •Биотрансформация
- •Выведение с мочой и желчью
- •Фармакодинамическое взаимодействие Определение фармакодинамики
- •Конкуренция за рецепторы
- •Изменение кинетики препарата в месте действия
- •Влияние на медиаторы
- •Изменение чувствительности рецепторов
- •Физиологическое взаимодействие
- •Глава 10 побочное действие лекарственных средств типы побочных реакций и осложнений лекарственной терапии
- •Побочные реакции, связанные с фармакологической активностью
- •Токсические осложнения
- •Нарушение иммунобиологических свойств организма
- •Аллергические реакции
- •Идиосинкразия
- •Клинические проявления побочного действия лекарственных средств
- •Поражение кожи и ее придатков
- •Гематологические нарушения
- •Желудочно-кишечные расстройства
- •Поражение почек
- •Поражение легких
- •Поражение сердечно-сосудистой системы
- •Поражение глаз
- •Часть II
- •Глава 11 лекарственные средства, применяемые при сердечно-сосудистных заболеваниях стенокардия
- •Нитросодержащие препараты
- •Побочное действие нитратов
- •Противопоказания
- •Контроль за лечением нитратами
Выведение с желчью
Из печени лекарственные вещества в виде метаболитов или в неизмененном виде пассивно или с помощью активных транспортных систем поступают в желчь. В дальнейшем лекарственные препараты или их метаболиты выводятся из организма с калом. Под влиянием ферментов желудочно-кишечного тракта или бактериальной микрофлоры они могут превращаться в другие соединения, которые реабсорбируются и вновь доставляются в печень, где претерпевают новый цикл метаболических превращений. Подобный цикл носит название энтерогепатической циркуляции. На выведение лекарственных средств с желчью влияют молекулярная масса соединений, их химическая природа, состояние гепатоцитов и желчевыводящих путей, интенсивность связывания препаратов с клетками печени.
Печеночный клиренс препаратов можно определить при исследовании дуоденального содержимого, полученного с помощью зонда. Степень выведения лекарственных веществ с желчью особенно важно учитывать при лечении больных с печеночной недостаточностью, а также воспалительными заболеваниями желчных путей.
Выведение с молоком
Многие лекарственные вещества могут выводиться с грудным молоком. Как правило, концентрация лекарственных средств в молоке матери слишком мала для того, чтобы оказать действие на новорожденного. Однако в некоторых случаях количество поглощаемого с молоком лекарственного средства может представлять опасность для ребенка.
Реакция грудного молока несколько более кислая (рН7), чем плазмы крови, поэтому вещества со свойствами слабых оснований, которые становятся более ионизированными при уменьшении рН, могут быть обнаружены в молоке в концентрациях, равных или более высоких, чем в плазме крови. Препараты, не являющиеся электролитами, легко проникают в молоко независимо от рН среды.
Сведений о безопасности для новорожденных многих лекарственных средств не имеется, поэтому фармакотерапию у кормящих женщин следует проводить крайне осторожно.

Моделирование фармакокинетических процессов
При фармакокинетическом изучении лекарственного средства измеряют его концентрацию в биологических средах (кровь, моча, слизь и т.д.) в определенные моменты времени. Частота и продолжительность забора биологических проб зависит от продолжительности пребывания лекарственного вещества или его метаболитов в организме. Концентрацию препаратов определяют с помощью жидкостной или газожидкостной хроматографии, радиоиммунного или ферментно-химического анализа, полярографии, спектрофотометрии и т.д. На основании полученных данных строится график, по оси абсцисс которого откладывают время, а по оси ординат — концентрацию лекарственного вещества в биологической пробе (наиболее часто в плазме крови) в соответствующих единицах. Кривая “концентрация — время” характеризует фармакокинетические процессы, происходящие с исследуемым препаратом
Для математического моделирования фармакокинетических процессов организм представляют в виде одной или нескольких частей (камер), ограниченных проницаемой мембраной, в которых равномерно распределяется лекарственное средство. Понятие “камера” условно, так как за ним не стоит какое-либо анатомически ограниченное пространство; это только единица формализованной фармакокинетической системы.
Наиболее простой фармакокинетической моделью является однокамерная модель, при которой организм представляется в виде единой гомогенной камеры. Эта модель пригодна для анализа концентрации препарата в крови, плазме и сыворотке, а также для анализа концентрации в моче лекарственных средств, которые быстро распределяются между плазмой крови и другими жидкостями и тканями организма. Динамика концентрации лекарственного вещества в крови при использовании однокамерной модели представлена.- Данная модель предполагает, что любые изменения концентрации лекарственного средства в плазме отражают изменения его содержания в тканях. Распределение препаратов в однокамерной модели происходит быстро, вследствие чего вскоре устанавливается стационарное состояние, т.е. устойчивое динамическое равновесие между поступлением препарата в кровь и выходом из нее. Однако многие лекарственные вещества поступают в ткани и выходят из них очень медленно. Кроме того, согласно однокамерной модели скорость выведения препарата из организма постоянна и характеризуется константой выведения, или элиминации (Кel). Эта константа служит для количественной оценки скорости выведения препарата из организма и численно равна тангенсу угла наклона полулогарифмической кривой к оси абсцисс. Скорость снижения концентрации большинства лекарственных средств пропорциональна их концентрации. Поэтому кинетические данные, полученные при математических расчетах однокамерной модели, для многих лекарственных веществ не соответствуют истине.
Более приемлемы двух- и трехкамерные модели. За центральную (обычно меньшую) камеру
 принимают
плазму крови, составляющие ее элементы
и хорошо перфузируемые органы (сердце,
легкие, печень, почки, эндокринные
железы); за периферическую —плохо
перфузируемые органы (мышцы, кожа, жир).
В этих камерах лекарственное средство
распределяется с разной скоростью:
быстро — в центральной и медленно — в
периферической, после чего частично
выводится. Например, после внутривенного
введения лекарственное вещество сначала
быстро распределяется в центральной
камере, в меньшей степени — в периферической
камере и частично начинает выводиться
из организма. В результате концентрация
его быстро падает. Эту фазу принято
называть альфа-фазой, или фазой
распределения. Затем происходит
интенсивное выведение лекарственного
средства и его переход из периферической
камеры в центральную. Это так называемая
бета-фаза, или фаза выведения. В
определенный промежуток времени между
этими фазами создается равновесие.
Кинетика распределения вещества в такой
модели характеризуется тремя константами:
константой скорости выведения (Кel),
константой элиминации из центральной
в периферическую камеру (К1-2), константой
перехода из периферической камеры в
центральную (К2-1). Выводится из организма
лекарственное вещество только через
центральную камеру, периферическая
служит дополнительным резервуаром.
принимают
плазму крови, составляющие ее элементы
и хорошо перфузируемые органы (сердце,
легкие, печень, почки, эндокринные
железы); за периферическую —плохо
перфузируемые органы (мышцы, кожа, жир).
В этих камерах лекарственное средство
распределяется с разной скоростью:
быстро — в центральной и медленно — в
периферической, после чего частично
выводится. Например, после внутривенного
введения лекарственное вещество сначала
быстро распределяется в центральной
камере, в меньшей степени — в периферической
камере и частично начинает выводиться
из организма. В результате концентрация
его быстро падает. Эту фазу принято
называть альфа-фазой, или фазой
распределения. Затем происходит
интенсивное выведение лекарственного
средства и его переход из периферической
камеры в центральную. Это так называемая
бета-фаза, или фаза выведения. В
определенный промежуток времени между
этими фазами создается равновесие.
Кинетика распределения вещества в такой
модели характеризуется тремя константами:
константой скорости выведения (Кel),
константой элиминации из центральной
в периферическую камеру (К1-2), константой
перехода из периферической камеры в
центральную (К2-1). Выводится из организма
лекарственное вещество только через
центральную камеру, периферическая
служит дополнительным резервуаром.
В фармакокинетических исследованиях указанные модели используются для оценки изменений концентрации лекарственного средства во времени в специфической камере, где проявляется желаемое терапевтическое действие препарата.
Важным фактором, влияющим на концентрацию лекарственных веществ, является их выведение из организма, или элиминация. Показателем элиминации является клиренс (мл/мин). Общий клиренс — объем плазмы крови, который очищается от препарата за единицу времени за счет выведения почками, печенью и др. Общий клиренс представляет собой сумму почечного и печеночного клиренса. Под печеночным клиренсом подразумевается метаболический клиренс в печени и выведение препарата с желчью. Например, почечный клиренс циметидина составляет около 600 мл/мин, метаболический в печени — 200 мл/мин и желчный — 10 мл/мин, следовательно, общий клиренс равен 810 мл/мин. Другие пути выведения, или внепочечный метаболизм, не имеют существенного значения и при расчете общего клиренса во внимание обычно не принимаются.
Основными физиологическими факторами, определяющими клиренс, являются функциональное состояние печени, объем притока крови, скорость печеночного кровотока и функциональная способность соответствующих ферментов. Например, клиренс лидокаина, который интенсивно метаболизируется ферментами печени, зависит прежде всего от скорости его доставки к печени, т.е. от объема притекающей крови, скорости кровотока. Поэтому при снижении печеночного кровотока в результате застойной сердечной недостаточности клиренс лидокаина снижается.
В то же время клиренс фенотиазинов зависит в основном от функционального состояния ферментов. Поэтому при поражении гепатоцитов клиренс фенотиазинов резко снижается; естественно, их концентрация в крови при этом значительно возрастает.
Для определения клиренса используют формулу:
![]() где
Vd — объем распределения, D — доза
лекарственного вещества, AUC — площадь
под кривой “концентрация — время”,
Т1/2 — период полувыведения лекарственного
средства.
где
Vd — объем распределения, D — доза
лекарственного вещества, AUC — площадь
под кривой “концентрация — время”,
Т1/2 — период полувыведения лекарственного
средства.
В клинических условиях клиренс служит для расчета дозы, необходимой для поддержания равновесной концентрации препарата в крови, т.е. поддерживающей дозы: Cl•Css, где Css — равновесная концентрация.
Объем распределения лекарственного вещества (Vd) — гипотетический объем жидкостей организма, необходимый для равномерного распределения всего количества данного вещества в концентрации, равной его концентрации в плазме крови. Объем распределения зависит от физико-химических свойств препарата (молекулярная масса, уровень ионизации и полярности, растворимость в воде и жирах), которые влияют на его прохождение через мембраны, возраста, пола больного, общего количества жиров в организме. Например, у пожилых людей и новорожденных объем распределения снижен. Кроме того, объем распределения изменяется при некоторых патологических состояниях, особенно при заболеваниях печени, почек, сердечно-сосудистой системы и т.д.
В клинической практике объем распределения служит для расчета нагрузочной дозы препарата, требуемой для достижения его необходимой концентрации в крови: D=Vd•C, где D — доза, Vd — объем распределения и С — необходимая концентрация. Определяется объем распределения по формуле:
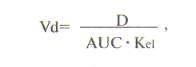 где
D — вводимая доза, AUC — площадь под кривой
“концентрация — время”.
где
D — вводимая доза, AUC — площадь под кривой
“концентрация — время”.
О выведении лекарственных средств из организма судят по периоду полувыведения (Т1/2). За один период из организма выводится 50% лекарственного средства, за два — 75%, за три — 90%. Период полувыведения препарата зависит от объема распределения и клиренса:
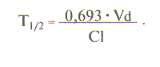
Т1/2 не является точным показателем, характеризующим выведение лекарственного средства. Например, при сердечной недостаточности объем распределения лидокаина снижается в результате его плохого проникновения в ткани. Клиренс лидокаина также уменьшается за счет снижения почечного кровотока. В результате Т1/2 изменяется незначительно. Если ориентироваться при дозировании лидокаина на полученное значение, то концентрация препарата в крови окажется токсической. В связи с этим оптимальным показателем выведения лекарственного средства остается клиренс, а Т1/2 служит главным образом для определения промежутка времени, необходимого для достижения равновесной концентрации лекарственного средства в крови (это обычно 3-5 периодов полувыведения препарата).
На практике при расчете интервала времени до создания равновесной концентрации лекарственного вещества в крови следует ориентироваться на Т1/2 этого препарата у данного больного, а не на среднее значение Т1/2. Это связано с тем, что Т1/2 варьирует в широких пределах при различных заболеваниях, а также зависит от возраста. У детей Т1/2 препаратов, как правило, увеличен по сравнению с таковыми у взрослых, поэтому следует увеличить интервал между приемом препарата или уменьшить его дозу.
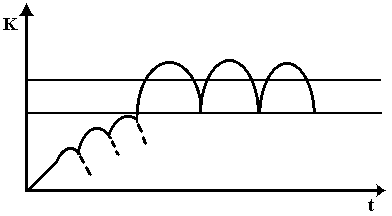
Равновесная концентрация устанавливается,
когда количество абсорбирующегося и
количество вводимого препарата равны.
В результате концентрация лекарственного
средства колеблется в определенных
пределах между максимальными и
минимальными значениями концентрации
препарата
 .
При установлении равновесной концентрации
проявляется в полном объеме клинический
эффект препарата. Для достижения
равновесной концентрации требуется,
как указывалось выше, 3-5 периодов
полувыведения. Чем короче период
полувыведения препарата, тем скорее
достигается его равновесная концентрация
и тем выраженнее будут ее колебания.
Например, новокаинамид имеет период
полувыведения около 2-3 ч, а его равновесная
концентрация характеризуется большим
разбросом значений при назначении
препарата через каждые 6 ч. Поэтому для
предупреждения и уменьшения указанных
колебаний равновесной концентрации в
крови в последнее время все шире
используются препараты в такой
лекарственной форме, которая обеспечивает
замедленное высвобождение препарата.
.
При установлении равновесной концентрации
проявляется в полном объеме клинический
эффект препарата. Для достижения
равновесной концентрации требуется,
как указывалось выше, 3-5 периодов
полувыведения. Чем короче период
полувыведения препарата, тем скорее
достигается его равновесная концентрация
и тем выраженнее будут ее колебания.
Например, новокаинамид имеет период
полувыведения около 2-3 ч, а его равновесная
концентрация характеризуется большим
разбросом значений при назначении
препарата через каждые 6 ч. Поэтому для
предупреждения и уменьшения указанных
колебаний равновесной концентрации в
крови в последнее время все шире
используются препараты в такой
лекарственной форме, которая обеспечивает
замедленное высвобождение препарата.
На практике равновесную концентрацию лекарственного средства можно вычислить по концентрации данного препарата после однократного введения:

где t — интервал времени от момента введения препарата до взятия пробы, F — биодоступность препарата. Другие обозначения см. выше.
Если вместо константы элиминации использовать период полувыведения, то уравнение приобретает следующий вид: