- •Частина і. Теоретичні основи хімічної технології
- •1.1. Предмет і завдання хімічної технології
- •1.2. Класифікація хімічних виробництв
- •7. Промисловість реактивів і особливо чистих речовин.
- •1.3. Хімічна технологія як наука
- •1.4. Значення хімічної технології, її міжгалузевий характер
- •1.5. Етапи розвитку хімічних виробництв і хімічної технології
- •1.6. Основні напрямки і перспективи розвитку хімічної технології і техніки
- •2.1. Класифікація технологічних процесів
- •2.2. Схеми руху матеріальних та енергетичних потоків
- •2.3. Хіміко-технологічні розрахунки. Матеріальні та енергетичні баланси
- •2.4. Інтенсивність та швидкість процесів
- •2.5. Продуктивність праці
- •2.6. Роль фізико-хімічних закономірностей у хімічній технології
- •2.7. Економічні вимоги, що ставляться до раціонального виробництва
- •2.8. Науково-дослідна, експериментальна і проектна робота в хімічній промисловості
- •3.1. Система процесів у хімічному реакторі
- •3.2. Класифікація хтп
- •3.3. Основні показники ефективності хтп
- •3.4. Термодинамічні основи хтп
- •4.1. Класифікація хімічних реакторів
- •4.2. Режим руху і перемішування реагентів
- •5.1. Гомогенні процеси у газовій фазі
- •5.2. Гомогенні процеси у рідкій фазі
- •5.3. Вплив концентрації реагуючих речовин, тиску, температури, переміщування на швидкість гомогенних реакцій
- •5.4. Реактори для гомогенних процесів
- •6.1. Рівновага і швидкість гетерогенних процесів
- •6.2. Процеси і реактори у системі газ-рідина (г–р)
- •6.3. Процеси і реактори у системі газ-тверде тіло (г–т)
- •7.1. Суть і види каталізу
- •7.2. Гомогенний каталіз
- •7.3. Гетерогенний каталіз
- •7.4. Властивості твердих каталізаторів і їх приготування
- •7.5. Каталітичні реактори
- •8.1. Мінеральна сировина
- •8.2. Добування і підготовка сировини до переробки
- •8.3. Сировина рослинного і тваринного походження
- •8.4. Енергія у хімічному виробництві
- •Частина II. Промислові хімічні виробництва
- •9.1. Зв'язаний азот та його значення
- •9.2. Методи зв'язування атмосферного азоту
- •9.3. Отримання та очищення азотоводневої суміші
- •9.4. Фізико-хімічні основи процесу синтезу амоніаку
- •9.5. Промислові способи виробництва синтетичного амоніаку
- •10.1. Загальна характеристика нітратної кислоти
- •10.2. Фізико-хімічні основи виробництва нітратної кислоти
- •10.3. Оптимальні умови процесу окиснення амоніаку
- •10.4. Переробка нітрозних газів на розбавлену нітратну кислоту
- •10.5. Виробництво розбавленої нітратної кислоти
- •11.1. Основні властивості та застосування сульфатної кислоти
- •11.2. Сировинна база сульфатно-кислотного виробництва
- •11.3. Виробництво сульфітного газу
- •11.4. Контактний спосіб виробництва сульфатної кислоти з колчедану
- •11.5. Виробництво сульфатної кислоти з сірки та сірководню
- •12.1. Загальна характеристика содових продуктів
- •12.2. Фізико-хімічні основи виробництва кальцинованої соди
- •12.3. Принципова схема виробництва кальцинованої соди
- •12.4. Виробництво каустичної соди
- •13.1. Основні закони електрохімії
- •13.2. Електроліз водних розчинів. Виробництво їдкого натру і хлору
- •13.3. Переробка електролітичного хлору. Виробництво хлоридної кислоти
- •14.1. Основні електротермічні закони
- •14.2. Виробництво кальцію карбіду
- •14.3. Виробництво кальцію ціанаміду
- •14.4. Виробництво фосфору і фосфатної кислоти
- •15.1. Піроліз деревини
- •15.2. Виробництво целюлози
- •15.3. Гідроліз деревини
- •15.4. Виробництво каніфолі і терпентину
- •Тушницький Орест Петрович загальна хімічна технологія
- •79000, М. Львів, вул. М. Коперника, 18
- •79057, М. Львів, вул. Генерала Чупринки, 103
2.2. Схеми руху матеріальних та енергетичних потоків
За кратністю обробки сировини процеси можна поділити на процеси з відкритим ланцюгом і циркуляційні (циклічні), в яких сировина, що не прореагувала за один цикл, разом з новою порцією сировини повертається у голову процесу.
Процес одноразової обробки сировини називають процесом з відкритим ланцюгом, або розімкненим. Прикладом одноразової обробки сировини можна назвати окиснення SO2 в SO3 на поверхні твердого каталізатора під час проходження газової суміші через контактний апарат.
У круговому (циклічному) процесі частина сировини циркулює у замкненому циклі. Прикладом циклічного процесу може бути синтез NH3 з H2 і N2, коли азотоводнева суміш, що не прореагувала при проходженні через контактний апарат, відокремлюється від NH3 і знову спрямовується у контактний апарат для подальшого контактування.
Як розімкнені, так і циркуляційні процеси можуть відбуватися при різних матеріальних і теплових напрямах потоків.
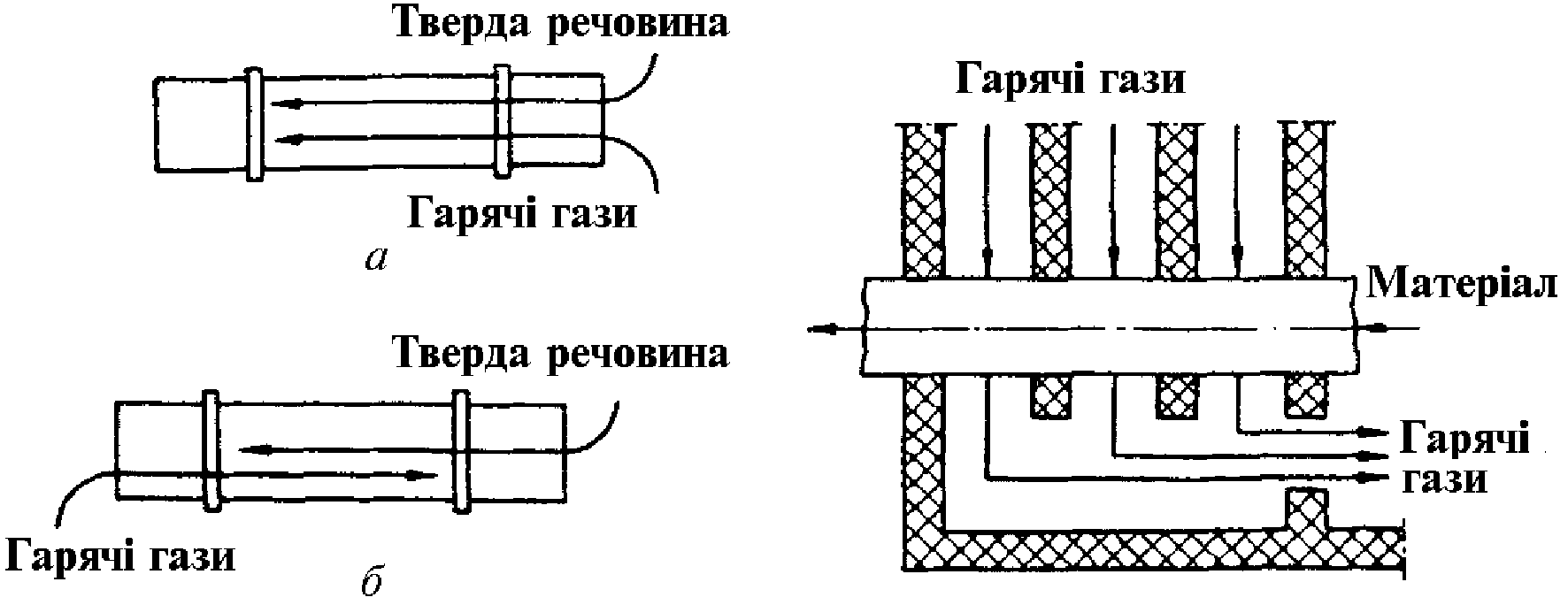
Прямоточні, або паралельно-точні, процеси характеризуються рухом матеріалів і теплових потоків в одному напрямі (рис. 2.1, а).
|
|
Рис. 2.1. Напрям потоків: а – прямотечія; б – протитечія |
Рис. 2.2. Схема перехресного потоку |
Протитечійні процеси, навпаки, відбуваються при протилежному русі реагентів або матеріалів і теплових потоків (рис. 2.1, б). Якщо потоки реагентів або матеріалів і теплові потоки рухаються під кутом один до одного, то схему процесу називають перехресною (рис. 2.2).
Прямоточний рух матеріалів і теплових газів створює велику різницю температур і концентрацій на вході в апарат і м'які умови на виході при закінченні процесу. Це дуже важливо, коли готова продукція не витримує високих температур.
Протитечійні схеми процесів у багатьох випадках мають значні переваги перед прямоточними. Протитечійний напрям забезпечує більш повний перебіг процесу, наприклад при розчиненні, вилуговуванні або промиванні твердої речовини, при абсорбції газів рідиною і т. ін.
2.3. Хіміко-технологічні розрахунки. Матеріальні та енергетичні баланси
Початок будь-якого нового виробництва пов'язаний з проектуванням як будівельної частини, так і технологічної схеми виробництва, з визначенням технологічного режиму кожної стадії виробництва. Для цього вибирають типи основної апаратури і конструкційні матеріали, проводять матеріальний розрахунок, обчислюють матеріальний і енергетичний баланси, на основі розрахунків визначають розміри і кількість апаратів кожного типу.
Першою основною і обов'язковою частиною кожного технологічного проекту є матеріальний розрахунок кількісних співвідношень реагуючих мас, тобто визначення норм витрати сировини, виходу продукції, напівпродуктів та відходів виробництва. Із загального курсу хімії відомо, що такі розрахунки проводять за стехіометричними рівняннями хімічних реакцій. Але при проектуванні виробничої технологічної схеми виникає багато ускладнень, яких не буває під час лабораторних досліджень, а тим більше при теоретичних розрахунках. Стехіометричні розрахунки ускладнюються насамперед тому, що треба враховувати склад природної сировини, яка, на відміну від хімічно чистої речовини, має велику кількість домішок. Треба враховувати всі чинники, що впливають на швидкість процесу, ступінь використання робочого часу, змінність роботи, кількість робочих днів протягом року, продуктивність апаратури і її вузькі місця, які не дають можливості максимально використовувати цю апаратуру.
До найважливіших хіміко-технологічних розрахунків належать розрахунки технологічних балансів, що відображують кількість введених і отриманих у виробничому процесі матеріалів і енергії. Основними технологічними балансами є матеріальні, енергетичні та економічні баланси.
Матеріальний баланс складають на основі матеріального розрахунку як при проектуванні, так і при аналізі роботи підприємства або якоїсь його частини. Складають матеріальний баланс за рівнянням основної сумарної реакції з урахуванням побічних процесів на підставі закону збереження маси речовини. За цим законом маса речовини, що надходить у вигляді самої сировини або сировини з різними добавками, повинна завжди дорівнювати масі речовин, отриманих у вигляді продуктів, напівпродуктів і відходів виробництва.
У загальному вигляді матеріальний баланс можна виразити рівнянням:
Ма + М6 + Мв +... = Мк + Мл + Мма + Ммб + Ммв + Мпб + Мвт,
де: Ма, М6, Мв – маси речовин, введених у виробничий процес (або в одну з його стадій) чи в апарат; Мк, Мл – маси речовин, добутих внаслідок виробничих процесів; Мма, Мм6, Ммв – маси вихідних речовин, що не прореагували; Mпб – маси побічних продуктів; Мвт – втрати.
Для складання матеріального балансу треба знати хімічний склад і деякі фізичні та фізико-хімічні властивості вихідної сировини, напівпродуктів і кінцевих продуктів виробництва.
Після проведення стехіометричних розрахунків складають таблиці матеріальних балансів. Найчастіше розрахунки роблять за відношенням до 1000 або 100 кг продукції чи сировини.
Матеріальний баланс складають у вигляді рівнянь, таблиць або діаграм. Як приклад можна розглянути спрощений матеріальний баланс виробництва 1000 кг фосфору при електротермічному процесі:
2Са3(РО4)2 + 6SiO2+ 10С = Р4 + 6CaSiO3 + 10СО + Q
У табл. 2.1 наведений спрощений матеріальний баланс.
Табл. 2.1. Матеріальний баланс виробництва фосфору (на 1000 кг Р)
Прихід |
кг |
% |
Витрата |
кг |
% |
Фосфоритна руда (28 % Р2О5) Кокс (80 % С) Пісок (95 % SiO2) |
10250 1330 2370 |
73,5 9,5 17,0 |
Фосфор Ферофосфор Оксид вуглецю та інші гази Шлак |
1000 282 3668 9000 |
7,2 2,0 26,3 64,5 |
Всього |
13950 |
100 |
Всього |
13950 |
100 |
На рис. 2.3 для прикладу показано матеріальний баланс у вигляді діаграми.
Матеріальний баланс є основою контролю виробництва. Різниця (сальдо) між кількостями взятих і добутих речовин свідчить про неправильне ведення контролю або невраховані витрати, чи навіть зловживання.
На підприємствах баланси складають за даними технічної, аналітичної та матеріальної звітності.
Енергетичний (тепловий) баланс складають майже так, як матеріальний баланс, на основі закону збереження енергії. У загальному вигляді його можна виразити таким рівнянням:
Qф + Qр + Qф.п. + Qв = Q'ф + Q'р + Q'ф.п. + Qвm
де: Qф – фізична теплота, введена у процес з вихідними речовинами; Qp – теплота екзотермічних реакцій; Qф.п. – теплота фізичних перетворень, що виділяється під час фізичних процесів (конденсації, кристалізації тощо); Qв – теплота, введена у процес ззовні з горючими газами, паливом, водою та ін.; Q'ф – фізична теплота, виведена з продуктами процесу; Q'p – теплота ендотермічних реакцій; Q'ф.п. – теплота фізичних перетворень, що поглинається під час фізичних процесів (випаровування, топлення тощо); Qвm – втрати теплоти у навколишнє середовище.
Для складання енергетичного балансу треба мати дані про всі хімічні і фізичні процеси, які відбуваються у даному виробництві, а також дані про всі матеріальні показники процесу, що входять до матеріального балансу. Ту складову частину балансу, яку не можна або важко розрахувати, визначають як невідому величину з рівняння енергетичного балансу.
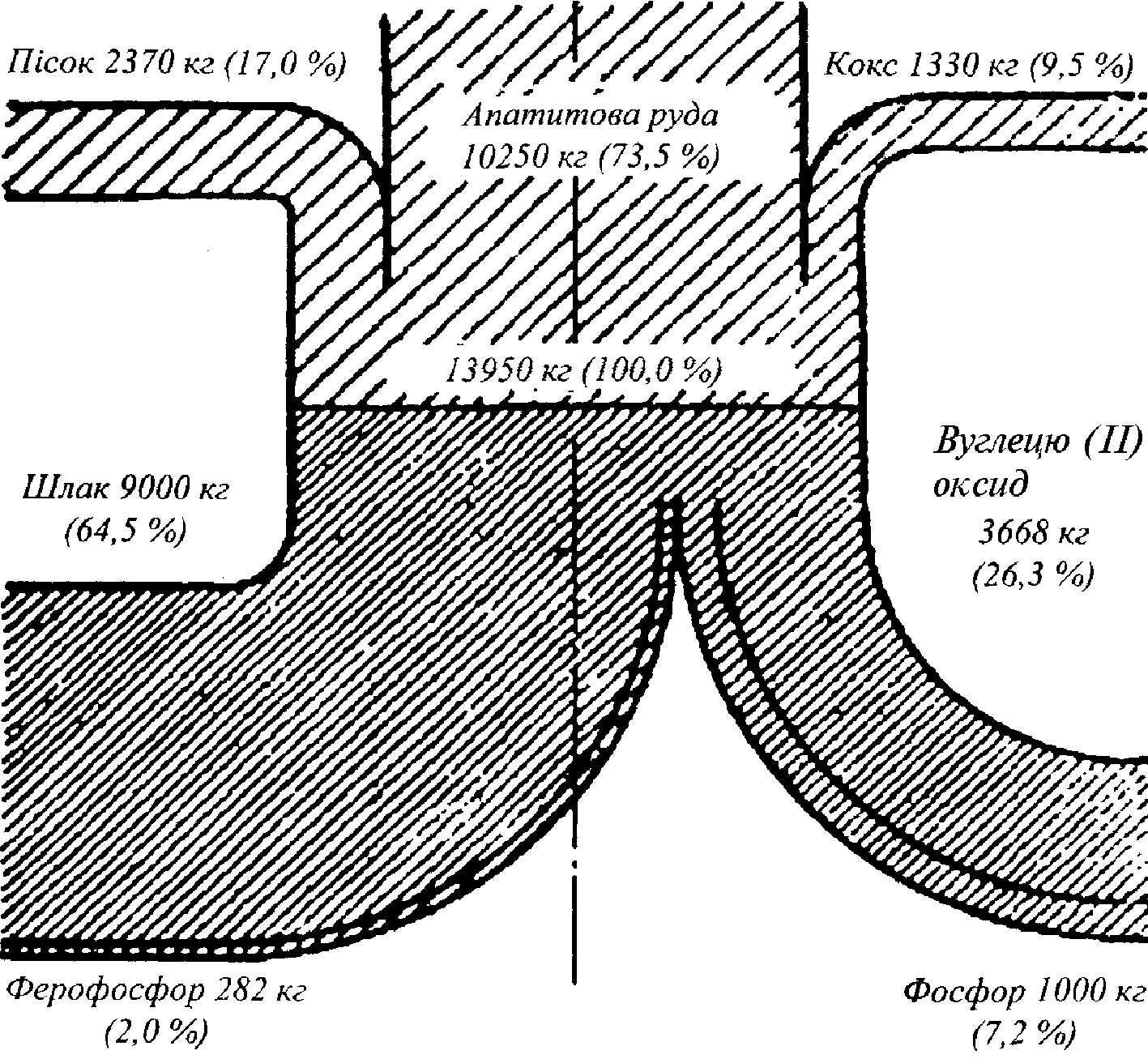
Рис. 2.3. Діаграма матеріального балансу виробництва фосфору
Аналітичні дані сировини, готової продукції, напівпродуктів та інших матеріалів виробництва використовують для стехіометричних розрахунків, які кладуть в основу матеріальних балансів, а термохімічні і теплофізичні константи (теплоти утворення і розкладання, теплоти плавлення, розчинення, сублімації та інших процесів, теплоємності, енергетичні параметри тощо) використовують для складання енергетичних балансів.
Тепловий баланс (табл. 2.2), як і матеріальний, можна виразити графічно.
Табл. 2.2. Тепловий баланс виробництва фосфору (на 1000 кг Р)
Прихід теплоти |
Тис. кДж |
% |
Витрата теплоти |
Тис. кДж |
% |
Вводиться ззовні |
65527,8 |
99,7 |
На відновлення |
|
|
Вноситься реагуючими |
|
|
фосфору |
|
|
речовинами |
205,1 |
0,3 |
(ендотермічна реакція) |
26586,4 |
40,4 |
|
|
|
На інші ендотермічні |
|
|
|
|
|
реакції |
3943,9 |
6 |
|
|
|
Виноситься шлаком і |
|
|
|
|
|
ферофосфором |
21047 |
32 |
|
|
|
Виноситься з газами |
1955,2 |
3 |
|
|
|
в атмосферу |
12200,3 |
18,6 |
Всього |
65 732,9 |
100 |
Всього |
65 732,9 |
100 |
Матеріальні і енергетичні баланси використовуються для аналізу і оцінки раціональності та доцільності здійснення того чи іншого виробничого процесу в умовах промисловості. За їх допомогою встановлюють питому масу виходів продукції, витрату і втрату сировини, палива, коефіцієнти використання енергії та ін. Баланси використовують для визначення розмірів апаратури, її потужності і продуктивності, інтенсивності процесів та ряду інших технічних і економічних показників виробництва.
Показники матеріального і енергетичного балансів у багатьох випадках виражають у грошових еквівалентах, на основі яких складають економічні баланси.
За даними матеріального балансу і матеріального розрахунку визначають вихід готової продукції, або коефіцієнт використання сировини, під яким розуміють виражене у процентах відношення кількості фактично виробленої продукції до теоретично можливої.
В енергетичних балансах виходу продукції відповідає коефіцієнт корисної дії – відношення кількості енергії, витраченої на корисну роботу, до всієї витраченої енергії, виражене у процентах. Характеристикою електрохімічних процесів є "вихід за струмом", тобто відношення кількості фактично добутої продукції до теоретично можливої, розрахованої за фактично витраченою електричною енергією при мінімально необхідній напрузі розкладання.