
- •Частина і. Теоретичні основи хімічної технології
- •1.1. Предмет і завдання хімічної технології
- •1.2. Класифікація хімічних виробництв
- •7. Промисловість реактивів і особливо чистих речовин.
- •1.3. Хімічна технологія як наука
- •1.4. Значення хімічної технології, її міжгалузевий характер
- •1.5. Етапи розвитку хімічних виробництв і хімічної технології
- •1.6. Основні напрямки і перспективи розвитку хімічної технології і техніки
- •2.1. Класифікація технологічних процесів
- •2.2. Схеми руху матеріальних та енергетичних потоків
- •2.3. Хіміко-технологічні розрахунки. Матеріальні та енергетичні баланси
- •2.4. Інтенсивність та швидкість процесів
- •2.5. Продуктивність праці
- •2.6. Роль фізико-хімічних закономірностей у хімічній технології
- •2.7. Економічні вимоги, що ставляться до раціонального виробництва
- •2.8. Науково-дослідна, експериментальна і проектна робота в хімічній промисловості
- •3.1. Система процесів у хімічному реакторі
- •3.2. Класифікація хтп
- •3.3. Основні показники ефективності хтп
- •3.4. Термодинамічні основи хтп
- •4.1. Класифікація хімічних реакторів
- •4.2. Режим руху і перемішування реагентів
- •5.1. Гомогенні процеси у газовій фазі
- •5.2. Гомогенні процеси у рідкій фазі
- •5.3. Вплив концентрації реагуючих речовин, тиску, температури, переміщування на швидкість гомогенних реакцій
- •5.4. Реактори для гомогенних процесів
- •6.1. Рівновага і швидкість гетерогенних процесів
- •6.2. Процеси і реактори у системі газ-рідина (г–р)
- •6.3. Процеси і реактори у системі газ-тверде тіло (г–т)
- •7.1. Суть і види каталізу
- •7.2. Гомогенний каталіз
- •7.3. Гетерогенний каталіз
- •7.4. Властивості твердих каталізаторів і їх приготування
- •7.5. Каталітичні реактори
- •8.1. Мінеральна сировина
- •8.2. Добування і підготовка сировини до переробки
- •8.3. Сировина рослинного і тваринного походження
- •8.4. Енергія у хімічному виробництві
- •Частина II. Промислові хімічні виробництва
- •9.1. Зв'язаний азот та його значення
- •9.2. Методи зв'язування атмосферного азоту
- •9.3. Отримання та очищення азотоводневої суміші
- •9.4. Фізико-хімічні основи процесу синтезу амоніаку
- •9.5. Промислові способи виробництва синтетичного амоніаку
- •10.1. Загальна характеристика нітратної кислоти
- •10.2. Фізико-хімічні основи виробництва нітратної кислоти
- •10.3. Оптимальні умови процесу окиснення амоніаку
- •10.4. Переробка нітрозних газів на розбавлену нітратну кислоту
- •10.5. Виробництво розбавленої нітратної кислоти
- •11.1. Основні властивості та застосування сульфатної кислоти
- •11.2. Сировинна база сульфатно-кислотного виробництва
- •11.3. Виробництво сульфітного газу
- •11.4. Контактний спосіб виробництва сульфатної кислоти з колчедану
- •11.5. Виробництво сульфатної кислоти з сірки та сірководню
- •12.1. Загальна характеристика содових продуктів
- •12.2. Фізико-хімічні основи виробництва кальцинованої соди
- •12.3. Принципова схема виробництва кальцинованої соди
- •12.4. Виробництво каустичної соди
- •13.1. Основні закони електрохімії
- •13.2. Електроліз водних розчинів. Виробництво їдкого натру і хлору
- •13.3. Переробка електролітичного хлору. Виробництво хлоридної кислоти
- •14.1. Основні електротермічні закони
- •14.2. Виробництво кальцію карбіду
- •14.3. Виробництво кальцію ціанаміду
- •14.4. Виробництво фосфору і фосфатної кислоти
- •15.1. Піроліз деревини
- •15.2. Виробництво целюлози
- •15.3. Гідроліз деревини
- •15.4. Виробництво каніфолі і терпентину
- •Тушницький Орест Петрович загальна хімічна технологія
- •79000, М. Львів, вул. М. Коперника, 18
- •79057, М. Львів, вул. Генерала Чупринки, 103
12.4. Виробництво каустичної соди
Каустичну соду (NaOH) крім електрохімічного способу виробляють і хімічними способами: вапняно-содовим (або просто вапняним) і феритним.
Сировиною для вапняного способу виробництва каустичної соди є содовий розчин і негашене вапно. Під час реакції вапно гаситься водою розчину і реагує з кальцинованою содою:
Na2CO3 + Са(ОН)2 = 2NaOH + CaCO3,
внаслідок чого утворюється NaOH. Як видно з графіка (рис. 12.2), ступінь каустифікації (так називається процес) тим більший, чим нижча концентрація Na2CO3 у вихідному розчині. Реакція утворення NaOH зворотна: при певних концентраціях і температурах настає стан рівноваги. З підвищенням вмісту соди у розчині значна кількість її лишається невикористаною. Це пояснюється тим, що при збільшенні концентрації Na2CO3 вище певного рівня загальна залишкова лужність розчину зменшується через випадання в осад гідрату подвійної солі (персаніту):
2Na2CO3 + Са(ОН)2 + 2Н2О = 2NaOH+ Na2CO3∙СаСО3∙2Н2О.
Встановлено, що у содових розчинах з концентрацією 14 % персаніт не утворюється. Практично на заводах ступінь каустифікації у рівноважному стані не перевищує 90 %.
Підвищення температури веде до зниження виходу NaOH, тому що розчинність вапна при цьому зменшується; зниження ж температури зменшує швидкість реакції. Отже, процес каустифікації слід проводити при температурах, близьких до 100 °С. У заводських умовах процес здійснюють при 60‑70 °С. Розчини після виділення осаду СаСО3 містять 90‑130 г/л NaOH, тому їх концентрують і зневоднюють.
Технологічний процес виробництва NaOH вапняним способом складається з таких основних операцій: приготування содового розчину розкладанням технічного NaHCO3 водяною парою (декарбонізація); приготування "нормального" розчину; перша каустифікація (взаємодія "нормального" содового розчину з Са(ОН)2), видалення шламу після першої каустифікації; обробка шламу розчином з декарбонізатора; промивання шламу; випарювання лугу, зневоднення NaOH.
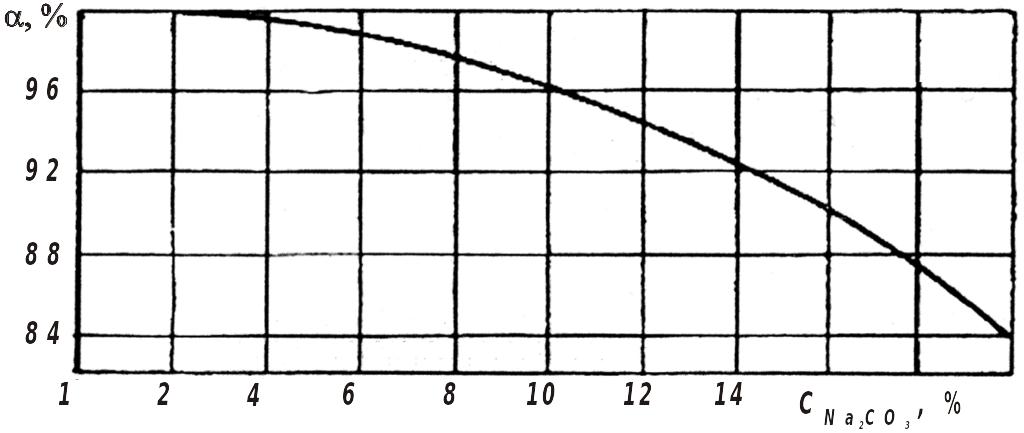
Рис. 12.2. Залежність ступеня каустифікації від концентрації соди С
У водному розчині NaHCO3, оброблений водяною парою, швидко розкладається (декарбонізується).
Для приготування "нормального" содового розчину використовують дозовані кількості декарбонізованого содового розчину, залишок розчину після випарювання лугу і лужної води. Після цього "нормальний" розчин каустифікується вапном, якого беруть з надлишком до 10 %. Процес каустифікації здійснюють в обертових апаратах – каустицерах – стальних барабанах діаметром 2,5 м і завдовжки 15 м, які встановлюють під невеликим кутом у бік завантаження. Ступінь каустифікації досягає 75 %. Для підвищення ступеня каустифікації лужну суспензію першої каустифікації після видалення кусків вапна і коксу, який потрапляє сюди з вапнякововипалювальної печі, подають для другої стадії каустифікації у вертикальні каустицери, після чого ступінь каустифікації становить 85‑90 %. Вертикальні каустицери – це циліндричні апарати з мішалкою загальною висотою 13 м, змонтовані з 14 бочок діаметром 3 м.
Для добування NaOH феритним способом сухий Na2CO3 змішують з подрібненим оксидом заліза у відношенні 1:3 і прожарюють в обертових печах при температурі близько 1000 °С. При цьому утворюються тверді грудочки фериту натрію:
Na2CO3 + Fe2O3 = Na2O ∙ Fe2O3 + CO2 – Q.
Під дією гарячої води ферит натрію розкладається з утворенням їдкого натру та оксиду заліза за реакцією
Na2O ∙ Fe2O3 + 2Н2О = 2NaOH + Fe2O3 ∙ Н2О.
Оксид заліза виділяють з розчину і повертають на виробництво. Розчин, який містить 360‑380 г/л NaOH, використовують у рідкому стані або концентрують і зневоднюють.
Питання до розділу 12
1. Властивості та застосування кальцинованої соди.
2. Яку сировину використовують для виробництва кальцинованої соди?
3. У чому суть амоніачного виробництва кальцинованої соди?
4. Через які стадії відбувається реакція утворення NaHCO3?
5. Які оптимальні умови отримання NaHCO3?
6. Описати принципову схему виробництва кальцинованої соди.
7. Як отримують каустичну соду (NaOH) вапняним способом?
8. Як отримують NaOH феритним способом?
Розділ 13. ЕЛЕКТРОХІМІЧНІ ВИРОБНИЦТВА
