
- •Частина і. Теоретичні основи хімічної технології
- •1.1. Предмет і завдання хімічної технології
- •1.2. Класифікація хімічних виробництв
- •7. Промисловість реактивів і особливо чистих речовин.
- •1.3. Хімічна технологія як наука
- •1.4. Значення хімічної технології, її міжгалузевий характер
- •1.5. Етапи розвитку хімічних виробництв і хімічної технології
- •1.6. Основні напрямки і перспективи розвитку хімічної технології і техніки
- •2.1. Класифікація технологічних процесів
- •2.2. Схеми руху матеріальних та енергетичних потоків
- •2.3. Хіміко-технологічні розрахунки. Матеріальні та енергетичні баланси
- •2.4. Інтенсивність та швидкість процесів
- •2.5. Продуктивність праці
- •2.6. Роль фізико-хімічних закономірностей у хімічній технології
- •2.7. Економічні вимоги, що ставляться до раціонального виробництва
- •2.8. Науково-дослідна, експериментальна і проектна робота в хімічній промисловості
- •3.1. Система процесів у хімічному реакторі
- •3.2. Класифікація хтп
- •3.3. Основні показники ефективності хтп
- •3.4. Термодинамічні основи хтп
- •4.1. Класифікація хімічних реакторів
- •4.2. Режим руху і перемішування реагентів
- •5.1. Гомогенні процеси у газовій фазі
- •5.2. Гомогенні процеси у рідкій фазі
- •5.3. Вплив концентрації реагуючих речовин, тиску, температури, переміщування на швидкість гомогенних реакцій
- •5.4. Реактори для гомогенних процесів
- •6.1. Рівновага і швидкість гетерогенних процесів
- •6.2. Процеси і реактори у системі газ-рідина (г–р)
- •6.3. Процеси і реактори у системі газ-тверде тіло (г–т)
- •7.1. Суть і види каталізу
- •7.2. Гомогенний каталіз
- •7.3. Гетерогенний каталіз
- •7.4. Властивості твердих каталізаторів і їх приготування
- •7.5. Каталітичні реактори
- •8.1. Мінеральна сировина
- •8.2. Добування і підготовка сировини до переробки
- •8.3. Сировина рослинного і тваринного походження
- •8.4. Енергія у хімічному виробництві
- •Частина II. Промислові хімічні виробництва
- •9.1. Зв'язаний азот та його значення
- •9.2. Методи зв'язування атмосферного азоту
- •9.3. Отримання та очищення азотоводневої суміші
- •9.4. Фізико-хімічні основи процесу синтезу амоніаку
- •9.5. Промислові способи виробництва синтетичного амоніаку
- •10.1. Загальна характеристика нітратної кислоти
- •10.2. Фізико-хімічні основи виробництва нітратної кислоти
- •10.3. Оптимальні умови процесу окиснення амоніаку
- •10.4. Переробка нітрозних газів на розбавлену нітратну кислоту
- •10.5. Виробництво розбавленої нітратної кислоти
- •11.1. Основні властивості та застосування сульфатної кислоти
- •11.2. Сировинна база сульфатно-кислотного виробництва
- •11.3. Виробництво сульфітного газу
- •11.4. Контактний спосіб виробництва сульфатної кислоти з колчедану
- •11.5. Виробництво сульфатної кислоти з сірки та сірководню
- •12.1. Загальна характеристика содових продуктів
- •12.2. Фізико-хімічні основи виробництва кальцинованої соди
- •12.3. Принципова схема виробництва кальцинованої соди
- •12.4. Виробництво каустичної соди
- •13.1. Основні закони електрохімії
- •13.2. Електроліз водних розчинів. Виробництво їдкого натру і хлору
- •13.3. Переробка електролітичного хлору. Виробництво хлоридної кислоти
- •14.1. Основні електротермічні закони
- •14.2. Виробництво кальцію карбіду
- •14.3. Виробництво кальцію ціанаміду
- •14.4. Виробництво фосфору і фосфатної кислоти
- •15.1. Піроліз деревини
- •15.2. Виробництво целюлози
- •15.3. Гідроліз деревини
- •15.4. Виробництво каніфолі і терпентину
- •Тушницький Орест Петрович загальна хімічна технологія
- •79000, М. Львів, вул. М. Коперника, 18
- •79057, М. Львів, вул. Генерала Чупринки, 103
12.3. Принципова схема виробництва кальцинованої соди
Функціональна схема виробництва Na2CO3 має такі стадії:
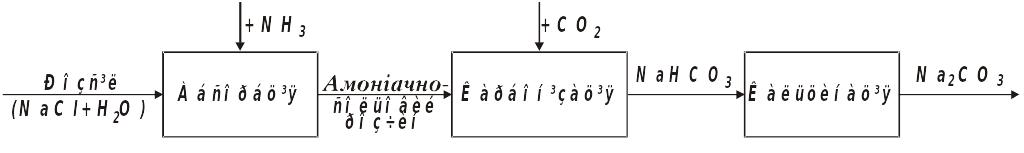
Технологічну схему виробництва кальцинованої соди наведено на рис. 12.1. Водний розчин, в якому міститься 305‑310 г/л NaCl, очищений від солей Са і Mg, надходить із збірника у промивник 7, де поглинає СО2 з газів, що надходять з карбонізаційної колони 6, і NH3 з газів, що надходять з вакуум-фільтра 10. Не поглинуті розчином гази (в основному азот) викидаються в атмосферу. З промивника газів 7 розчин подається в абсорбер 8, де поглинає регенеровані NH3 і СО2, які надходять з дистиляційної колони 14. Амонізований і частково карбонізований розчин, охолоджений у холодильнику 9, безперервно надходить у верхню частину карбонізаційної колони 6, де насичується далі СО2 (37‑40 % СО2), який подається після очищення в апараті 2 з вапняково-випалювальної печі 1, і змішаним газом (60‑80 % СО2), що утворюється після добавляння газу з содової печі 12 (85‑90 %-ий СО2). Гази подаються у колону 6 під тиском 0,3‑0,4 МПа, який створюється компресорами 3 і 5 для подолання гідравлічного опору колон. Утворений NaHCO3 випадає в осад, а у розчині залишаються в основному NaCl і NH4C1. Суспензія з колони 6 для відокремлення NaHCO3 подається на вакуум-фільтр 10. Фільтрат надходить у дистиляційну колону 14, де регенерується NH3. Карбонати амонію розкладаються у колоні 14 при нагріванні до 70‑80 °С, a NH4C1 розкладається у колоні 13 під дією вапнякового молока, що утворюється гашенням вапна в апараті 4. Амоніак і СО2, що утворюються при розкладанні солей амонію, відганяються водяною парою, що подається у нижню частину апарата 13, і надходять в абсорбер 8 для поглинання їх соляним розчином.
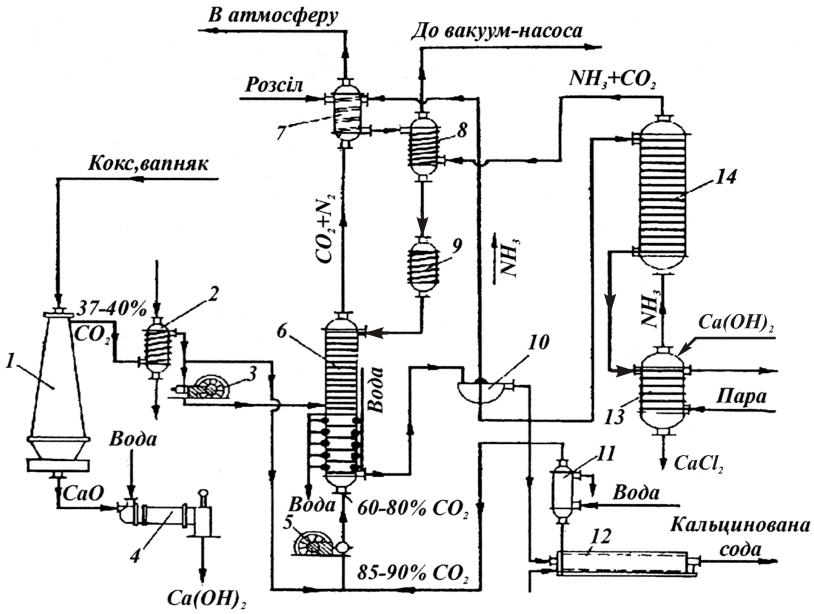
Рис. 12.1. Принципова схема виробництва соди амоніачним способом: 1 – піч для випалювання вапняку; 2 – очисний апарат; 3,5 – компресори; 4 – апарат для гасіння вапна; 6 – карбонізаційна колона; 7 – промивна колона; 8 – абсорбер; 9 – холодильник; 10 – вакуум-фільтр; 11 – промивний апарат; 12-содова піч; 13 – колона розкладу NH4Cl; 14 – дистиляційна колона
Сирий NaHCO3 з фільтра 10 подається в обертову содову піч 12 для кальцинування. Кальцинована сода після печі 12 іде на пакування або на склад.
Внаслідок розкладання NaHCO3 у содових печах утворюється газова суміш з вмістом 85‑90 % СО2, яка після охолодження і промивання в апараті 11 змішується з газом вапнякововипалювальної печі 1 і компресором 5 подається у нижню частину карбонізаційної колони 6.
Складний процес виробництва кальцинованої соди здійснюється послідовно у таких цехах содового заводу, які прийнято називати станціями: попереднього очищення амоніачно-сольового розчину від солей Са і Mg, абсорбції, карбонізації, фільтрації, дистиляції, кальцинації.
Важливими відділами содових заводів є також вапняково-випалювальний, гашення вапна, склад готової продукції та ін.
Основні процеси й апаратура у виробництві кальцинованої соди. У виробництві соди амоніачним способом використовується водний розчин кухонної солі (розсіл), який добувають із природних джерел або виготовляють, розчиняючи у воді тверду кам'яну сіль. Сирий розсіл з різними домішками і розчиненими солями Са і Mg очищають розчинами Na2CO3, NaOH або вапнякового молока, які осаджують йони Са2+ і Mg2+:
Са2+ + Na2CO3 = СаСО3 + 2Na+;
Mg2+ + 2NaOH = Mg(OH)2 + 2Na+.
Утворений осад видаляють у спеціальних відстійниках і фільтруванням. На виробництво 1 т Na2СОз витрачається близько 5 м3 сирого розсолу, тому содові заводи будують переважно у місцевостях, де є природні поклади кухонної солі. Після очищення розсіл спрямовують на станцію абсорбції.
Призначення станції абсорбції – виготовляти потрібний для карбонізації амоніачно-сольовий розчин відповідної концентрації. Спочатку у промивному апараті розсіл частково насичується газами, які надходять із станцій карбонізації, абсорбції і фільтрації, а потім остаточно в абсорбері – NH3, що надходить із станції дистиляції. Аміак і СО2 утворюють амонію карбонат і карбамід:
2NH3 + СО2 + Н2О = (NН4)2СО3;
2NH3 + СО2 = NH2COONH4.
При цьому виділяється велика кількість теплоти, що нагріває розсіл до 80‑90 °С і знижує ефект абсорбції, тому абсорбцію здійснюють з проміжним охолодженням рідини у холодильниках.
Для абсорбції використовують апарати барботажного типу. У сучасних удосконалених барботажних колонах для інтенсифікації поглинання збільшують поверхню дотику газів з рідиною, розміщуючи замість одного великого ковпака 14 маленьких.
Вся апаратура абсорбції на содових заводах, як правило, змонтована у двох колонах – великій і малій. Велика колона близько 41 м заввишки і діаметром 2,8 м складається з абсорбера і промивників газів, що надходять з карбонізаційної колони, а також газів, що надходять з вакуум-фільтрів. Промивник газу і відстійник змонтовані у малій колоні.
На станції абсорбції систематично контролюється вміст NH3 у рідині та у газі, що виходять після абсорберів і промивників газів.
Станція карбонізації є найважливішою станцією на содовому заводі. Тут амоніачно-сольовий розчин насичується СО2 з утворенням суспензії NaHCO3. Карбонізація послідовно здійснюється у трьох подібних між собою колонах: попередньої карбонізації, промивній і осаджувальній. Колона попередньої карбонізації призначена для розчинення NaHCO3, який викристалізувався на стінках колони:
2NaHCO3 + 2NH4OH = Na2CO3 + (NН4)2СО3 + 2Н2О.
Промивна колона зрошується рідиною, що виходить з колони попередньої карбонізації, яка тут же донасичується СО2. До осаджувальної карбонізаційної колони 6 (див. рис. 12.1) у верхню холодильну частину надходить газ із вмістом СО2 37‑40 % і у нижню холодильну бочку – змішаний газ, в якому СО2 60‑80 %.
Реакція карбонізації відбувається з виділенням великої кількості теплоти, внаслідок чого температура рідини у середній частині колони підвищується до 60‑65 °С, тому нижня частина колони (десять холодильних бочок) охолоджується водою. Карбонізація здійснюється у безперервно діючих апаратах, які працюють за принципом протитечії. Швидкість реакції утворення NaHCO3 залежить від вмісту NH3, і NaСl у розчині, вмісту СО2 у газі, що надходить на карбонізацію, і від температури, при якій відбувається процес карбонізації.
Здебільшого карбонізаційна колона – це циліндричний апарат барботажної дії діаметром 2,7 м з загальною висотою близько 26 м. Колона складається з 7‑10 холодильних бочок, 25‑29 барботажних бочок з тарілками і 2 газових бочок без тарілок. Рідина проходить через карбонізаційну колону за 2‑2,5 год.
Процес карбонізації закінчується у нижній бочці. Температура, з якою виходить рідина з колони, не повинна перевищувати 26‑28 °С, що забезпечує утворення крупних кристалів NaHCO3, які добре відфільтровуються у вакуум-фільтрах. При утворенні 1 т соди поглинається близько 650 кг СО2. Середня продуктивність такої колони 190 т Na2CО3 на добу.
На станції фільтрації NаНСОз відокремлюють від маточного розчину і промивають його на вакуум-фільтрах. Продуктивність одного вакуум-фільтра – 160‑200 т соди на добу. На станції дистиляції NH3 регенерують з розчинів, які надходять із вакуум-фільтрів. У них NH3 міститься у зв'язаному (NH4C1) і у напівзв'язаному ((NН4)2СОз і NН4НСОз) станах. Амоніак, який перебуває у напівзв'язаному стані, виділяється при нагріванні розчину до 80 °С:
(NH4)2CO3 = 2NH3 + СО2 + Н2О;
NH4HCO3 = NH3 + CO2 + H2O.
Для виділення зв'язаного NH3 розчин обробляють вапняним молоком:
2NН4Сl + Са(ОН)2 = 2NH3 + СаС12 + 2Н2О.
Для виділення NH3 розчин продувають водяною парою. Утворений розчин NaCl і СаCl2 використовують як флотаційний реагент. Основним апаратом станції дистиляції є дистиляційна колона барботажного типу.
Станція кальцинації призначена для розкладання (при 140‑170 °С) сирого NаНСОз з утворенням Na2CO3:
2NaHCO3 = Na2CO3 + СО2 + Н2О – Q;
(NH4)2CO3 = 2NH3 + СО2 + Н2О.
Амоніак і СО2 повертаються знову у голову процесу, а сирий NаНСО3 подається на кальцинацію у піч. Щоб запобігти прилипанню до стінок печі сирого NаНСО3, до нього іноді примішують сухий Na2CO3. Парогазова суміш, що утворюється при розкладанні NаНСО3, очищається від содового пилу у циклоні, охолоджується водою у холодильнику, промивається водою у колоні і з температурою близько 30 °С і вмістом СО2 90 % надходить під тиском до 0,3 МПа у карбонізаційну колону. При добуванні 1 т соди у содовій печі утворюється близько 400 кг СО2, 500 кг Н2О і 15 кг NH3.
Содова піч обігрівається зовні горючими газами та обертається зі швидкістю близько 5 об/хв.
Для добування 1 т кальцинованої соди витрачається приблизно така кількість матеріалів і енергії:
очищений розсіл (310 г/л NaCl), м3 4,85-5,15
амоніачна вода (26,5 % NH3), кг 12-14
вапно (85 % CaO), т 0,7-0,71
електроенергія, кВт·год 36‑102
водяна пара, млн. кДж 5,36‑5,52
паливо, кг 120‑145
вода, м3 82-40
В Україні виробляється кальцинована сода трьох марок: технічна, фотографічна та оптична, які відрізняються між собою ступенем чистоти. Зберігають і перевозять кальциновану соду у багатошарових паперових мішках та у критих вагонах.
Перспективи розвитку амоніачно-содового виробництва. Незважаючи на те, що амоніачним способом соду добувають понад 100 років, принципова схема його і навіть апаратура зазнали порівняно невеликих змін. Тільки останнім часом у зв'язку із зростанням масштабів содового виробництва і збільшенням кількості відходів до технологічної схеми було внесено деякі зміни. Наприклад, у схему було включено попереднє очищення сирого розсолу, вилуговування підземних пластів солі за методом гідроврубу, одноступеневу схему добування амонізованого розсолу, кальцинацію NaHCO3 без добавляння соди та ін. Одночасно збільшувалась продуктивність окремих агрегатів від 100‑150 до 600 т на добу. Запроваджено автоматичний контроль і автоматизацію управління виробництвом, що сприяло підвищенню продуктивності праці, поліпшенню якості продукції і техніко-економічних показників.
Проводяться науково-дослідні роботи пов'язані з удосконаленням та інтенсифікацією окремих апаратів, а також з пошуками нових видів сировини. Так, А.П. Бєлопольський запропонував замість NaCl використовувати Na2SO4. Амоніачно-содовий процес у цьому разі відбуватиметься за таким рівнянням:
Na2SО4 + 2NH3 + 2СО2 + 3Н2О = 2NaHCO3 + (NH4)2SO4.
Утворений (NH4)2SO4 широко використовується як добриво. Але цей процес набагато складніший, ніж з NaCl.
Одним з найважливіших напрямків цих досліджень є виробництво соди при переробці нефеліну.
Виробництво гідрокарбонату натрію. Очищений NaHCO3 випускають двох марок: технічний і медичний. У них нормуються вміст NaHCO3, Na2CO3, NaCl і волога. У готовому продукті не повинно бути солей амонію, важких металів і миш'яку.
Вихідною речовиною для виробництва очищеного NaHCO3 є Na2CO3 або сирий NaHCO3 після виробництва кальцинованої соди. У першому випадку Na2CO3 розчиняють у воді, у другому NаНСОз добре очищають від NH4C1 і промивають водою. Розмішаний у воді NaHCO3 продувають у декарбонізаторах водяною парою, внаслідок чого амонійні солі і гідрокарбонат розкладаються за рівняннями (5) і (6), а NH3 видаляється разом з СО2. Після фільтрування содові розчини карбонізують:
Na2CO3 + СО2 + Н2О = 2NaHCO3.
Гідрокарбонат відфільтровують, центрифугують, сушать гарячим повітрям і подрібнюють. Пакують NaHCO3 залежно від промислового призначення.
