
- •Частина і. Теоретичні основи хімічної технології
- •1.1. Предмет і завдання хімічної технології
- •1.2. Класифікація хімічних виробництв
- •7. Промисловість реактивів і особливо чистих речовин.
- •1.3. Хімічна технологія як наука
- •1.4. Значення хімічної технології, її міжгалузевий характер
- •1.5. Етапи розвитку хімічних виробництв і хімічної технології
- •1.6. Основні напрямки і перспективи розвитку хімічної технології і техніки
- •2.1. Класифікація технологічних процесів
- •2.2. Схеми руху матеріальних та енергетичних потоків
- •2.3. Хіміко-технологічні розрахунки. Матеріальні та енергетичні баланси
- •2.4. Інтенсивність та швидкість процесів
- •2.5. Продуктивність праці
- •2.6. Роль фізико-хімічних закономірностей у хімічній технології
- •2.7. Економічні вимоги, що ставляться до раціонального виробництва
- •2.8. Науково-дослідна, експериментальна і проектна робота в хімічній промисловості
- •3.1. Система процесів у хімічному реакторі
- •3.2. Класифікація хтп
- •3.3. Основні показники ефективності хтп
- •3.4. Термодинамічні основи хтп
- •4.1. Класифікація хімічних реакторів
- •4.2. Режим руху і перемішування реагентів
- •5.1. Гомогенні процеси у газовій фазі
- •5.2. Гомогенні процеси у рідкій фазі
- •5.3. Вплив концентрації реагуючих речовин, тиску, температури, переміщування на швидкість гомогенних реакцій
- •5.4. Реактори для гомогенних процесів
- •6.1. Рівновага і швидкість гетерогенних процесів
- •6.2. Процеси і реактори у системі газ-рідина (г–р)
- •6.3. Процеси і реактори у системі газ-тверде тіло (г–т)
- •7.1. Суть і види каталізу
- •7.2. Гомогенний каталіз
- •7.3. Гетерогенний каталіз
- •7.4. Властивості твердих каталізаторів і їх приготування
- •7.5. Каталітичні реактори
- •8.1. Мінеральна сировина
- •8.2. Добування і підготовка сировини до переробки
- •8.3. Сировина рослинного і тваринного походження
- •8.4. Енергія у хімічному виробництві
- •Частина II. Промислові хімічні виробництва
- •9.1. Зв'язаний азот та його значення
- •9.2. Методи зв'язування атмосферного азоту
- •9.3. Отримання та очищення азотоводневої суміші
- •9.4. Фізико-хімічні основи процесу синтезу амоніаку
- •9.5. Промислові способи виробництва синтетичного амоніаку
- •10.1. Загальна характеристика нітратної кислоти
- •10.2. Фізико-хімічні основи виробництва нітратної кислоти
- •10.3. Оптимальні умови процесу окиснення амоніаку
- •10.4. Переробка нітрозних газів на розбавлену нітратну кислоту
- •10.5. Виробництво розбавленої нітратної кислоти
- •11.1. Основні властивості та застосування сульфатної кислоти
- •11.2. Сировинна база сульфатно-кислотного виробництва
- •11.3. Виробництво сульфітного газу
- •11.4. Контактний спосіб виробництва сульфатної кислоти з колчедану
- •11.5. Виробництво сульфатної кислоти з сірки та сірководню
- •12.1. Загальна характеристика содових продуктів
- •12.2. Фізико-хімічні основи виробництва кальцинованої соди
- •12.3. Принципова схема виробництва кальцинованої соди
- •12.4. Виробництво каустичної соди
- •13.1. Основні закони електрохімії
- •13.2. Електроліз водних розчинів. Виробництво їдкого натру і хлору
- •13.3. Переробка електролітичного хлору. Виробництво хлоридної кислоти
- •14.1. Основні електротермічні закони
- •14.2. Виробництво кальцію карбіду
- •14.3. Виробництво кальцію ціанаміду
- •14.4. Виробництво фосфору і фосфатної кислоти
- •15.1. Піроліз деревини
- •15.2. Виробництво целюлози
- •15.3. Гідроліз деревини
- •15.4. Виробництво каніфолі і терпентину
- •Тушницький Орест Петрович загальна хімічна технологія
- •79000, М. Львів, вул. М. Коперника, 18
- •79057, М. Львів, вул. Генерала Чупринки, 103
9.5. Промислові способи виробництва синтетичного амоніаку
Принципова схема виробництва. Для досягнення високої продуктивності каталізатора синтез NH3 провадять, не досягаючи рівноважного стану. Газ пропускають з такою об'ємною швидкістю, при якій газова суміш, що виходить з апарата, далека від стану рівноваги і містить невелику кількість NH3. Виділивши NH3 з азотоводневої суміші, її знову спрямовують у контактний апарат.
Перша стадія процесу – стискання азотоводневої суміші до тиску, при якому здійснюється синтез NH3.
Способи виробництва NH3 залежно від робочого тиску поділяються на три групи: системи високого тиску (45‑100 МПа), системи середнього тиску (20‑30 МПа) і системи низького тиску (до 10 МПа).
Функціональна схема виробництва NH3 має такі стадії
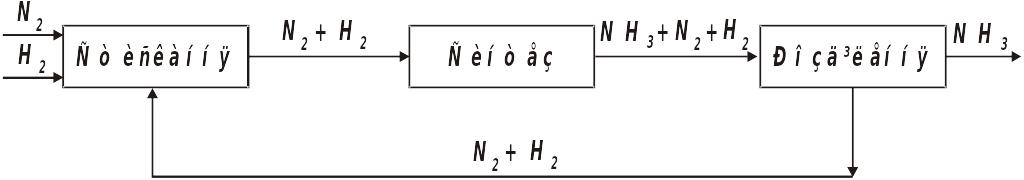
Системи синтезу NH3 відрізняються також схемами циркуляції азотоводневої суміші, яка не прореагувала, способами виділення NH3 з азотоводневої суміші, температурними режимами, об'ємними швидкостями, концентрацією інертних газів у циклі, конструкціями контактних апаратів, типами машин для циркуляції газів. Проте відмінності в окремих системах не позначаються на принциповій схемі синтезу NH3.
Останнім часом більшу частину NH3 в усьому світі виробляють у системах середнього тиску (32 МПа).
Синтез NH3 під середнім тиском. Схему установки для синтезу амоніаку наведено на рис. 9.2. Азотоводнева суміш надходить у колону синтезу 1, в якій частково перетворюється в NH3 (ступінь перетворення не перевищує 17%).
Після колони синтезу газова суміш містить, %: Н2 – 52‑57; N2 – 17,5‑19; NH3 – 12‑18; СН4 – 6,6 і Аr – 5,5. Концентрація NH3 після колони синтезу залежить в основному від чистоти вихідної суміші, об'ємної швидкості, активності і часу роботи каталізатора та конструкції каталізаторної коробки у колоні синтезу.
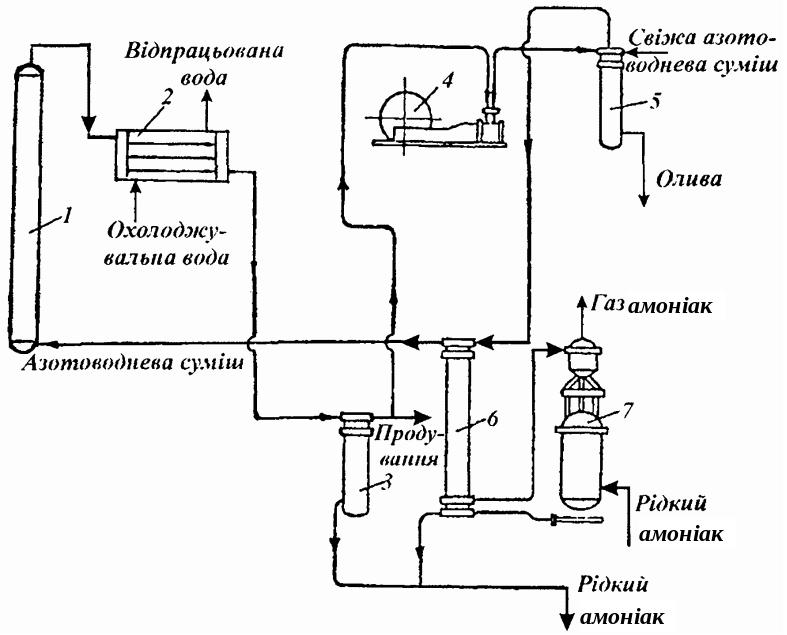
Рис. 9.2. Схема установки синтезу NH3 під середнім тиском: 1 – колона синтезу; 2 – конденсатор; 3 – сепаратор; 4 – насос; 5 – фільтр; 6 – теплообмінник-конденсатор; 7 – випарник
З колони синтезу газ з температурою 120‑200 °С надходить у водяний конденсатор 2, де охолоджується до 25‑35 °С, внаслідок чого основна частина NH3 конденсується і видаляється у сепараторі 3.
Кількість NH3, що залишається у газовій суміші при даній температурі конденсації, обернено пропорційна загальному тиску Р. Це дає змогу, застосовуючи високий тиск і охолоджуючи газову суміш у водяних холодильниках, вилучати з неї 80‑90 % NH3. Установки, які працюють при високих тисках, виробляють переважно рідкий NH3, а установки менших тисків – газоподібний.
В азотоводневій суміші, яка циркулює через систему, концентрація інертних газів (СН4, Аr та ін.) може збільшитися настільки, що порушиться режим роботи колони. Тому частину газової суміші треба періодично виводити, щоб зменшити вміст цих газів. Кількість азотоводневої суміші, яку необхідно вивести з циклу (з розрахунку на 1 т виробленого NH3), дорівнює:
![]() ,
,
де: А – витрата азотоводневої суміші на 1 т NH3; Мсв та Мц – молярні частки інертних газів у свіжій і циркулюючій суміші.
Для компенсації втрати тиску газову суміш стискають циркуляційним насосом 4 до 30‑32 МПа і подають у фільтр 5, куди надходить і свіжа азотоводнева суміш. Кількість свіжої азотоводневої суміші, яку треба ввести у систему, дорівнює сумі кількості газу, перетвореного на NH3, і кількості виведеної суміші з інертними газами та газу, який розчинився в NH3.
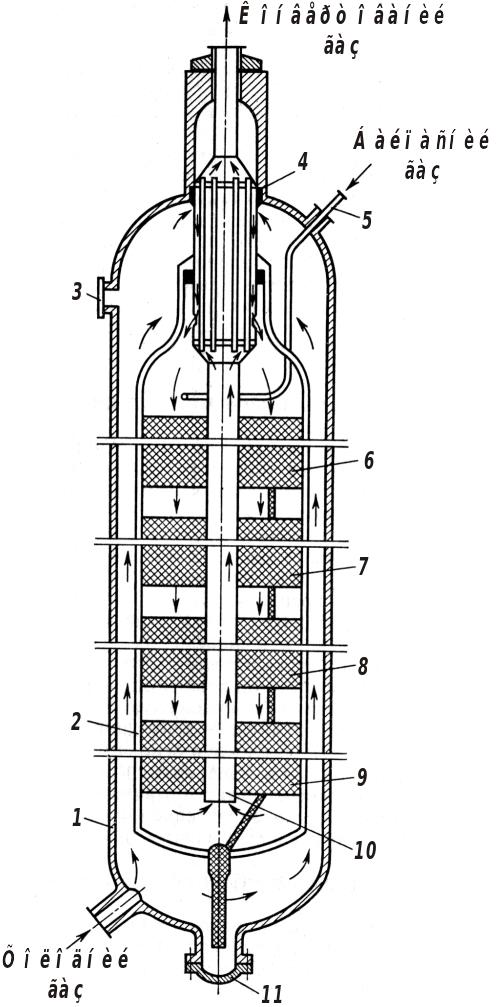
Рис. 9.3. Схема чотириполичкової колони синтезу амоніаку під середнім тиском: 1 – корпус колони; 2 – корпус каталізаторної коробки; 3 – аварійний люк; 4 – трубчастий теплообмінник; 5 – патрубок вводу байпасного газу; 6‑9 – полиці з каталізатором; 10 – центральна труба; 11 – люк для розвантаження каталізатора
На фільтрі, крім оливи від насоса, затримується і амонію карбонат, що міг утворитися з NH3, водяної пари і СО2, які залишились у газовій суміші
СО2 + Н2О + 3NH3 = (NH4)2CO3.
З фільтра газова суміш надходить у конденсаційну колону 6, яка складається з теплообмінника і сепаратора. У теплообміннику суміш охолоджується циркуляційним газом до 5‑15 °С і подається для конденсації залишків NH3, що утворились раніше у колоні синтезу, в амоніачний випарник 7, температура в якому (0‑15 °С) підтримується киплячим NH3. Газова суміш з фільтра 5 через теплообмінник-конденсатор 6 і амоніачний випарник 7 надходить знову у колону синтезу і цикл синтезу замикається.
Колона синтезу – найважливіша частина кожного агрегату синтезу NH3. Конструкція колони повинна забезпечувати тривалий, безперебійний та безпечний перебіг процесу під великим тиском.
Азотоводнева суміш і NH3 агресивно діють на матеріал (сталь), з якого виготовлено колону. Особливо шкідлива дія Н2, який вимиває зі сталі вуглець, утворюючи з ним під дією високої температури і тиску вуглеводні (відбувається воднева корозія).
Для забезпечення високої продуктивності колона повинна містити велику кількість каталізатора, сприяти автотермічності процесу та використанню зайвої теплоти, наприклад для виробництва водяної пари. Тому основне при конструюванні колони – запобігти впливу високої температури на товстостінні частини – тіло колони. Цього досягають, спрямовуючи потік холодної газової суміші вздовж внутрішньої стінки колони. Автотермічність досягається тим, що поряд з каталізаторною коробкою у колону вмонтовуються теплообмінники. Застосовують поличкові і трубчасті колони.
На рис. 9.3 наведено чотириполичкову трубчасту колону синтезу амоніаку під середнім тиском. Колона висотою 30 м і діаметром 2,5 м виготовлена зі спеціальної сталі, яка здатна витримувати високий тиск, температуру й агресивну дію водню та амоніаку. Холодна азотоводнева суміш подається в нижню частину колони і скеровується вгору між корпусом колони 1 і корпусом каталізаторної коробки 2. У верхній частині реактора холодний газ потрапляє у міжтрубний простір теплообмінника 4, в якому він нагрівається до 400 °С за рахунок теплоти конвертованого газу, що залишає колону синтезу по трубах теплообмінника 4. Підігрітий газ послідовно проходить чотири шари каталізатора 6‑9 і потрапляє в центральну трубу 10, по якій подається в теплообмінник 4. При цьому газ охолоджується приблизно до 330 °С. У зв'язку з тим, що реакція синтезу амоніаку екзотермічна, на каталізаторних полицях газ дуже нагрівається (особливо на перших, де перетворюється велика кількість вихідних речовин). При цьому температура значно відхиляється від оптимальної. Для регулювання температурного режиму каталізу передбачено подачу байпасного холодного синтез-газу (патрубок 5) у кожний шар каталізатора (на схемі показано подачу газу тільки у перший). При робочій температурі 300‑520 °С і тиску 32 МПа колона синтезу вказаних розмірів має продуктивність за амоніаком коло 1360 т/добу.
Синтез NH3 під високим тиском. Системи високого тиску синтезу NH3 працюють при 45‑60 МПа. У системах високого тиску завдяки великій концентрації NH3 у газовій суміші, яка виходить з колони синтезу, NH3 легко конденсується і тому відпадає потреба в амоніачному охолодженні.
Сучасний агрегат розвиває потужність 1200‑1500 т NH3 на добу, розміщуючись на площі тільки 20000 м2, і не потребує великої кількості обслуговуючого персоналу.
Сорти, перевезення і зберігання NH3. Рідкий синтетичний NH3 випускають двох сортів:
|
І сорт (сорт А) |
ІІ сорт (сорт Б) |
Вміст NH3, %, не менше |
99,75 |
99,6 |
Домішок, не більше |
||
вологи, % |
0,25 |
0,4 |
масла, мг/л |
10 |
35 |
заліза, мг/л |
2 |
– |
Продукція І сорту призначена для холодильних машин, II сорту – для добування газоподібного NH3, виробництва HNO3, азотних добрив і т. д.
Невеликі кількості NH3 перевозять і зберігають у стальних балонах місткістю 30 і 35 л під. тиском 3 МПа. Балони пофарбовані у жовтий колір з написом на них фарбою "Аміак".
Для перевезення великих кількостей рідкого NH3 застосовують спеціальні залізничні цистерни низького тиску 0,4 МПа або високого тиску до 2 МПа, які вміщують до 50 тис. л NH3.
Рідкий NH3 з сепараторів і конденсаційних колон дроселюється до тиску 1,6 МПа і надходить у збірники рідкого NH3. Збірник рідкого NH3 – це горизонтальний зварний резервуар зі сферичним днищем 5,0 м завдовжки і діаметром 1,1 м. У збірнику з рідкого NH3 виділяються гази, які містять N2, Н2 і NH3, і по окремому трубопроводу разом з газами продування надходять на установку вловлювання NH3.
Техніка безпеки у виробництві синтетичного NH3. Виробництво NH3 є вогне- і вибухонебезпечним. При виробництві азотоводневої суміші методом конверсії СН4 природного газу і конверсії CO із застосуванням високих температур і тисків завжди є небезпека виникнення пожежі і вибуху. Щоб запобігти загазованості робочих приміщень вибухонебезпечними та отруйними речовинами, необхідно встановити постійний нагляд за герметичністю фланцевих з'єднань трубопроводів і апаратів та стежити за справністю притічно-витяжної вентиляції. Для управління технологічним процесом використовують системи автоматичного і дистанційного управління.
Питання до розділу 9
1. Яку роль відіграє азот у природі і житті людини?
2. Які є методи зв'язування повітряного азоту? Навести коротку характеристику кожного з них.
3. Як отримують азот для приготування азотоводневої суміші?
4. Як можна отримати водень для синтезу амоніаку?
5. Як отримують азотоводневу суміш конверсією метану?
6. Які є методи очищення азотоводневої суміші від сірководню?
7. Як очищають конвертований газ від СО2?
8. Як здійснюють очищення газу від оксиду вуглецю?
9. Які умови синтезу амоніаку з N2 і Н2?
10. Які каталізатори використовують для синтезу амоніаку?
11. Які отрути впливають на активність каталізатора?
12. За якими стадіями відбувається каталітичний процес синтезу амоніаку?
13. Дати характеристику об'ємної швидкості і продуктивності каталізатора.
14. Описати принципову схему виробництва амоніаку.
15. Описати схему установки синтезу амоніаку під середнім тиском.
16. Як працює колона синтезу амоніаку?
17. Як здійснюють синтез амоніаку під високим тиском?
18. Як перевозять і зберігають амоніак?
19. Техніка безпека у виробництві амоніаку.
Розділ 10. ВИРОБНИЦТВО НІТРАТНОЇ КИСЛОТИ
