
- •Частина і. Теоретичні основи хімічної технології
- •1.1. Предмет і завдання хімічної технології
- •1.2. Класифікація хімічних виробництв
- •7. Промисловість реактивів і особливо чистих речовин.
- •1.3. Хімічна технологія як наука
- •1.4. Значення хімічної технології, її міжгалузевий характер
- •1.5. Етапи розвитку хімічних виробництв і хімічної технології
- •1.6. Основні напрямки і перспективи розвитку хімічної технології і техніки
- •2.1. Класифікація технологічних процесів
- •2.2. Схеми руху матеріальних та енергетичних потоків
- •2.3. Хіміко-технологічні розрахунки. Матеріальні та енергетичні баланси
- •2.4. Інтенсивність та швидкість процесів
- •2.5. Продуктивність праці
- •2.6. Роль фізико-хімічних закономірностей у хімічній технології
- •2.7. Економічні вимоги, що ставляться до раціонального виробництва
- •2.8. Науково-дослідна, експериментальна і проектна робота в хімічній промисловості
- •3.1. Система процесів у хімічному реакторі
- •3.2. Класифікація хтп
- •3.3. Основні показники ефективності хтп
- •3.4. Термодинамічні основи хтп
- •4.1. Класифікація хімічних реакторів
- •4.2. Режим руху і перемішування реагентів
- •5.1. Гомогенні процеси у газовій фазі
- •5.2. Гомогенні процеси у рідкій фазі
- •5.3. Вплив концентрації реагуючих речовин, тиску, температури, переміщування на швидкість гомогенних реакцій
- •5.4. Реактори для гомогенних процесів
- •6.1. Рівновага і швидкість гетерогенних процесів
- •6.2. Процеси і реактори у системі газ-рідина (г–р)
- •6.3. Процеси і реактори у системі газ-тверде тіло (г–т)
- •7.1. Суть і види каталізу
- •7.2. Гомогенний каталіз
- •7.3. Гетерогенний каталіз
- •7.4. Властивості твердих каталізаторів і їх приготування
- •7.5. Каталітичні реактори
- •8.1. Мінеральна сировина
- •8.2. Добування і підготовка сировини до переробки
- •8.3. Сировина рослинного і тваринного походження
- •8.4. Енергія у хімічному виробництві
- •Частина II. Промислові хімічні виробництва
- •9.1. Зв'язаний азот та його значення
- •9.2. Методи зв'язування атмосферного азоту
- •9.3. Отримання та очищення азотоводневої суміші
- •9.4. Фізико-хімічні основи процесу синтезу амоніаку
- •9.5. Промислові способи виробництва синтетичного амоніаку
- •10.1. Загальна характеристика нітратної кислоти
- •10.2. Фізико-хімічні основи виробництва нітратної кислоти
- •10.3. Оптимальні умови процесу окиснення амоніаку
- •10.4. Переробка нітрозних газів на розбавлену нітратну кислоту
- •10.5. Виробництво розбавленої нітратної кислоти
- •11.1. Основні властивості та застосування сульфатної кислоти
- •11.2. Сировинна база сульфатно-кислотного виробництва
- •11.3. Виробництво сульфітного газу
- •11.4. Контактний спосіб виробництва сульфатної кислоти з колчедану
- •11.5. Виробництво сульфатної кислоти з сірки та сірководню
- •12.1. Загальна характеристика содових продуктів
- •12.2. Фізико-хімічні основи виробництва кальцинованої соди
- •12.3. Принципова схема виробництва кальцинованої соди
- •12.4. Виробництво каустичної соди
- •13.1. Основні закони електрохімії
- •13.2. Електроліз водних розчинів. Виробництво їдкого натру і хлору
- •13.3. Переробка електролітичного хлору. Виробництво хлоридної кислоти
- •14.1. Основні електротермічні закони
- •14.2. Виробництво кальцію карбіду
- •14.3. Виробництво кальцію ціанаміду
- •14.4. Виробництво фосфору і фосфатної кислоти
- •15.1. Піроліз деревини
- •15.2. Виробництво целюлози
- •15.3. Гідроліз деревини
- •15.4. Виробництво каніфолі і терпентину
- •Тушницький Орест Петрович загальна хімічна технологія
- •79000, М. Львів, вул. М. Коперника, 18
- •79057, М. Львів, вул. Генерала Чупринки, 103
8.4. Енергія у хімічному виробництві
В хімічній промисловості енергія витрачається не тільки для проведення хімічної реакції того чи іншого технологічного процесу, а й на різні допоміжні роботи, пов'язані з виробництвом. Витрата енергії визначається кількістю кіловат-годин, кілокалорій (кілоджоулів) або кількістю палива (тонн, кілограмів, кубометрів), витрачених на виробництво одиниці продукції. В енергетичному відношенні виробничі процеси поділяються на силові, теплові, електрохімічні, електротермічні та ін. Для здійснення цих процесів застосовується енергія електричного струму, водяної пари, гарячої води, палива, радіоактивного випромінювання, сонячна енергія.
Провідна роль у сучасній промисловості належить електричній енергії: її найлегше передавати на далекі відстані і використовувати у виробництві для різноманітних потреб. Здійснення деяких виробничих процесів стало можливим тільки завдяки застосуванню електричної енергії. Це – електрохімічні, електротермічні, електромагнітні процеси, а також процеси, пов'язані з використанням електростатичних явищ. Дуже широко використовується перетворення електричної енергії у механічну, яка потрібна для проведення операцій подрібнення, змішування, центрифугування, транспортування рідин і газів, роботи компресорів, вентиляторів та ін.
Електричні печі є основою розвитку високоякісної металургії. На базі електротермії створено і розвиваються виробництва феросплавів, спеціальних сплавів, чистих і надчистих кольорових, рідкісних і легких металів, кальцію карбіду, фосфору.
Джерелами електроенергії є використання енергії води на гідроелектростанціях, а також перетворення теплової й атомної енергії в електричну на теплових і атомних електростанціях.
Теплова енергія широко використовується у хімічній промисловості для здійснення багатьох фізичних операцій: нагрівання, плавлення, сушіння, випарювання, дистиляції, а також для проведення ендотермічних процесів. Джерелом теплової енергії є паливо, при спалюванні якого утворюються паливні гази, їх використовують безпосередньо або для добування водяної пари, гарячої і перегрітої води та ін. Крім палива, для отримання теплової енергії використовується перетворення електроенергії у теплову.
Оскільки температура є одним з основних чинників зміни швидкості хімічних реакцій, створення оптимального теплового режиму відіграє у хімічній технології надзвичайно важливу роль. Теплова енергія екзотермічних реакцій становить незначну частку порівняно з іншими видами енергії, що використовуються у хімічній технології.
Ядерна енергія. Освоєння і промислове застосування ядерної енергії для виробництва електричної енергії безмежно збільшує запаси природної енергії. Дедалі більшого поширення набувають радіаційні хімічні процеси. Подальше використання атомної енергії у хімічній технології є актуальним завданням сучасної науки і техніки.
Хімічна енергія гальванічних елементів і акумуляторів поки що мало використовується у хімічній технології. У майбутньому ці джерела енергії матимуть величезне значення, тому що при невеликих габаритах у них можна досягати великої потужності з високим к. к. д. Останнім часом для збільшення строку використання у гальванічний елемент добавляють активний матеріал у міру його витрати. Це досягається у спеціальних приладах – електрохімічних генераторах електричної енергії. Прилади, в яких активним матеріалом негативного електрода є звичайне паливо – природний газ, Н2, CO тощо – називають паливними елементами. Активним матеріалом катода може бути О2.
Останнім часом широко використовують хімічну енергію вибухових речовин у будівництві гідроелектростанцій, шляхів, каналів, добуванні сировини з родовищ та ін. Хімічна енергія нагромаджується і витрачається також і у біохімічних процесах, які відбуваються у рослинних клітинах. Біохімічні процеси лежать в основі багатьох важливих виробництв, таких як дріжджове, хлібопекарське, спиртове, пивоварне, виробництво чаю, тютюну, ацетону, оцтової, лимонної, молочної та олійної кислот.
Світлову енергію дедалі частіше використовують у хімічній технології для проведення фотохімічних процесів: синтезу хлороводню, галогенування і сульфування органічних сполук. Світлова енергія перетворюється в електричну у фотоелементах, які широко використовуються у промисловості для автоматизації і механізації технологічних процесів, контролю виробництва, для сигналізації і регулювання технологічних процесів, при збагаченні сировини та ін.
На хімічних підприємствах велике значення має вторинна енергія у вигляді відходів або побічних продуктів виробництва – гарячих газів, води, рідин, пари тощо, які широко використовуються для здійснення технологічних процесів і для побутових потреб.
Промислові ресурси енергії закладені у запасах вугілля, нафти, природних газів, торфу, сланців, деревини, гідроенергії, частково енергії вітру і сонячної енергії. Світові запаси основних видів палива становлять приблизно 6000 млрд. т умовного палива, з якого 91,8 % припадає на кам'яне вугілля і лігніни, 3,1 % – на нафту і 1,9 % – на природні гази. У світових запасах урану і торію міститься енергія, яка у десятки разів перевищує потенціальну енергію відомих запасів вугілля, нафти і природних газів разом взятих. Та хоч які великі запаси енергетичних ресурсів у нашій країні, треба на кожному кроці запроваджувати сувору економію енергії і раціональне використання її на виробництві. Боротьба з усіма видами понаднормових витрат енергії і нераціонального її використання є важливим завданням хімічної технології.
У майбутньому, можливо, набудуть великого значення такі джерела енергії, як енергія вітру, сонця, теплоти земної кори, припливів і відпливів.
Раціональне використання енергії. В енергомістких хімічних виробництвах витрати енергії впливають на техніко-економічні показники процесів. Критерієм економічного використання її є "коефіцієнт використання енергії". Коефіцієнтом, використання енергії E називається відношення кількості енергії, яку необхідно витратити теоретично на добування одиниці (маси або об'єму) продукції Wm до кількості практично витраченої енергії Wпp:
![]() .
.
Ступінь використання теплоти у хіміко-технологічному процесі виражається тепловим к. к. д. Т, під яким розуміють відношення кількості теплоти, використаної на здійснення основних хімічних реакцій Qт, до загальної кількості теплоти, витраченої на процес Qnp.
![]() .
.
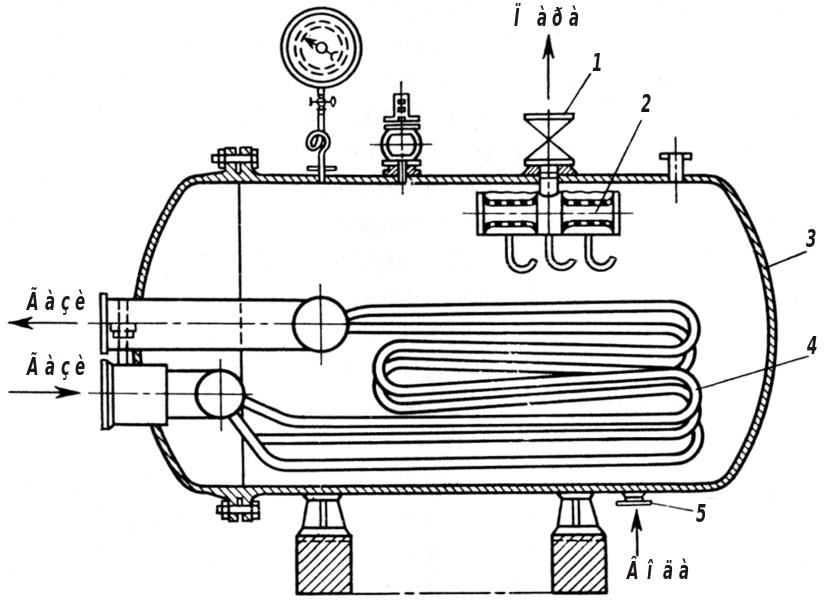
Рис. 8.5. Котел-утилізатор: 1 – вентиль; 2 – вологовіддільник; 3 – корпус; 4 – труби, через які проходять гарячі гази; 5 – штуцер для введення води
Щоб визначити тепловий к. к. д. апарата, треба скласти тепловий баланс. Для використання теплоти газоподібними продуктами реакцій у спеціальних теплообмінниках – рекуператорах нагрівають реагенти, що надходять в апарат. Теплоту газоподібних продуктів використовують також в апаратах-регенераторах енергії для нагрівання газів-теплоносіїв або для виробництва пари у котлах-утилізаторах, схема якого наведена на рис. 8.5. Гарячі гази рухаються по трубах, розміщених у корпусі апарата; у міжтрубному просторі знаходиться вода, яка подається через штуцер. Водяна пара, що утворюється у котлі, виводиться через вентиль. Теплоту продуктів відходу на хімічних заводах використовують для сушіння, випарювання, дистиляції та нагрівання води для потреб заводу або населення.
Питання до розділу 8
1. Загальна класифікація сировини.
2. Що означає "комплексне використання сировини"?
3. На які групи поділяють мінеральну сировину?
4. Які основні елементи входять до складу земної кори?
5. Що називають збагаченням руди?
6. Що називають виходом концентрату, ступенем вилучення і ступенем збагачення?
7. Які основні операції попередньої обробки сировини?
8. Які способи використовують при збагаченні твердої сировини?
9. На чому ґрунтуються хімічні способи збагачення сировини?
10. Яка різниця між повітряними, електромагнітними і електростатичними сепараторами?
11. На чому ґрунтується гравітаційне збагачення руди?
12. Що таке флотація?
13. Які засоби використовують для підвищення ефективності флотації?
14. Який принцип дії флотаційної машини?
15. Які ще є методи збагачення руд?
16. Які переваги і недоліки сировини рослинного і тваринного походження?
17. Які види енергії використовують у хімічній промисловості?
18. Що таке вторинна енергія? Її використання.
19. Що називають коефіцієнтом використання енергії?
20. Що називають ступенем використання теплоти у хіміко-технологічному процесі?
