- •Частина і. Теоретичні основи хімічної технології
- •1.1. Предмет і завдання хімічної технології
- •1.2. Класифікація хімічних виробництв
- •7. Промисловість реактивів і особливо чистих речовин.
- •1.3. Хімічна технологія як наука
- •1.4. Значення хімічної технології, її міжгалузевий характер
- •1.5. Етапи розвитку хімічних виробництв і хімічної технології
- •1.6. Основні напрямки і перспективи розвитку хімічної технології і техніки
- •2.1. Класифікація технологічних процесів
- •2.2. Схеми руху матеріальних та енергетичних потоків
- •2.3. Хіміко-технологічні розрахунки. Матеріальні та енергетичні баланси
- •2.4. Інтенсивність та швидкість процесів
- •2.5. Продуктивність праці
- •2.6. Роль фізико-хімічних закономірностей у хімічній технології
- •2.7. Економічні вимоги, що ставляться до раціонального виробництва
- •2.8. Науково-дослідна, експериментальна і проектна робота в хімічній промисловості
- •3.1. Система процесів у хімічному реакторі
- •3.2. Класифікація хтп
- •3.3. Основні показники ефективності хтп
- •3.4. Термодинамічні основи хтп
- •4.1. Класифікація хімічних реакторів
- •4.2. Режим руху і перемішування реагентів
- •5.1. Гомогенні процеси у газовій фазі
- •5.2. Гомогенні процеси у рідкій фазі
- •5.3. Вплив концентрації реагуючих речовин, тиску, температури, переміщування на швидкість гомогенних реакцій
- •5.4. Реактори для гомогенних процесів
- •6.1. Рівновага і швидкість гетерогенних процесів
- •6.2. Процеси і реактори у системі газ-рідина (г–р)
- •6.3. Процеси і реактори у системі газ-тверде тіло (г–т)
- •7.1. Суть і види каталізу
- •7.2. Гомогенний каталіз
- •7.3. Гетерогенний каталіз
- •7.4. Властивості твердих каталізаторів і їх приготування
- •7.5. Каталітичні реактори
- •8.1. Мінеральна сировина
- •8.2. Добування і підготовка сировини до переробки
- •8.3. Сировина рослинного і тваринного походження
- •8.4. Енергія у хімічному виробництві
- •Частина II. Промислові хімічні виробництва
- •9.1. Зв'язаний азот та його значення
- •9.2. Методи зв'язування атмосферного азоту
- •9.3. Отримання та очищення азотоводневої суміші
- •9.4. Фізико-хімічні основи процесу синтезу амоніаку
- •9.5. Промислові способи виробництва синтетичного амоніаку
- •10.1. Загальна характеристика нітратної кислоти
- •10.2. Фізико-хімічні основи виробництва нітратної кислоти
- •10.3. Оптимальні умови процесу окиснення амоніаку
- •10.4. Переробка нітрозних газів на розбавлену нітратну кислоту
- •10.5. Виробництво розбавленої нітратної кислоти
- •11.1. Основні властивості та застосування сульфатної кислоти
- •11.2. Сировинна база сульфатно-кислотного виробництва
- •11.3. Виробництво сульфітного газу
- •11.4. Контактний спосіб виробництва сульфатної кислоти з колчедану
- •11.5. Виробництво сульфатної кислоти з сірки та сірководню
- •12.1. Загальна характеристика содових продуктів
- •12.2. Фізико-хімічні основи виробництва кальцинованої соди
- •12.3. Принципова схема виробництва кальцинованої соди
- •12.4. Виробництво каустичної соди
- •13.1. Основні закони електрохімії
- •13.2. Електроліз водних розчинів. Виробництво їдкого натру і хлору
- •13.3. Переробка електролітичного хлору. Виробництво хлоридної кислоти
- •14.1. Основні електротермічні закони
- •14.2. Виробництво кальцію карбіду
- •14.3. Виробництво кальцію ціанаміду
- •14.4. Виробництво фосфору і фосфатної кислоти
- •15.1. Піроліз деревини
- •15.2. Виробництво целюлози
- •15.3. Гідроліз деревини
- •15.4. Виробництво каніфолі і терпентину
- •Тушницький Орест Петрович загальна хімічна технологія
- •79000, М. Львів, вул. М. Коперника, 18
- •79057, М. Львів, вул. Генерала Чупринки, 103
6.1. Рівновага і швидкість гетерогенних процесів
Рівновага і швидкість гетерогенних процесів є функцією багатьох змінних і тому кількісна оцінка гетерогенних процесів досить складна. Для спрощення процес розглядають постадійно. Визначають найбільш повільну (лімітуючу) стадію (дифузія або хімічна реакція) і, описавши її математично, описують тим самим процес у цілому. Такий підхід виправданий, якщо швидкості дифузії і хімічного перетворення дуже різні. В іншому випадку приходиться враховувати обидва чинники і кінетичне рівняння дуже ускладнюється.
Рівновага у гетерогенних хімічних процесах, як і у гомогенних, визначає вихід готового продукту. На гетерогенну рівновагу впливає температура, тиск, концентрація реагуючих речовин і т. ін. Рівновага фаз визначається правилом фаз.
Для визначення фазової рівноваги у системі рідина-тверда речовина (Р – Т) застосовують діаграми фазового стану, в яких одну з властивостей системи визначають як функцію складу за дослідними даними. Аналіз діаграм фазового стану дає змогу визначити рівноважний вихід і умови проведення процесу.
Швидкість гетерогенних ХТП при ідеальному витісненні і неповному перемішуванні виражається рівнянням
![]() .
.
При режимах, близьких до повного змішування,
![]() ,
,
де: Сk – кінцева рушійна сила процесу; k – коефіцієнт масопередачі; F – площа поверхні розділу фаз; G – маса продукту реакції.
Для процесів у дифузійній області збільшення коефіцієнта масопередачі k досягається, головним чином, збільшенням турбулентності взаємодіючих фаз, за рахунок чого постійно поновлюється міжфазна поверхня. При переході реакції у кінетичну область турбулізація негативно впливає на ефективність роботи реактора.
Збільшення рушійної сили гетерогенного процесу досягається підвищенням концентрації реагуючих речовин, застосуванням оптимальних температур і тиску та ін. Збільшення міжфазної поверхні здійснюється вдосконаленням конструкції реакторів і застосуванням інтенсивного гідродинамічного режиму.
Кінетика гетерогенних процесів, конструкція реакторів і методи їх розрахунку, шляхи інтенсифікації процесів визначаються перш за все фазовим станом взаємодіючих реагентів і продуктів реакції. Тому нижче розглянуто процеси і реактори для основних видів двохфазних гетерогенних систем, які найбільше застосовуються у хімічних виробництвах.
6.2. Процеси і реактори у системі газ-рідина (г–р)
Процеси з участю рідких і газоподібних реагентів широко застосовуються у хімічній промисловості. До них належать абсорбція і десорбція газів, випаровування і конденсація парів, дистиляція і ректифікація рідких сумішей, піроліз рідин, полімеризація у газовій фазі з утворенням рідких полімерів і т.д. Для системи Г–Р особливо характерні абсорбційно-десорбційні процеси.
Абсорбція – процес поглинання газів рідинами з утворенням розчинів. Якщо абсорбція супроводжується хімічною реакцією, вона називається хемосорбцією. Сорбційні процеси широко розповсюджені у хімічній технології і є складовою частиною виробництв хлоридної, сульфатної, нітратної, фосфатної і інших кислот, амоніаку, соди, вони застосовуються для поглинання компонентів коксового газу, газів нафтопереробки і піролізу речовини, при очистках викидних газів, у технології органічного синтезу і т. ін.
Десорбція – процес, обернений абсорбції – полягає у виділенні з рідини розчинених у ній газів. На практиці десорбцію називають відгонкою і здійснюють нагріванням рідини і пропусканням через неї інертного газу або водяної пари. Виділення газоподібного компоненту з розчину відбувається завдяки зменшенню парціального тиску десорбованої речовини у газовому потоці. Десорбція використовується майже так часто, як абсорбція, оскільки сорбційні процеси комбінують: спочатку абсорбують потрібний компонент, а потім його десорбують у концентрованому вигляді. Саме таким способом у промисловості здійснюють виділення бензолу і його гомологів з коксового газу.
Рівновага у системі Г–Р, як і для інших гетерогенних систем, визначається з допомогою правила фаз, закону розподілу і константи рівноваги хімічних реакцій у рідкій фазі.
При розрахунку абсорбційної (десорбційної) рівноваги виражають склад рідини і газу у відносних молярних концентраціях і тоді
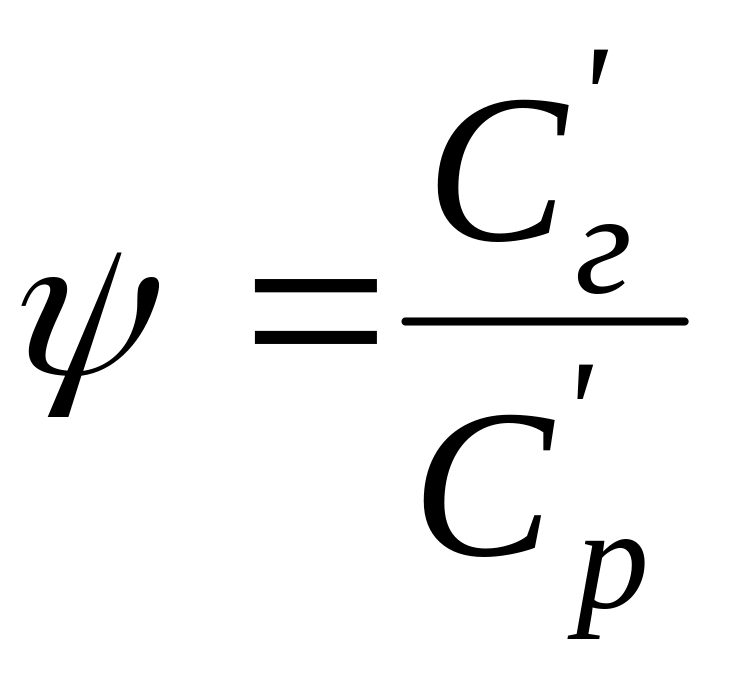 ,
,
де:
![]() – відносний молярний склад газу у
стані рівноваги;
– відносний молярний склад газу у
стані рівноваги;
![]() – відносний молярний склад рідини;
– відносний молярний склад рідини;
![]() –
коефіцієнт розподілу.
–
коефіцієнт розподілу.
Для хемосорбційних
процесів рівновага характерна участю
константи рівноваги хімічної реакції.
Якщо у рідкій фазі відбувається зворотна
реакція між абсорбованою речовиною А
і поглинаючою речовиною В з утворенням
продукту D (аА + bВ
dD) і система підпорядковується
закону Генрі, то константу фазової
рівноваги
![]() можна визначити за формулою
можна визначити за формулою
![]() ,
,
де: Кс – константа рівноваги хімічної реакції; Сb – концентрація поглинаючої речовини (активної речовини поглинача).
Ступінь абсорбції – основний технологічний показник, який характеризує і швидкість процесів у системі Г–Р. Фактично ступінь абсорбції рівнозначний виходу продукту X. Для абсорбції є відношення кількості поглиненої речовини до рівноважної
![]() ,
,
де: Сгп і Сгк
– концентрація речовини у газі, який
відповідно надходить у реактор і виходить
з нього;
![]() – концентрація речовини у газі, рівноважна
з середньоарифметичною концентрацією
її у рідині.
– концентрація речовини у газі, рівноважна
з середньоарифметичною концентрацією
її у рідині.
При абсорбції рівновагу можна змістити у бік збільшення розчинності газу, зменшуючи температуру, збільшуючи початкову концентрацію речовини, яка поглинається Сгп або загальний тиск Р, що також збільшує Сгп. Для пониження температури охолоджують вихідні газ і рідину, відводять теплоту абсорбції з допомогою внутрішніх або зовнішніх теплообмінників. При десорбції газів і рідин рівновагу зміщують протилежними способами, тобто підвищенням температури і пониженням тиску; для цього обігрівають десорбер з допомогою теплообмінників або гострої пари.
Швидкість процесів у системі Г–Р розглянемо на прикладі процесів абсорбції і десорбції. Для дифузійної області загальні кінетичні рівняння мають вигляд
U = KгF(P – Р*) або U = KpF(C* – С),
де: Р і Р* – парціальний тиск речовини, яка поглинається, фактичний і рівноважний; С і С* – концентрація розчиненої речовини у рідині фактична і рівноважна з газом; Кг і Кр – коефіцієнти масопередачі, виражені в одиницях парціального тиску або концентрації рідини; F – площа перерізу реактора або об'єм рідкої фази (поверхня розділу фаз).
Реакція у рідкій фазі понижує концентрацію речовини, яка поглинається у рідині, тобто збільшує рушійну силу і швидкість процесу порівняно з фізичною абсорбцією.
Реактори для гетерогенних перетворень у системі Г–Р. Такі реактори є типовою хімічною апаратурою, в якій на хімічних заводах здійснюють як фізичні процеси (випаровування, дистиляцію і ректифікацію, промивання газів), так і хемосорбційні процеси (у виробництві кислот, соди, органічних речовин). Основні типи реакторів для взаємодії між рідинами і газами показані на рис. 6.1.
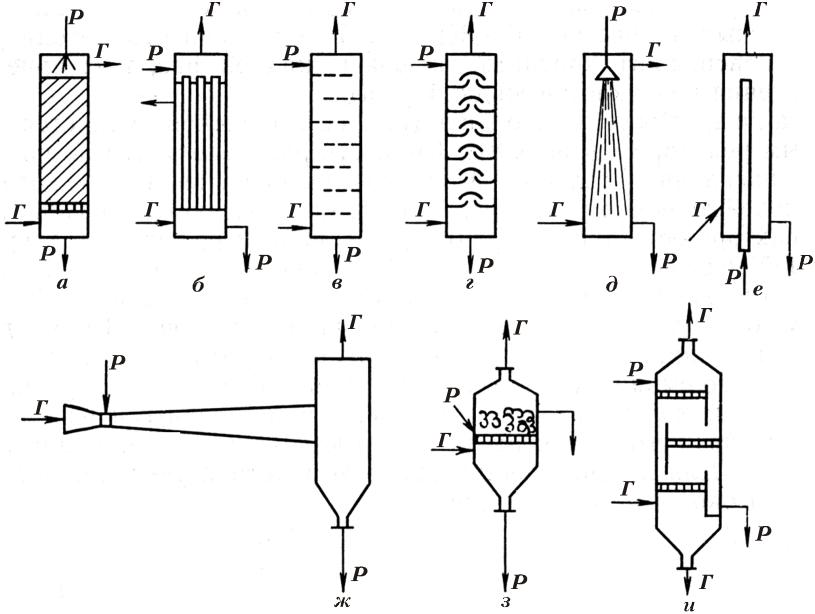
Рис. 6.1. Типи реакторів для гетерогенних процесів у системі Г–Р: а, б – колони плівкові (а – з насадкою, б – трубчаста); в, г – колони барботажні (в – з ситоподібними тарілками, г – з ковпачковими тарілками); д, е – колонні реактори з розбризкуванням рідини (д – пустотілий, е – циклонний); ж – реактор з розпилюванням рідини; з, й – пінні реактори; Г – газ; Р – рідина
Основне завдання конструктивного оформлення реакторів – збільшення поверхні контакту газової і рідкої фази. Це досягається в основному збільшенням поверхні рідкої фази.
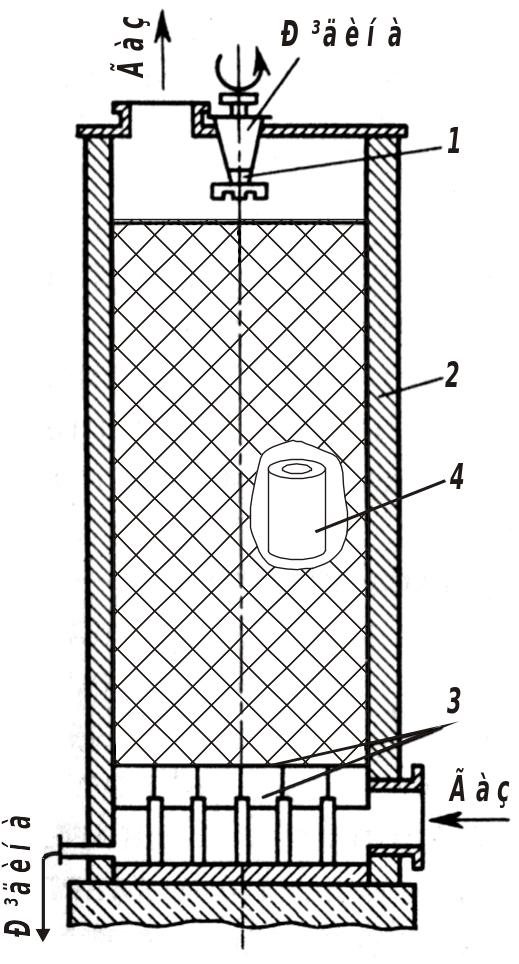
Колона з насадкою є плівковим реактором (рис. 6.2).
Рідина розподіляється по поверхні насадки тонкою плівкою і стікає вниз назустріч газу. Реактор складається з колони, колосникової решітки, яка підтримує насадку, самої насадки і зрошувального пристрою. Насадка повинна мати велику питому поверхню, великий вільний об'єм, бути легкою, механічно міцною і дешевою. Крім того, насадка повинна чинити мінімальний опір потокові газу і добре змочуватися рідиною. Застосовуються насадки різної форми: кільця зі сталі або кераміки з однаковими розмірами висоти і діаметра (hd=100100 або 5050 або 2525 мм). Для інтенсифікації роботи реактора збільшують швидкості потоків газу і рідини.
Колони з насадкою – найбільш поширені реактори для абсорбційно-десорбційних процесів, їх широко застосовують у виробництві сульфатної, нітратної кислот, при переробці коксового газу, у ряді виробництв органічного синтезу і т. ін.
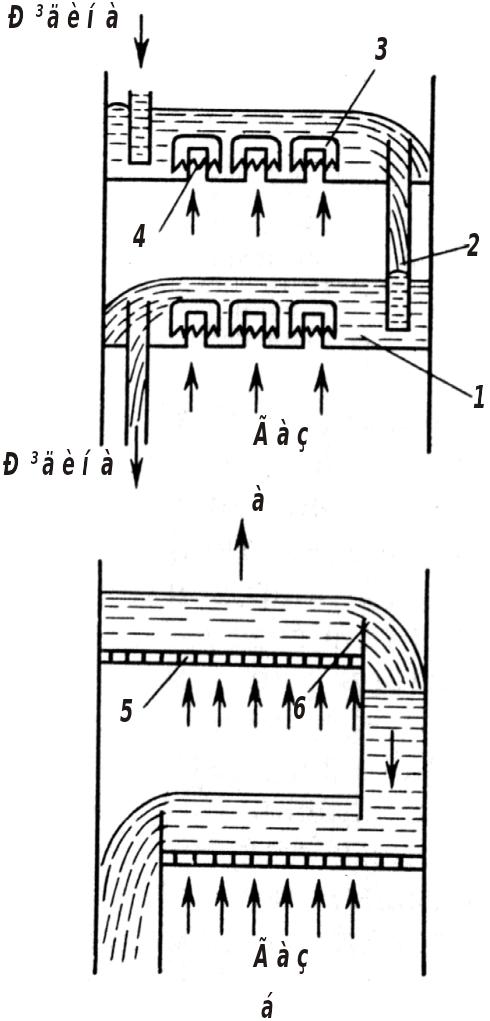
Барботажний реактор (рис. 6.3) може мати від однієї до декількох десятків ковпачкових або ситоподібних тарілок залежно від характеру процесу селективності. На кожній тарілці відбувається диспергування газу в об'ємі рідини шляхом барботажу, тобто пропусканням бульбашок газу через шар рідини, яка протікає по тарілці. Барботажні реактори також широко застосовуються у хімічній технології при концентруванні кислот у виробництві соди, при переробці нафти, для процесів дистиляції і ректифікації, у технології органічних речовин. Ці реактори конструктивно більш складні, ніж колони з насадкою, їх експлуатація пов'язана з великими затратами, але вони працюють більш інтенсивно, забезпечують високий ступінь розділення рідких сумішей.
Рис. 6.2. Колона з насадкою: 1 – корпус; 2 – розбризкувач рідини; 3 – колосникова решітка; 4 – насадка (кільця) |
Рис. 6.3. Схема пристрою барботажного реактора з внутрішнім переливом (а) і ситоподібними тарілками (б): 1 – ковпачкова тарілка; 2 – переливна труба; 3 – ковпачок; 4 – патрубок для газу; 5 – ситоподібна тарілка (решітка); 6 – зливний поріг |
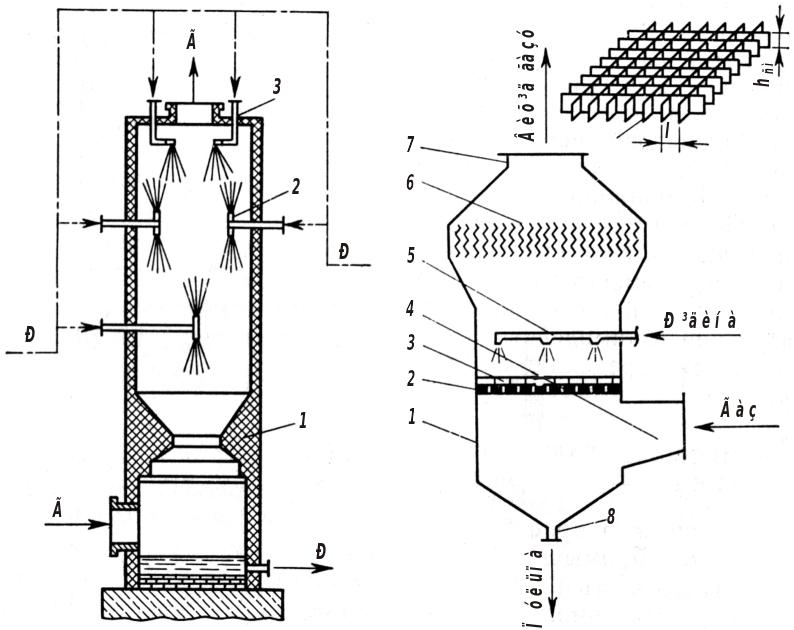
Порожниста колона з розбризкуванням рідини (рис. 6.4). У реакторах такого типу розвиток поверхні рідкої фази відбувається її диспергуванням, тобто, розбризкуванням, розпиленням пневматичним або механічним шляхом в об'ємі чи потоці газу. Такий реактор застосовується, наприклад, у виробництві сульфатної кислоти.
Пінні апарати (рис. 6.5) за інтенсивністю роботи значно перевершують барботажні при менших витратах енергії. У пінних апаратах потік газу проходить знизу вгору через решітку з такою швидкістю, при якій сили тертя газу об рідину врівноважують її масу. Внаслідок утворюється киплячий шар рухомої піни у вигляді швидко рухомих плівок, крапель, струменів рідини, тісно перемішаних з бульбашками і струменями газу. Швидкість газу у перетині апарата може складати до 4,5 м/с (в 2-4 рази більше, ніж у барботажних колонах). При більш високих швидкостях газу піна руйнується і виноситься з газом. При швидкості газу менш ніж 1 м/с рідина протікає через решітку і піна не утворюється. Для стабілізації піни використовують решітку з вертикально розташованих перехресних пластин. Стабілізатор забезпечує рівномірну висоту піни і рівномірну швидкість газу по перетину апарата.
Для абсорбційно-десорбційних процесів застосовують головним чином багатополичкові пінні реактори з переливними трубами. Число полиць визначається заданими ККД і селективністю процесу.
|
|
Рис. 6.4. Порожниста колона з розбризкуванням рідини: 1 – корпус; 2 – подвійний розпилювач рідини; 3 – одинарний розпилювач рідини |
Рис. 6.5. Пінний апарат: 1 – корпус; 2 – решітка; 3 – стабілізатор піни; 4 – вхід газу; 5 – подача рідини; 6 – краплевловлювач; 7 – вихід газу; 8 – вихід пульпи |