
- •Лекция №1. Основные положения молекулярно – кинетической теории. Масса и размеры молекул. Основные положения мкт.
- •Масса молекул.
- •Лекция № 2. Идеальный газ. Основное уравнение мкт.
- •Идеальный газ.
- •Лекция № 4. Уравнение Менделеева-Клапейрона. Общий газовый закон и его следствия.
- •Лекция № 5. Внутренняя энергия и способы её изменения.
- •Способы изменения внутренней энергии.
- •Лекция № 6. Первый закон термодинамики и его применение к изопроцессам. Адиабатический процесс.
- •Первый закон термодинамики.
- •Применение первого закона термодинамики к изопроцессам.
- •Лекция № 7. Принцип действия тепловой машины. Второй закон термодинамики.
- •Лекция № 8. Фазовые переходы. Испарение и насыщенный пар.
- •Насыщенный пар и его свойства.
- •Лекция № 9. Влажность воздуха. Взаимодействие атмосферы и гидросферы.
- •Лекция № 10. Кипение жидкости. Критическое состояние вещества.
- •Изотерма пара.
- •Сжижение газов.
- •Лекция № 11. Свойства жидкостей.
- •Текучесть
- •Поверхностное натяжение.
- •Смачивание и капиллярные явления.
- •Лекция № 12. Твёрдые тела. Виды кристаллических структур.
- •Виды кристаллических решёток.
- •Лекция № 13. Электрический заряд. Закон кулона. Электризация тел.
- •Закон Кулона.
- •Принцип суперпозиции сил.
- •Лекция № 14. Электрическое поле. Напряжённость электрического поля.
- •Принцип суперпозиции полей.
- •Напряжённость электрического поля заряженного шара.
- •Напряженность электрического поля бесконечной плоскости.
- •Силовые линии электрического поля.
- •Лекция № 15. Работа электрического поля при перемещении заряда.
- •Лекция № 16. Проводники и диэлектрики в электрическом поле. Проводники.
- •Диэлектрики.
- •Лекция № 17. Электроёмкость проводника. Конденсатор. Электроёмкость проводника.
- •Конденсатор. Электроёмкость конденсатора.
- •Лекция № 18. Способы соединения конденсаторов. Энергия электрического поля конденсатора.
- •Энергия заряженного конденсатора.
- •Лекция № 19. Постоянный электрический ток.
- •Лекция № 20. Закон Ома для участка цепи. Сопротивление.
- •Лекция № 21. Способы соединения проводников. Работа и мощность тока. Способы соединения проводников.
- •Работа электрического тока.
- •Мощность тока.
- •Соединение источников электрической энергии в батареи.
- •Лекция №23. Ток в электролитах. Электролиз и его законы.
- •Ток в электролитах
- •Законы Фарадея
- •Лекция № 24 Электрический ток в газах.
- •Основные виды газового разряда.
- •Лекция №25. Ток в вакууме. Электровакуумные приборы.
- •Лекция № 26 Ток в полупроводниках. Примесная проводимость.
- •Лекция №27. Электронно-дырочный переход и его свойства”.
Лекция № 4. Уравнение Менделеева-Клапейрона. Общий газовый закон и его следствия.
Поведение любой макроскопической системы можно рассматривать при помощи физических величин относящихся ко всей системе в целом. Эти величины называют макропараметрами. Для идеального газа к макропараметрам относят: давление Р, объём V, температуру Т, плотность , массу m.
Для данной массы газа m три параметра Р,V и Т полностью характеризуют его состояние. Состояние идеального газа называют равновесным, если все три его параметра не изменяются в течение длительного интервала времени. Соотношение, связывающее между собой параметры равновесного состояния идеального газа, называется уравнением состояния газа. Уравнение состояния было получено в 1875 г. Д.И.Менделеевым как результат обобщения экспериментальных законов. Мы же получим этот закон, используя основное уравнение молекулярно-кинетической теории идеального газа (уравнение Клаузиуса)
![]() , (4.1)
, (4.1)
где n – концентрация молекул. По определению – это число молекул в единице объёма n=N/V, число молекул газа равно N = mNA/μ, поэтому уравнение (4.1) примет вид
![]() (4.2)
(4.2)
В уравнение (4.2) произведение двух постоянных величин Авогадро и Больцмана является постоянной величиной. Её называют универсальной газовой постоянной R.
![]() (4.3)
(4.3)
Окончательно уравнение (4.2) запишем в следующем виде
![]() . (4.4)
. (4.4)
Изменение состояния газа, сопровождается изменением всех или некоторых его параметров. В газе возникает некоторый процесс, в результате которого он переходит из одного состояния (состояние 1) в другое (состояние 2). Процесс называется равновесным, если он состоит из ряда непрерывно следующих друг за другом равновесных состояний (для любого малого интервала времени t – Р,V,Т не изменяются). Все процессы, которые нам придётся рассматривать, являются равновесными. Соотношение между параметрами газа в начале процесса (Р1,V1,Т1) и в его конце (Р2,V2,Т2) называют газовым законом. Из уравнения (4.4) для данной массы газа m легко можно получить общий газовый закон. Действительно, если m=const, то
![]() ,
или (4.6)
,
или (4.6)
![]() (4.7)
(4.7)
где а – некоторое постоянное число.
Рассмотрим некоторые следствия общего газового закона.
Закон Бойля-Мариотта. Газ переводится из состояния 1 (Р1,V1,Т) в состояние 2 (Р2,V2,Т) при постоянной температуре Т1. Процесс, протекающий при постоянной температуре (Т=const) называется изотермическим. Такой процесс можно наблюдать при очень медленном расширении или сжатии газа внутри цилиндра, закрытого подвижным поршнем. Поршень должен перемещаться при сжатии медленно для того, чтобы количество теплоты успевало отводиться из-под поршня, и температура газа не изменялась Т=Т1=Т2. Для изотермического процесса уравнение (4.6) имеет вид
![]() . (4.8)
. (4.8)
П оследнее
соотношение выражает закон Бойля-Мариотта.
С увеличением объёма давление данной
массы газа уменьшается.
Эта обратно пропорциональная зависимость
изображена на рисунке 4.1. Изображённые
кривые называются изотермами.
Каждой изотерме соответствует своя
температура. Чем
дальше изотерма
(или точка) удалена
от начала координат тем выше её
температура.
Действительно общий газовый закон с
помощью уравнение (4.6) может быть записан
в виде РV=aT,
тогда для данного объёма V1
большему
давлению соответствует большая
температура. Поэтому если Р2>Р1,
то и Т2>Т1.
оследнее
соотношение выражает закон Бойля-Мариотта.
С увеличением объёма давление данной
массы газа уменьшается.
Эта обратно пропорциональная зависимость
изображена на рисунке 4.1. Изображённые
кривые называются изотермами.
Каждой изотерме соответствует своя
температура. Чем
дальше изотерма
(или точка) удалена
от начала координат тем выше её
температура.
Действительно общий газовый закон с
помощью уравнение (4.6) может быть записан
в виде РV=aT,
тогда для данного объёма V1
большему
давлению соответствует большая
температура. Поэтому если Р2>Р1,
то и Т2>Т1.
З
 акон
Шарля.
Закон
Шарля соответствует изохорическому
процессу. Процесс называют изохорическим,
если он происходит при постоянной массе
m=const
и неизменном объёме V=const.
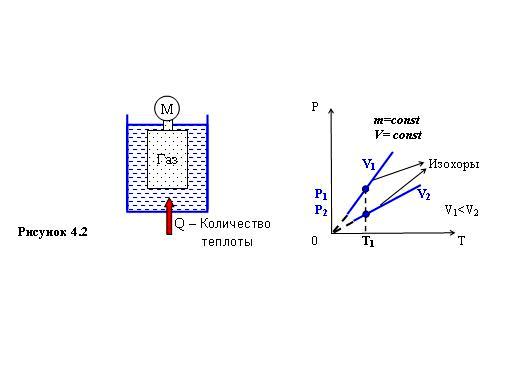
Этот процесс был изучен французским
физиком Ж. Шарлем в 1787 г. Схема опыта
изображена на рисунке 4.2. Герметичный
сосуд, заполненный газом, соединялся
с манометром и опускался в калориметр,
заполненный в свою очередь водой. Воду
постепенно нагревали, давление измеряли
при помощи манометра, а её температуру
– обычным термометром. В ходе опыта
была установлена зависимость Р(T)
изображённая на рисунке 4.2 – давление
идеального газа при постоянной массе
и постоянном объёме прямо пропорционально
величине его температуры.
Прямолинейные участки, состоящие из
множества точек равного объёма,
называются изохорами.
Для данной массы газа каждому значению
объёма соответствует своя изохора. На
рисунке 4.2 изохоры построены для объёмов
V1
и V2.
Математическая форма записи этого
закона легко получается из уравнения
(4.6). Так как V1
= V2
= V,
то
акон
Шарля.
Закон
Шарля соответствует изохорическому
процессу. Процесс называют изохорическим,
если он происходит при постоянной массе
m=const
и неизменном объёме V=const.
Этот процесс был изучен французским
физиком Ж. Шарлем в 1787 г. Схема опыта
изображена на рисунке 4.2. Герметичный
сосуд, заполненный газом, соединялся
с манометром и опускался в калориметр,
заполненный в свою очередь водой. Воду
постепенно нагревали, давление измеряли
при помощи манометра, а её температуру
– обычным термометром. В ходе опыта
была установлена зависимость Р(T)
изображённая на рисунке 4.2 – давление
идеального газа при постоянной массе
и постоянном объёме прямо пропорционально
величине его температуры.
Прямолинейные участки, состоящие из
множества точек равного объёма,
называются изохорами.
Для данной массы газа каждому значению
объёма соответствует своя изохора. На
рисунке 4.2 изохоры построены для объёмов
V1
и V2.
Математическая форма записи этого
закона легко получается из уравнения
(4.6). Так как V1
= V2
= V,
то
![]()
![]() . (4.9)
. (4.9)
Последнее уравнение и называется законом Шарля. Легко доказать, что чем ближе изохора (или точка) расположена к оси температур тем больший объём занимает данный газ. Действительно общий газовый закон с помощью уравнения (4.6) может быть записан в виде Р=aT/V, т.е. для данной температуры Т1 на диаграмме РТ рисунка 4.2 большему давлению Р1 соответствует меньший объём V1. Иными словами, так как Р2<Р1, то и V2>V1.
Закон Гей-Люссака. Закон Гей-Люссака соответствует изобарическому процессу. Процесс называют изобарическим, если он происходит при постоянной массе m=const и неизменном давлении Р=const. Этот закон был открыт в 1802 г. французским учёным Ж. Гей-Люссаком и носит его имя. Схема опыта изображена на рисунке 4.3. Герметичный сосуд, заполненный газом, соединялся с трубкой с каплей ртути 1 и опускался в калориметр, заполненный водой. Воду постепенно нагревали, объём газа увеличивался и капля ртути смещалась вправо. По величине её смещения определялся объём газа, температуру измеряли обычным термометром. Зависимость V(T) установленная в ходе опыта изображена на рисунке 4.3 – объём идеального газа при постоянной массе и постоянном давлении прямо пропорционален величине его температуры. Прямолинейные участки, состоящие из множества точек равного давления, называются изобарами. На рисунке 4.3 изобары построены для давлений Р1 и Р2. Математическую форма записи этого закона имеет вид
![]() . (4.10)
. (4.10)
Ч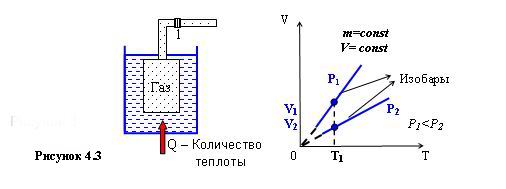 ем
ближе изобара
(или точка) расположена
к оси температур, тем большее давление
соответствует данному газу.
Общий газовый закон с помощью уравнения
(4.6) может быть записан в виде Р=aT/V,
тогда для данной температуры Т1
большему
давлению соответствует меньший объём.
Следовательно если V2<V1,
то Р2>Р1.
ем
ближе изобара
(или точка) расположена
к оси температур, тем большее давление
соответствует данному газу.
Общий газовый закон с помощью уравнения
(4.6) может быть записан в виде Р=aT/V,
тогда для данной температуры Т1
большему
давлению соответствует меньший объём.
Следовательно если V2<V1,
то Р2>Р1.
