
- •Лекция №1. Основные положения молекулярно – кинетической теории. Масса и размеры молекул. Основные положения мкт.
- •Масса молекул.
- •Лекция № 2. Идеальный газ. Основное уравнение мкт.
- •Идеальный газ.
- •Лекция № 4. Уравнение Менделеева-Клапейрона. Общий газовый закон и его следствия.
- •Лекция № 5. Внутренняя энергия и способы её изменения.
- •Способы изменения внутренней энергии.
- •Лекция № 6. Первый закон термодинамики и его применение к изопроцессам. Адиабатический процесс.
- •Первый закон термодинамики.
- •Применение первого закона термодинамики к изопроцессам.
- •Лекция № 7. Принцип действия тепловой машины. Второй закон термодинамики.
- •Лекция № 8. Фазовые переходы. Испарение и насыщенный пар.
- •Насыщенный пар и его свойства.
- •Лекция № 9. Влажность воздуха. Взаимодействие атмосферы и гидросферы.
- •Лекция № 10. Кипение жидкости. Критическое состояние вещества.
- •Изотерма пара.
- •Сжижение газов.
- •Лекция № 11. Свойства жидкостей.
- •Текучесть
- •Поверхностное натяжение.
- •Смачивание и капиллярные явления.
- •Лекция № 12. Твёрдые тела. Виды кристаллических структур.
- •Виды кристаллических решёток.
- •Лекция № 13. Электрический заряд. Закон кулона. Электризация тел.
- •Закон Кулона.
- •Принцип суперпозиции сил.
- •Лекция № 14. Электрическое поле. Напряжённость электрического поля.
- •Принцип суперпозиции полей.
- •Напряжённость электрического поля заряженного шара.
- •Напряженность электрического поля бесконечной плоскости.
- •Силовые линии электрического поля.
- •Лекция № 15. Работа электрического поля при перемещении заряда.
- •Лекция № 16. Проводники и диэлектрики в электрическом поле. Проводники.
- •Диэлектрики.
- •Лекция № 17. Электроёмкость проводника. Конденсатор. Электроёмкость проводника.
- •Конденсатор. Электроёмкость конденсатора.
- •Лекция № 18. Способы соединения конденсаторов. Энергия электрического поля конденсатора.
- •Энергия заряженного конденсатора.
- •Лекция № 19. Постоянный электрический ток.
- •Лекция № 20. Закон Ома для участка цепи. Сопротивление.
- •Лекция № 21. Способы соединения проводников. Работа и мощность тока. Способы соединения проводников.
- •Работа электрического тока.
- •Мощность тока.
- •Соединение источников электрической энергии в батареи.
- •Лекция №23. Ток в электролитах. Электролиз и его законы.
- •Ток в электролитах
- •Законы Фарадея
- •Лекция № 24 Электрический ток в газах.
- •Основные виды газового разряда.
- •Лекция №25. Ток в вакууме. Электровакуумные приборы.
- •Лекция № 26 Ток в полупроводниках. Примесная проводимость.
- •Лекция №27. Электронно-дырочный переход и его свойства”.
Виды кристаллических решёток.
С точки зрения сил, действующих между частицами, образующими кристаллы их можно условно разбить на четыре типа: ионные, атомные, молекулярные и металлические кристаллы.
И
 онная
решётка.
Её образуют большинство неорганических
соединений, например, соли или оксиды
различных химических элементов. В узлах
пространственной решётки этих кристаллов
размещаются поочерёдно ионы противоположных
знаков. Механизм образования ионного
кристалла можно объяснить на примере
поваренной соли NaCl.
Атом натрия легко теряет один электрон,
который присоединяется к атому хлора.
Так возникают два иона с противоположными
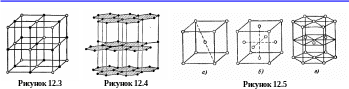
по знаку зарядами. На рисунке 12.3 белыми
кружками обозначены несущие положительный
заряд ионы натрия, чёрными кружками –
отрицательные ионы хлора. Образовавшиеся
ионы удерживаются в узлах решётки
электростатическими силами. Ионные
кристаллы хорошо растворяются в воде,
обладают высокой механической прочностью.
В ионной решётке нельзя выделить
отдельные молекулы: кристалл представляет
собой как бы одну гигантскую молекулу.
онная
решётка.
Её образуют большинство неорганических
соединений, например, соли или оксиды
различных химических элементов. В узлах
пространственной решётки этих кристаллов
размещаются поочерёдно ионы противоположных
знаков. Механизм образования ионного
кристалла можно объяснить на примере
поваренной соли NaCl.
Атом натрия легко теряет один электрон,
который присоединяется к атому хлора.
Так возникают два иона с противоположными
по знаку зарядами. На рисунке 12.3 белыми
кружками обозначены несущие положительный
заряд ионы натрия, чёрными кружками –
отрицательные ионы хлора. Образовавшиеся
ионы удерживаются в узлах решётки
электростатическими силами. Ионные
кристаллы хорошо растворяются в воде,
обладают высокой механической прочностью.
В ионной решётке нельзя выделить
отдельные молекулы: кристалл представляет
собой как бы одну гигантскую молекулу.Атомная решётка. Она образуется при взаимодействии нейтральных атомов. Чаще всего атомы одинаковые и при их взаимодействии не могут образовываться ионы. Примерами таких кристаллов являются алмаз и графит (рисунок 12.4), атомную решётку имеют полупроводники германий и кремний. Атомы удерживаются в узлах решётки ковалентными связями: у соседних атомов общие внешние (валентные) электроны, движущиеся по орбитам, охватывающим оба атома. Вещества с атомной решёткой обладают различной механической прочностью. Решётка графита состоит из слоёв, которые легко сдвигаются друг относительно друга, поэтому графитовый карандаш оставляет след на бумаге. Решётка алмаза не содержит плоских слоёв, поэтому алмаз является очень прочным соединением.
Молекулярная решётка. В узлах кристаллической решётки находятся молекулы. К веществам с молекулярной решёткой относят большинство органических соединений, а также кристаллы сухого льда – твёрдой углекислоты CO2, нафталина, йода и т.п. Между молекулами действуют силы межмолекулярного взаимодействия. Вследствие того, что эти силы довольно слабые, молекулярные кристаллы не обладают механической прочностью, легко разрушаются за счёт теплового движения молекул. Они плавятся при очень низких температурах, а также легко испаряются. Так кристаллы йода при нормальном атмосферном давлении испаряются при +39,6°С.
М
 еталлическая
решётка.
Такой решёткой обладают все металлы.
Решётки большинства металлов изображены
на рисунке 12.5. В узлах кристаллической
решётки находятся положительные ионы
металла, между которыми движутся
электроны. При кристаллизации металлов
электроны, находящиеся на внешних
орбитах (валентные электроны), отделяются
от атомов. Однако, в отличие от случая
ионной связи, здесь электроны не могут
присоединиться к другому атому и
образовать отрицательный ион, так как
все атомы металла одинаковы. Поэтому
валентные
электроны коллективизируются –
они уже принадлежат не одному атому,
как в случае ионной связи, и не паре
соседних атомов, как при ковалентном
взаимодействии, а всему кристаллу в
целом. Металлическая связь обеспечивается
притяжением между ионной решеткой,
образованной положительно заряженным
ионами, и отрицательно заряженным
электронным облаком, так называемым
электронным
газом.
Заметим,
что наличие свободных электронов,
способных под действием электрического
поля перемещаться по кристаллу,
обеспечивает хорошую электропроводность
металлов.
еталлическая
решётка.
Такой решёткой обладают все металлы.
Решётки большинства металлов изображены
на рисунке 12.5. В узлах кристаллической
решётки находятся положительные ионы
металла, между которыми движутся
электроны. При кристаллизации металлов
электроны, находящиеся на внешних
орбитах (валентные электроны), отделяются
от атомов. Однако, в отличие от случая
ионной связи, здесь электроны не могут
присоединиться к другому атому и
образовать отрицательный ион, так как
все атомы металла одинаковы. Поэтому
валентные
электроны коллективизируются –
они уже принадлежат не одному атому,
как в случае ионной связи, и не паре
соседних атомов, как при ковалентном
взаимодействии, а всему кристаллу в
целом. Металлическая связь обеспечивается
притяжением между ионной решеткой,
образованной положительно заряженным
ионами, и отрицательно заряженным
электронным облаком, так называемым
электронным
газом.
Заметим,
что наличие свободных электронов,
способных под действием электрического
поля перемещаться по кристаллу,
обеспечивает хорошую электропроводность
металлов.
