
- •Лекция №1. Основные положения молекулярно – кинетической теории. Масса и размеры молекул. Основные положения мкт.
- •Масса молекул.
- •Лекция № 2. Идеальный газ. Основное уравнение мкт.
- •Идеальный газ.
- •Лекция № 4. Уравнение Менделеева-Клапейрона. Общий газовый закон и его следствия.
- •Лекция № 5. Внутренняя энергия и способы её изменения.
- •Способы изменения внутренней энергии.
- •Лекция № 6. Первый закон термодинамики и его применение к изопроцессам. Адиабатический процесс.
- •Первый закон термодинамики.
- •Применение первого закона термодинамики к изопроцессам.
- •Лекция № 7. Принцип действия тепловой машины. Второй закон термодинамики.
- •Лекция № 8. Фазовые переходы. Испарение и насыщенный пар.
- •Насыщенный пар и его свойства.
- •Лекция № 9. Влажность воздуха. Взаимодействие атмосферы и гидросферы.
- •Лекция № 10. Кипение жидкости. Критическое состояние вещества.
- •Изотерма пара.
- •Сжижение газов.
- •Лекция № 11. Свойства жидкостей.
- •Текучесть
- •Поверхностное натяжение.
- •Смачивание и капиллярные явления.
- •Лекция № 12. Твёрдые тела. Виды кристаллических структур.
- •Виды кристаллических решёток.
- •Лекция № 13. Электрический заряд. Закон кулона. Электризация тел.
- •Закон Кулона.
- •Принцип суперпозиции сил.
- •Лекция № 14. Электрическое поле. Напряжённость электрического поля.
- •Принцип суперпозиции полей.
- •Напряжённость электрического поля заряженного шара.
- •Напряженность электрического поля бесконечной плоскости.
- •Силовые линии электрического поля.
- •Лекция № 15. Работа электрического поля при перемещении заряда.
- •Лекция № 16. Проводники и диэлектрики в электрическом поле. Проводники.
- •Диэлектрики.
- •Лекция № 17. Электроёмкость проводника. Конденсатор. Электроёмкость проводника.
- •Конденсатор. Электроёмкость конденсатора.
- •Лекция № 18. Способы соединения конденсаторов. Энергия электрического поля конденсатора.
- •Энергия заряженного конденсатора.
- •Лекция № 19. Постоянный электрический ток.
- •Лекция № 20. Закон Ома для участка цепи. Сопротивление.
- •Лекция № 21. Способы соединения проводников. Работа и мощность тока. Способы соединения проводников.
- •Работа электрического тока.
- •Мощность тока.
- •Соединение источников электрической энергии в батареи.
- •Лекция №23. Ток в электролитах. Электролиз и его законы.
- •Ток в электролитах
- •Законы Фарадея
- •Лекция № 24 Электрический ток в газах.
- •Основные виды газового разряда.
- •Лекция №25. Ток в вакууме. Электровакуумные приборы.
- •Лекция № 26 Ток в полупроводниках. Примесная проводимость.
- •Лекция №27. Электронно-дырочный переход и его свойства”.
Лекция № 8. Фазовые переходы. Испарение и насыщенный пар.
Рисунок 8. 1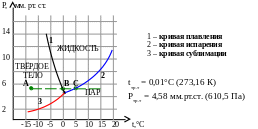
Рассмотрим подробнее фазовую диаграмму – график зависимости давления от температуры для разных фазовых состояний, изображённый на рисунке 8.1. Мы видим, что каждой точке плоскости соответствует своя определённая фаза, кроме тех точек, когда две фазы сосуществуют одновременно. На диаграмме это изображено при помощи кривых 1,2,3. Эти кривые имеют одну общую точку пересечения, которая называется тройной точкой. В этой точке возможно одновременное существование всех трёх фаз данного вещества. Она характеризуется определёнными значениями давления и температуры для данного вещества. При помощи фазовой диаграммы удобно изображать процессы изменения состояния вещества. Например, изобарическое (Р=const) нагревание вещества, находящегося в твёрдом состоянии (точка А), изображено прерывистой прямой, параллельной оси температур. Эта прямая показывает, что при температуре соответствующей точке В тело начинает плавится, при более высокой температуре превращается в жидкость, а при температуре соответствующей точке С начинает превращаться в пар.
Из всех возможных процессов рассмотрим процесс испарения и конденсации. Под испарением будем понимать процесс парообразования, происходящий только с поверхности вещества, граничащего с газообразной средой. Если учесть, что испаряться могут и твёрдые тела (сублимировать), то процесс испарения может происходить при любой возможной температуре. Механизм испарения можно объяснить следующим образам. Молекула (атом), находящаяся на поверхности жидкости или кристалла, втягивается внутрь силами межмолекулярного взаимодействия и тем самым удерживается на поверхности. Для того чтобы молекула могла покинуть вещество, её кинетическая энергия должна быть больше потенциальной энергии взаимодействия Еп молекул. Эта энергия равна работе по удалению молекулы от поверхности жидкости на расстояние, где молекулярные силы уже не действуют, т.е. на расстояние большее радиуса межмолекулярного взаимодействия RМ=10-9 м. Следовательно, условие испарения можно записать при помощи уравнения
![]() . (8.1)
. (8.1)
Отсюда следует, что покинуть поверхностный слой могут не любые молекулы, а те, у которых кинетическая энергия достаточно велика. Если из жидкости улетают быстрые молекулы, то средняя кинетическая энергия Е=3/2·kT оставшихся молекул становится меньше. Это означает, что температура жидкости в процессе испарения всегда уменьшается, а сама жидкость охлаждается. Понижение температуры воздуха после дождя объясняется испарением воды.
Скорость испарения оценивается числом молекул, переходящих с единицы поверхности жидкости (твёрдого тела) в пар за единицу времени
![]() . (8.2)
. (8.2)
Скорость испарения зависит в основном от двух причин: во-первых, она зависит от рода вещества, например, ацетон испаряется значительно быстрее, чем вода; во-вторых, от температуры (с ростом температуры скорость испарения значительно увеличивается).
Хаотически движущиеся молекулы пара, подлетая к поверхности жидкости, могут попасть в сферу действия её молекул и перейти в жидкость (как бы утонуть в ней). Этот процесс называется конденсацией. При конденсации жидкость нагревается, так как влетающие в неё молекулы пара возвращают ей повышенную кинетическую энергию, унесённую при испарении. Скорость конденсации зависит от давления или плотности пара над поверхностью жидкости. Она прямо пропорциональна плотности пара – чем больше молекул содержится в единице объёма над жидкостью, тем вероятнее, что молекула приблизится к поверхности жидкости и будет поглощена. В ветреную погоду влажное бельё сохнет быстрее. Пары воды сносятся ветром, их давление и плотность становятся меньше, и скорость конденсации значительно уменьшается. В данном случае испарение будет преобладать над конденсацией, что и приводит к быстрому высыханию белья. Процессы испарения и конденсации идут одновременно. Если преобладает первый из них, то объем жидкости уменьшается, а количество пара над ней увеличивается, Если же преобладает второй процесс, то имеет место обратная картина.
