
- •Глава 1. Физиологические аспекты старения...................... 10
- •Глава 2. Характеристика эндогенных геропротекторов
- •Введение
- •Глава 1
- •Структурно-функциональные изменения в организме при старении
- •Профилактика возрастной патологии
- •Геропротекторы
- •Глава 2
- •Многоступенчатая очистка активной субстанции от примесей
- •2.1. Физико-химические свойства
- •Молекулярная масса компонентов нуклеопротеиновых комплексов
- •Содержание сиаловых кислот в нуклеопротеиновых комплексах, выделенных из различных тканей
- •Содержание белка и нуклеиновых кислот в нпк, выделенных из различных тканей
- •2.2. Состав
- •Аминокислотный состав цитаминов
- •Содержание минеральных веществ в нуклеопротеиновых комплексах
- •Содержание микроэлементов нуклеопротеиновых комплексах
- •2.3. Антиоксидантные и геропротекторные свойства
- •Химический состав нуклеопротеиновых комплексов
- •Содержание витаминов в нуклеопротеиновых комплексах
- •Влияние нуклеопротеиновых комплексов на продолжительность жизни мышей
- •2.4. Тканеспецифические свойства
- •Глава 3
- •3.1. Эмбриотоксические и тератогенные свойства
- •3.2. Безопасность в отношении приемных белков
- •3.3. Безопасность в отношении вирусов и протоонкогенов
- •Глава 4
- •4.1. Характеристика больных
- •Распределение больных дисциркуляторной энцефалопатией по полу и возрасту
- •4.2. Эффективность применения церебрамина
- •Эффективность применения церебрамина у больных дисциркуляторной энцефалопатией
- •Динамика субъективных показателей у больных дисциркуляторной энцефалопатией
- •Динамика показателей выполнения корректурной пробы больными дисциркуляторной энцефалопатией
- •Динамика биоэлектрической активности головного мозга у больных дисциркуляторной энцефалопатией
- •Динамика изменения альфа-индекса у больных дисциркуляторной энцефалопатией
- •Глава 5 Применение геропротекторов для профилактики
- •5. 1. Характеристика больных
- •5.2. Исследование эффективности применения корамина
- •Динамика субъективных показателей у больных ишемической болезнью сердца
- •Динамика изменения показателей минерального обмена в крови больных ишемической болезнью сердца
- •Динамика показателей эхокардиографии у больных ишемической болезнью сердца
- •Динамика показателей велоэргометрии у больных ишемической болезнью сердца
- •Глава 6
- •6.1. Характеристика больных
- •6.2. Исследование эффективности применения эпифамина
- •Динамика субъективных показателей у больных с климактерическим синдромом
- •Динамика изменения содержания гормонов гипофиза в сыворотке крови больных с климактерическим синдромом
- •Глава 7
- •Динамика субъективных показателей у больных обменно-алиментарным ожирением с сопутствующей гипертонической болезнью
- •Показатели функционального состояния сердечно-сосудистой системы у больных обменно-алиментарным ожирением с сопутствующей гипертонической болезнью
- •Биохимические показатели в периферической крови больных обменно-алиментарным ожирением с сопутствующей гипертонической болезнью
- •Динамика субъективных показателей у больных обменно-алиментарным ожирением с хроническим панкреатитом
- •Динамика показателей гемоцитограммы у больных обменно-алиментарным ожирением с хроническим панкреатитом
- •Динамика биохимических показателей в периферической крови у больных обменно-алиментарным ожирением с хроническим панкреатитом
- •Динамика показателей углеводного обмена у больных обменно-алиментарным ожирением с хроническим панкреатитом.
- •Заключение
3.2. Безопасность в отношении приемных белков
Для анализа биологического материала на содержание прионных белков ВОЗ рекомендованы методы гистохимии, электронной микроскопии, электрофореза и иммуноблотинга с антителами к прионному (РгР) белку [Меморандум совещания ВОЗ, 1992; Киселев О. И. и соавт., 1998; Покровский В. И. и соавт., 2004]. '
С целью подтверждения отсутствия в выделенных нуклео-протеиновых комплексах прионных белков изучали сконцентрированные в 200 раз образцы препаратов. Для изучения использовали НПК, выделенные из органов, наиболее опасных в отношении содержания прионных белков, — коры головного мозга, эпифиза головного мозга, тканей глаза, хрящевой ткани: церебрамин, эпифамин, офталамин, хондрамин соответственно.
Для первичного скрининга прионных инфекций ВОЗ рекомендован гистохимический метод, основанный на окрашивании исследуемого препарата красителем конго-красным. По характерному свечению в скрещенных поляризаторах окрашенного конго-красным препарата можно выявитm наличие в препарате амилоида, т. е. класса белков, к которому относятся прионы.
Результаты гистохимического исследования представлены на рис. 7.
При окрашивании красителем конго-красным сконцентрированных фракций церебрамина, офталамина, эпифа-мина и хондрамина, фиксированных на полиакриламидном геле, не наблюдалось избирательного связывания красителя. Просмотр окрашенных препаратов в скрещен-

Рис. 7. Анализ церебрамина гистохимическим методом
Окрашивание конго-красным х 600. Свечения амилоида не наблюдается. Точки - пузырьки в геле, светлое пятно — рассеяние света в геле
ных поляризаторах не выявил какого-либо характерного для амилоидных агрегатов свечения. При исследовании препарата амилоидной печени человека обнаруживалось яркое избирательное окрашивание конго-красным и характерное желто-зеленое свечение амилоидных фибрилл в скрещенных поляризаторах (рис. 8).
Таким образом, с использованием гистохимического метода наличия амилоида и амилоидоподобных белковых соединений, в том числе прионов, при исследовании НПК выявлено не было.
В настоящее время разработаны более специфичные и высокочувствительные методы выявления прионных белков, чем гистохимическое окрашивание конго-красным, в частности иммуноблотинг и прямое электронно-микроскопическое выявление прионов в виде скрэпи-ассоции-рованных фибрилл (САФ) в сочетании с протеолизом.
Иммуноблотинг — высокоспецифичный метод, позволяющий выявить в препарате различные варианты РгР-белка, в том числе инфекционные прионы.

Рис. 8. Анализ препарата амилоидной печени человека
гистохимическим методом. x6ОО
Свечение амилоидных фибрилл при наблюдении в скрещенных
поляризаторах окрашенного конго-красным препарата
Для иммуноблотинга использовали моноклональные антитела к клеточному (неинфекционному) РгРс и инфекционному РгРSc белкам — 6Н4 (check-kit PRIONICS).
Результаты
исследования представлены на рис. 9 и
10. В препарате хондрамин по результатам
электрофореза в полиакриламидном
геле (рис. 9) не было выявлено белков с
молекулярной массой ниже 45-50 кДа, что
свидетельствует об отсутствии белков
класса прионов (27-30 кДа), После инкубации
мембраны PVDF
с
исследуемыми образцами препаратов
хондрамин и офталамин без протеазцой
обработки с антителами 6Н4 и последующего
окрашивания не было выявлено никаких
бэндов связывания, т. е. прионных
белков в исследованных препаратах не
обнаружено (рис. 10).
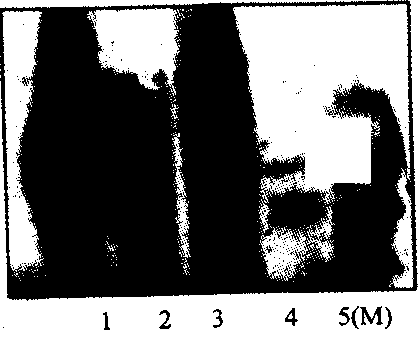
Рис. 9. Анализ нуклеопротеиновых комплексов методом
электрофореза в полиакриламидном геле
Дорожки: 1 — церебрамин; 2 — хондрамин; 3 — офталамин; 4 — эпифамин; 5 — маркерные белки (молекулярная масса 30, 40 кДа)
В препаратах церебрамин и эпифамин до протеолити-ческой обработки методом электрофореза (рис. 9) были выявлены слабые полосы на уровне молекулярной массы 30-35 кДа, что свидетельствовало о наличии нормального клеточного белка РгРсв исследуемых препаратах. После обработки образцов протеиназой К, инкубации с антителами 6Н4 и последующего окрашивания ни в одном из исследованных препаратов не было выявлено связывания с антителами (рис. 10), что свидетельствует об отсутствии инфекционного прионного белка.
Таким образом, методом иммуноблотинга установлено, что связывания антител с церебрамином, офталамином, эпифамином и хондрамином не наблюдалось. Следовательно, нормальный клеточный прионный белок (РгРс), присутствующий в исходном сырье, эффективно элиминируется в технологическом процессе и в конечном продукте не обнаруживается. Аномальные модификации прионного белка (PrPSc), т. е. инфекционные прионы, также не выявлены.
Прямое электронно-микроскопическое выявление прионных белков в виде скрэпи-ассоциированных фибрилл в сочетании с протеолизом позволяет обнаружить наличие прионов сразу по двум характерным признакам: протео-литической резистентности и морфологическим особенностям фибриллярных структур, образуемых прионами. Некоторые авторы указывают на то, что агрегация отдельных прионных молекул с образованием жгутообразных структур типа САФ может происходить уже после обработки протеиназой К в небольшой концентрации, поэтому в отдельных случаях (видимо, при наличии сильно гликозилированных форм) прионы не обнаруживаются электронно-микроскопически до обработки протеиназой.
При
исследовании сконцентрированных в 200
раз белковых фракций НПК фибриллярных
структур в виде так называемых «прионных
палочек» и скрэпи-ассоциированных
фибрилл выявлено не было. На угольных
подложках обнаруживались только
следы сорбции низкомолеку-
Рис. 10. Анализ нуклеопротеиновых комплексов методом иммуноблотинга
Дорожки: 1 — церебрамин; 2 — хондрамин; 3 — офталамин; 4 — эпифамин. Слева — дорожки до обработки протеиназой К, справа - после обработки

Рис. 1 1 . Анализ церебрамина
электронно-микроскопическим методом
Изображение углеродной подложки, на которой сорбирован церебрамин.
Негативный контраст, х 30 000
Какие-либо волокна отсутствуют. Видны только светлые округлые пятна —
следы сорбции низкомолекулярных водорастворимых соединений. Темные
области — контрастирующее вещество
лярных соединений. После протеолиза никаких структур, похожих на прионы, также не выявлено (рис. 11).
Таким образом, диагностическими методами, рекомендованными ВОЗ, в том числе с использованием иммуноблотинга и электронной микроскопии, белковых соединений класса амилоидов, в том числе прионов, в нуклеопротеиновых комплексах не выявлено.
