
- •Терминологический словарь
- •Моносахариды- простые углеводы, содержащие гидроксильные и альдегидную (альдозы) или кетонную (кетозы) группы. По числу атомов углерода различают триозы, тетрозы, пентозы и т.Д.
- •Глава 1. Паращитовидные железы
- •Функции кальция.
- •Регуляция поддержания нормального уровня
- •Кальция, магния и фосфата в сыворотке крови
- •Метаболизм фосфата
- •Регуляторы экспрессии птг
- •Рецепторы птг — трансмембранные гликопротеины, связанные с g‑белком — в значительном количестве содержатся в костной ткани (остеобласты) и корковой части почек (эпителий извитых канальцев нефрона).
- •Функции. Птг поддерживает гомеостаз кальция и фосфатов.
- •Минерализация остеоида
- •Особенности коррекция обмена кальция методами прикладной кинезиологии.
- •Пищевые факторы стимулирующие: Лосось
- •Глава 2. Мужские половые железы — яички (тестис)
- •Анатомия яичек и половой системы
- •Эмбриогенез
- •Гормоны мужских половых желез - яичек
- •Эффекты мужских половых гормонов
- •Транспорт мужских половых гормонов
- •Механизм действия андрогенов
- •Регуляция функции мужских половых желез
- •Болезни мужских половых желез гипогонадизм
- •Первичный гипергонадотропный гипогонадизм
- •Причины первичного гипогонадизма:
- •Недостаточность семинифорных трубочек у взрослых.
- •Аутоиммунный гипогонадизм.
- •Вторичный и третичный гипогонадотропный гипогонадизм
- •Третичный гипогонадизм
- •Гиперпролактинемия как причина гипогонадизма
- •Мужской климакс, или андропауза
- •Примеры токсических эффектов факторов внешней среды на мужскую репродуктивную систему
- •Доброкачественная гиперплазия простаты (дгп)
- •Гормональная регуляция предстательной железы
- •Фитотерапия
- •Женские половые железы — яичники. Анатомия, функция, гормоны яичников. Менструальный цикл
- •Гормоны яичников
- •Физиологические эффекты стероидных гормонов яичников
- •Метаболизм стероидных гормонов яичников
- •Пути метаболизма эстрогенов
- •Рост и развитие фолликула в яичниках
- •Гипоталамически-гипофизарный цикл
- •Цикл яичников
- •Половой гормон, связывающий глобулин
- •Механизм регуляции функции яичников
- •Клиника и патогенез нарушений метаболизма эстрогенов
- •Предменструальный синдром
- •При ановуляторных циклах предменструальный синдром не возникает.
- •Наблюдаются:
- •Диагностический критерий:
- •Лечение дисменореи
- •Симптомы
- •Эстрогены при поликистозе:
- •Диагностика
- •Возможные этиологии
- •Лечение
- •Предменопауза
- •Менопауза
- •Урогенитальные изменения
- •Лечение
- •Прутняк/Ягоды чистоты
- •Клопогон кистевидный (Black Cohosh)
- •Индол-3-карбинол
- •Глава 3. Эндокринная часть поджелудочной железы (островки лангерганса, гормоны, их функция, эффекты, механизм действия)
- •Механизм действия инсулина
- •Транспортные белки для глюкозы
- •Соматостатин
- •Панкреатический полипептид (рр)
- •Гомеостаз глюкозы в норме Функции углеводов
- •Расщепление углеводов
- •Транспорт глюкозы в клетки
- •Катаболизм глюкозы
- •Значение анаэробного гликолиза
- •Особенности метаболизма гликогена в печени и мышцах
- •Биосинтез глюкозы - глюконеогенез
- •Пентозофосфатный путь в метаболизме глюкозы
- •Регуляция метаболизма углеводов (некоторые аспекты)
- •Сахарный диабет
- •3. Другие специфические типы сахарного диабета.
- •4. Гестационный диабет.
- •Сахарный диабет тип 2
- •Гиперинсулинизм.
- •Интерпретация результатов пробы
- •Аллопатическое лечение сахарного диабета
- •3. Препараты сулъфонилмочевины (см).
- •1 Тип сахарного диабета.
- •2Тип сахарного диабета.
- •Глубокоуважаемые коллеги!
- •Программа семинаров
Минерализация остеоида
Остеоид — неминерализованный органический костный матрикс вокруг остеобластов, синтезирующих и секретирующих его компоненты. Остеоид минерализуется за счёт активности щелочной фосфатазы. Этот фермент осуществляет гидролиз эфиров фосфорной кислоты с образованием ортофосфата, который взаимодействует с Ca2+, что приводит к образованию осадка в виде аморфного фосфата кальция Ca3(PO4)2 с последующим формированием из него кристаллов гидроксиапатита. Для нормальной минерализации остеоида особенно необходима активная форма витамина D3 — кальцитриол. Способствуя всасыванию кальция и фосфора в кишечнике, он обеспечивает их необходимую концентрацию для запуска кристаллизационных процессов в костном матриксе. Прямо воздействуя на остеобласты, кальцитриол повышает активность щелочной фосфатазы в этих клетках, способствуя минерализации костного матрикса.
Клетки костной ткани
Остеобласты активно синтезируют и секретируют вещества костного матрикса практически через всю поверхность клетки, что даёт возможность остеобласту окружить себя матриксом со всех сторон. По мере снижения синтетической и секреторной активности остеобласты становятся остеоцитами, замурованными в костный матрикс. И остеобласты, и остеоциты экспрессируют рецепторы ПТГ и кальцитриола.
Остеоциты — зрелые неделящиеся клетки, расположенные в костных полостях, или лакунах. Тонкие отростки остеоцитов находятся в канальцах, отходящих в разные стороны от костных полостей (лакунарно–канальцевая система). Остеоциты поддерживают структурную целостность минерализованного матрикса, участвуют в регуляции обмена Ca2+ в организме. Эта функция остеоцитов находится под контролем со стороны Ca2+ плазмы крови и различных гормонов. Лакунарно–канальцевая система заполнена тканевой жидкостью, через которую осуществляется обмен веществ между остеоцитами и кровью. В канальцах постоянно циркулирует жидкость, что поддерживает диффузию метаболитов и обмен между лакунами и кровеносными сосудами надкостницы. По химическому составу лакунарно–канальцевая жидкость отличается от плазмы крови или жидкости в матриксе других тканей. Концентрация Ca2+ и PO43– в лакунарно–канальцевой жидкости превышает критический уровень для спонтанного осаждения солей Ca2+, что указывает на присутствие секретируемых костными клетками ингибиторов осаждения, контролирующих процесс минерализации.
Остеокласты — крупные многоядерные клетки системы мононуклеарных фагоцитов. Предшественники остеокластов — моноциты. Для дифференцировки остеокластов необходимы колониестимулирующий фактор макрофагов (M-CSF) и кальцитриол, а для их активизации ИЛ6 и продуцируемый остеобластами фактор дифференцировки остеокластов (лиганд остеопротегерина). Остеокласты расположены в области резорбции (разрушения) кости.

Рис. 21. Клетки костной ткани. Адаптировано из Афанасьев Ю.И., Елисеев В.Г., 1989 .

Рис.22 КОСТНАЯ ТКАНЬ. I. Остеокласт. Цитоплазматические выросты гофрированной каёмки направлены к поверхности костного матрикса. В цитоплазме содержатся многочисленные лизосомы. II. Остеокласт и резорбция кости. При взаимодействии остеокласта с поверхностью минерализованного костного матрикса карбоангидраза II (CA II) катализирует образование H+ и HCО3–. H+ при помощи протонной H+,K+‑АТФазы активно выкачивается из клетки, что приводит к закислению замкнутого пространства лакуны. Гидролитические ферменты лизосом расщепляют фрагменты костного матрикса. А — остеокласт на поверхности кости; Б — часть гофрированной каёмки; В — часть клеточной мембраны остеокласта в области, гофрированной каёмки. III. Трабекулы костной ткани. Слева — в норме, справа — остеопороз. IV. Возрастная динамика костной массы. Для гидроксиапатита даны относительные значения.
Гофрированная каёмка остеокласта — многочисленные цитоплазматические выросты, направленные к поверхности кости. Через мембрану выростов из остеокласта выделяется большое количество H+ и Cl–, что создаёт и поддерживает в замкнутом пространстве лакуны кислую среду (pH около 4), оптимальную для растворения солей кальция костного матрикса. Образование H+ в цитоплазме остеокласта катализирует карбоангидраза II. Остеокласты содержат многочисленные лизосомы, ферменты которых (кислые гидролазы, коллагеназы, катепсин K) разрушают органическую часть костного матрикса.

Рис. 23. Схема ремоделирования кости. Адаптировано из Raisz L.G., 1999 .
Таблица 6. Шаги кальцификации кости.
Остеокласты секретируют молекулы коллагена и основного вещества. |
Молекулы коллагена образуют коллагеновые волокна, называемые остеоидом. |
Остеобласты секретируют энзим - щелочную фосфатазу (ЩФ), которая увеличивает локальную концентрацию фосфата, активирует коллагеновые волокна, вызывая отложение солей фосфата кальция. |
Соли фосфата кальция преципитируют на коллагеновых волокнах и окончательно становятся кристаллами гидроксиапатита. |
Гормональная регуляция
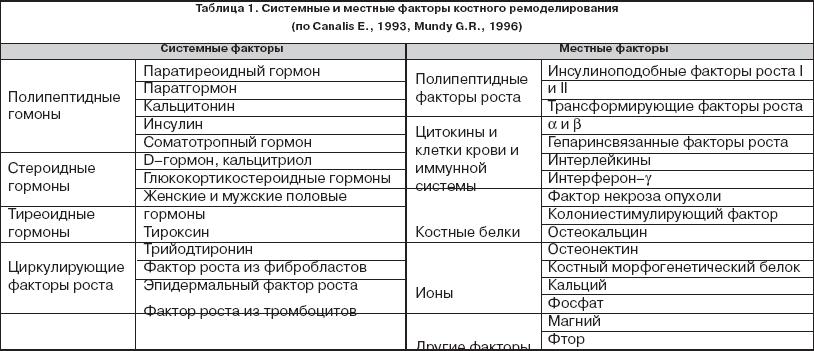
Регуляция роста
Синтез макромолекул костного матрикса стимулируют:
Кальциотонин (кальцитриол), ПТГ, соматомедины, трансформирующий фактор роста β, полипептидные факторы роста из кости.
Соматомедины стимулируют анаболические процессы в скелетных тканях (синтез ДНК, РНК, белка, включая протеогликаны), а также сульфатирование гликозаминогликанов. Активность соматомединов определяет гормон роста (соматотропин).
Витамин C необходим для образования коллагена. При дефиците этого витамина замедляются рост костей и заживление переломов.
Витамин A поддерживает образование и рост кости. Недостаток витамина тормозит остеогенез и рост костей. Избыток витамина A вызывает зарастание эпифизарных хрящевых пластинок, и замедление роста кости в длину.
Регуляция минерализации
Кальцитриол, необходимый для всасывания Ca2+ в тонком кишечнике, поддерживает процесс минерализации. Кальцитриол стимулирует минерализацию на уровне транскрипции, усиливая экспрессию остеокальцина. Дефицит витамина D3 приводит к нарушению минерализации кости, что и наблюдают при рахите у детей и остеомаляции у взрослых.
Регуляция резорбции
Резорбцию кости усиливают: ПТГ, ИЛ1, ИЛ6, трансформирующий фактор роста α, Пг. Резорбцию кости поддерживают йодсодержащие гормоны щитовидной железы.
Усиление резорбции под действием ПТГ не связано с прямым влиянием этого гормона на остеокласты, т.к. эти клетки не имеют рецепторов ПТГ. Активирующее влияние ПТГ и кальцитриола на остеокласты осуществляется опосредованно — через остеобласты. ПТГ и кальцитриол стимулируют образование фактора дифференцировки остеокластов — лиганда остеопротегерина.
Резорбцию кости, и активность остеокластов подавляют кальцитонин (через рецепторы в плазмолемме остеокластов) и γ‑ интерферон.
Эстрогены ингибируют выработку ретикулярными клетками костного мозга колониестимулирующего фактора макрофагов (M-CSF), необходимого для образования остеокластов, что тормозит резорбцию кости.
Микроэлементы и метаболизм костной ткани.
Многообразие
процессов остеогенеза направляется и
контролируется при участии гормонов,
ферментов, витаминов, медиаторов и
других факторов, в физиологической и
биохимической активации которых
важнейшее, а в ряде случаев решающее
значение и меют
различные микроэлементы и их сочетания
(рис.21). Действуя по принципу обратной
связи, микроэлементы, гормоны, ферменты,
витамины, медиаторы и другие, биологически
активные вещества, как при физиологическом
остеогенезе, так и при регенерации
обеспечивают анаболическую направленность
костного метаболизма. Так, продукция
анаболических гормонов происходит при
мобилизации меди, кобальта, марганца и
др.
меют
различные микроэлементы и их сочетания
(рис.21). Действуя по принципу обратной
связи, микроэлементы, гормоны, ферменты,
витамины, медиаторы и другие, биологически
активные вещества, как при физиологическом
остеогенезе, так и при регенерации
обеспечивают анаболическую направленность
костного метаболизма. Так, продукция
анаболических гормонов происходит при
мобилизации меди, кобальта, марганца и
др.
Рис. 21. Биохимические взаимосвязи минеральных элементов. Сплошные линии - установленные взаимосвязи, пунктирные - предполагаемые, жирные линии - синергизм, полужирные - антагонизм (по В. И. Георгиевскому).
Активизация ферментов и энзиматических систем также происходит с участием микроэлементов. Так, сукцинатдегидрогеназа активизируется в присутствии ионов Al3+ Co2+; изоцитрат - в присутствии Mn2+ и Mg2+; пируват - Mn2+, Co2+; пируватфосфатазы — Fe2+, Co2+; липазы - Pb2+ и др. Недостаток ряда микроэлементов, в частности марганца, в костной ткани нарушает синтез мукополисахаридов костного регенерата и созревание коллагена. В то же время избыток ряда микроэлементов и их сочетаний угнетает метаболизм, усвояемость питательных веществ, в том числе и минеральных, в желудочно-кишечном тракте (стронций, бериллий, магний, медь, алюминий). Микроэлементы играют важную роль не только в процессах нормальной физиологической регенерации и обновления кристаллической решетки гидроксиапатита костной ткани, но и тесно связаны в обмене с органическим компонентом ее за счет прямого влияния на остеогенные клеточные элементы. Процесс синтеза мукополисахаридов в зоне перелома кости также сопровождается усилением адсорбции ряда микроэлементов (Al, Cu, Mn, Pb и др.). Образуют они стойкие хелатные комплексы с соединениями мукопротеидной природы и играют, вероятно, определенную роль в "созревании" коллагена и его дальнейшей пространственной агрегации. Ряд микроэлементов (Mn, Co, Cu) участвует в катализе ферментативных реакций, протекающих в остеогенных клетках, и без их присутствия нарушается, например, остеобластическая и остеокластическая дифференцировка. Кроме того, микроэлементы принимают активное участие в энзиматических процессах коллагеновых фибрилл (марганец, ванадий и др.). Установлено, что некоторые микроэлементы играют важную роль в патогенезе костных болезней. Соли стронция и ванадия благоприятно влияют на репаративные процессы в костной ткани при тяжелом течении рахита, не поддающегося лечению, а также при некоторых формах остеомаляции и остеохондрозе. Недостаток ряда микроэлементов может быть причиной некоторых форм спонтанного рассасывания минерального компонента костной ткани, снижения интенсивности конденсации гидроксиапатита (Мп, Sr, Wa, Си, F, РЬ и др.). Эта многогранная роль микроэлементов проявляется благоприятно только при условии, что они поступают в организм в биотических количествах, не превышающих предельную физиологическую потребность организма. Завышенные количества микроэлементов вначале вызывают усиление физиологических функций и метаболических процессов, а затем отрицательно влияют на организм. Это токсикофармакологическое действие микроэлементов проявляется в нарушении жизнедеятельности организма вследствие блокировки (инактивации) ферментных систем, метаболических цепей и изменения агрегатного состояния коллоидодисперсных систем. Гидроксиапатитовая кристаллическая решетка костной ткани имеет огромную площадь, на которой в большом количестве адсорбируются ионы, обладающие способностью обмениваться с окружающей внутритканевой средой. Все эти процессы каталитически и материально протекают с участием различных микроэлементов. Микроэлементы, входя в состав металлоэнзимов, витаминов и других комплексных высокоактивных биополимеров, играют важную интегрирующую функцию на различных уровнях организации. Ряд микроэлементов (медь, кобальт, марганец) активно участвует в каталитических обменных реакциях в остеоцитах, обусловливая их дифференцировку и функционирование. Марганец и ванадий принимают участие в энзиматических процессах минерализации коллагена костной ткани. Стронций и ванадий стимулируют репаративные процессы в костной ткани при тяжело протекающем рахите, остеомаляции, не поддающихся D-витаминной терапии. Недостаток ряда микроэлементов приводит к усилению резорбтивных процессов в костной ткани (марганец, стронций, ванадий, медь, фтор и др.). Наряду с этим избыток отдельных микроэлементов в почве, воде может быть причиной. К таким же последствиям может привести их дисбаланс - избыток одних и недостаток других (уровская болезнь).
Магний. Как недостаток, так и избыток магния способствуют образованию камней во внутренних органах (почечнокаменная, желчнокаменная болезнь).
Марганец. Гипомарганцемия приводит к приостановке роста костей и снижению активности щелочной фосфатазы в крови. Продолжительное и избыточное введение солей марганца, наоборот, угнетает рост и кальцификацию костей. Субтоксические дозы марганца нарушают процесс энхондрального остеогенеза и вызывают патологическую картину рахита в костной ткани.
Железо. Способно накапливаться в зонах энхондрального и периостального костеобразования, способствуя процессу стабилизации гидроксиапатита в остеоидной субстанции. Чрезмерное поступление солей железа может вызвать признаки хондродисплазии, особенно на фоне избытка стронция, когда изменения в костной ткани начинают протекать по типу рахита. Наряду с кальцием железо активно отлагается в очагах некроза.
Фтор. Костная ткань является основной тканью, депонирующей в организме фтор. В оптимальных дозах фтор играет важную роль в остеогенезе, так как кристаллы гидроксиапатита без присутствия следов фтора не образуются.
Медь. В процессах роста и дифференциации костной ткани медь играет важную роль, концентрируясь в основном в зонах роста эпифизов костей. При недостатке меди наступает гипофосфатемия, приводящая к нарушению остеогенеза, не поддающемуся А- и D-витаминной терапии. В случае недостатка, как и избытка, меди компакта становится на 1/3-1/2 тоньше, чем в норме, количество остеонов уменьшается (остеопороз). Хрящевая ткань, наоборот, гипертрофируется и содержит больше, чем в норме, хондробластов. Остеобласты под действием избытка меди угнетаются. Благоприятное действие меди на остеобласты проявляется только в оптимальных дозах, особенно в сочетании с диетой, обогащенной солями кальция. При недостатке меди ингибируется энергетический цикл остеобластов (в системе цитохромоксидаза - цитохром С) и клетки гибнут, нарушаются остеобластическая дифференцировка клеточных элементов регенерата костной ткани, заживление переломов и синтез гемоглобина, снижается основной обмен.
Барий является остеотропным микроэлементом. В золе трубчатых костей его содержится около 0,022 % (М. Г. Белан, 1964). При недостатке кальция барий заменяет его в кристаллической решетке гидрооксиапатита. Барий в 2 раза быстрее переходит из крови в кость и обменивается за 12,8 дн. Избыток его угнетает процесс минерализации костной ткани.
Стронций также в основном депонируется костной тканью, обладает свойствами, близкими к кальцию. В трубчатых костях его содержится около 0,0186 % (М. Г. Белан, 1964). Сосредоточен стронций главным образом в зонах остеобластической активности и поэтому может служить индикатором репаративной активности костной ткани. Однако стронций, особенно радиоактивный (Sr90), обладает канцерогенными свойствами, и это не позволяет широко использовать его в клинической практике. Опасность представляет загрязнение окружающей среды (почвы, воды, растений и т. п.) радиоактивным стронцием. Костная ткань в обычных условиях задерживает стронций по сравнению с кальцием в соотношении 1:6. Витамин D способствует задержке стронция в костной ткани.
Цинк. В костной ткани содержится от 70 до 200 у (мкг) цинка на 1 г массы сырой костной ткани. Он является активатором ряда ферментов, в том числе щелочной фосфатазы костной ткани, карбоангидразы, карбоксипептидазы панкреатического сока, алкогольдегидрогеназы и др. Усвояемость цинка зависит от белкового состава пищи, содержания в них кальция, меди. Последние угнетают утилизацию цинка, отчего нарушается его резорбция из кишечника. Повышение уровня цинка в пище угнетает обмен кальция, фосфора и магния.
Алюминий. Воздействует на обмен фосфора на стадии фосфорилирования и принимает участие в образовании ядер нуклеина белковой матрицы костной ткани (H.Selje, 1965).
Кремний принимает активное участие в процессах физиологической и репаративной регенерации кости. По С. F. Geyer (1953), в 100 г золы из компакты находится 0,04 % кремния, а в эмали зубов - 0,03 %. При остеомаляции из организма выделяется значительно больше кальция и кремния, чем магния и фтора. Введение в организм соединений кремния и калия стимулирует рекальцификацию костной ткани. При остеомаляции в костной ткани понижено содержание кремния, фосфора и щелочноземельных микроэлементов наряду с задержкой в организме фтора, магния и кальция. Таким воздействием на обмен кремния можно повысить фиксацию кальция и фосфора в костной ткани.
Кобальт. Соединения кобальта стимулируют заживление переломов костей и включение фосфора в костную ткань (Ф. X. Сейфуллин, 1963). Входя в состав витамина B12 (цианкобаламина), он стимулирует общий обмен, гемопоэз и, таким образом, вторично влияет на интенсивность костного метаболизма. Соединения кобальта усиливают активность щелочной фосфатазы, играющей важную роль в минерализации костной ткани.
Селен.
Бор. Физиологическая роль в процессах остеогенеза не вполне ясна. Обмен бора связан с обменом калия, при дефиците которого задерживается рост, устраняемый назначением солей бора.
Иод. Стимулирует синтетическую активность органического матрикса, что создает благоприятные условия для процесса минерализации.
Хром. Способен к ионообмену с кальцием подобно ионообмену стронция и адсорбированию на поверхности кристаллической решетки гидрооксиапатита.
Нарушения нормальной функции кости
Метаболические заболевания костей разделяют на следующие категории: остеомаляция, остеопороз, остеодистрофии, остеопетроз.
Остеомаляция — патология скелета, возникающая при недостаточной минерализации органического матрикса костей. У детей это рахит, вызванный дефицитом витамина D, а у взрослых — нарушения метаболизма кальция, фосфора и витамина D.
Остеопороз
Остеосклероз и остеопетроз — собирательные и на практике идентичные понятия, характеризующие относительное увеличение содержания костной ткани в составе костей, что приводит к уменьшению объёма костномозговых полостей с неизбежным нарушением гемопоэза.
Акромегалия. Вследствие избытка соматотропина развиваются аномальные кости конечностей и лицевого скелета.
Эктопическая кальцификация происходит в стенке сосудов при атеросклерозе и в «норме» при образовании «мозгового песка» в шишковидной железе.
ОСТЕОПОРОЗ
Остеопороз — системное заболевание скелета, характеризующееся снижением массы костей и микронарушениями в архитектонике костной ткани, которые приводят к значительному увеличению хрупкости костей и возможности их переломов (определение остеопороза, принятое в международной практике, 1999 г.).
норма
остеопороз

Рис.24.
Строение кости.
Потеря костной массы — остеопения начинается у женщин в четвертом десятилетии жизни, у мужчин — позже. Когда остеопения, вначале физиологическая, приобретает характер патологической, ее называют остеопорозом.
Причины первичного остеопороза:
Менопаузальный и постменопаузальный остеопороз.
Сенильный, или старческий, остеопороз.
Идиопатический остеопороз, возникающий в молодом возрасте, — «ювенильный остеопороз».
Патогенез первичного остеопороза.
• Постменопаузальный остеопороз. Эстрогены защищают кость от разрушения путем подавления ее резорбции. Они подавляют синтез остеобластами цитоки- нов, таких как интерлейкин-6 (ИЛ-6) и синтез остеокласты стимулирующего фактора. В условиях недостатка эстрогенов секреция остеобластами интерлей- кина-6 увеличивается, он активирует остеокласты и резорбцию кости. Увеличивается потеря кальция с мочой. В эти периоды потеря кальция составляет около 60 мг/сут., в то время как в молодом возрасте потеря кальция находится в пределах 20 мг/сут. Это составляет 13% от всего количества кальция в орга- низме (1000 мг). Увеличение экскреции кальция с мочой подавляет образование активного витамина D3 в почках. Уменьшение концентрации витамина D3 в сыворотке крови ведет к уменьшению всасывания кальция из кишечника. В результате повышается секреция ПТГ или повышается чувствительность кости к ПТГ, происходит прогрессирующее уменьшение минеральной плотно- сти кости и повышается риск ее переломов. Такой же генез имеет остеопороз при первичном и вторичном гипогонадизме, пролактиноме. В основе лежит недостаток половых гормонов.
Старческий, или сенильный, остеопороз. В пожилом и старческом возрасте у женщин и мужчин снижаются функциональная активность кишечника и почек. Прогрессивно уменьшается образование в коже предысточника витамина D -холекальциферола и способность почек превращать гидроксивитамин D3 -l,25(OH)D в дегидроксивитамин D — l,25(OH)2D, который является активным витамином D. В результате уменьшается всасывание кальция и его содержание в сыворотке крови. Это ведет к увеличению секреции ПТГ и увеличению резорбции кости.
Идиопатический (ювенилъный) остеопороз развивается у лиц молодого возраста без каких-либо причин. Течение болезни может быть тяжелым, с компрессионными переломами позвонков.
Причины и патогенез вторичного остеопороза:
Диетический фактор — недостаток кальция в пище. Это ведет к уменьшению синтеза кости и увеличению резорбции, обеспечивающих поддержание нормального уровня кальция в крови.
Желудочно-кишечные болезни: синдром мальабсорбции, цирроз печени, обтурационная желтуха. При этих болезнях уменьшается всасывание кальция в кишечнике.
Недостаточность эстрогенов у женщин и андрогенов у мужчин — первичный и вторичный гипогонадизм, пролактинома.
Тиреотоксикоз и лечение большими дозами тироксина (прямое стимулирующее дейстие на остеокласты и увеличивает резорбцию кости).
Синдром Кушинга и лечение глюкокортикоидами (увеличение катабо-лических процессов. Они подавляют созревание и активность остеобластов и способствуют их апоптозу, влияют на мультипотентные стволовые клетки костного мозга, изменяя их дифференцировку с образования остеобластов на другой путь, ведущий к образованию адипоцитов, тормозят реабсорбцию кальция и увеличивают его экскрецию с мочой, в больших дозах прямо подавляют всасывание кальция и в результате уменьшают концентрацию кальция, в том числе ионизированного, в сыворотке крови. В ответ увеличивается секреция ПТГ и ремоделирование кости с преобладанием резорбции и увеличением поступления кальция в кровь).
Длительное лечение гепарином или противосудорожными препаратами(активизация остеокластов и резорбции кости).
Анорексия невроза (Уменьшение поступления кальция с пищей и всасывания его в кишечнике. Катаболические процессы происходят во всех органах и тканях, в том числе и в костях. Развитию остеопороза способствует дефицит эстрогенов из-за снижения функции яичников и аменорея).
Алкоголизм (недостаток кальция, белка и витаминов в пище, уменьшение всасывания кальция в кишечнике и, возможно, прямое катаболическое действие алкоголя на кость).
9. Длительная иммобилизация и уменьшение физической активности. Для нормального ремодулирования кости необходима физическая активность. Уменьшение или прекращение физической активности способствует развитию остеопороза.
Синдром Марфана. В основе этого заболевания лежит дефект в мезенхимальной ткани, в том числе и в кости.
Остеопороз у атлетов. Развитие остеопороза у спортсменок связано с развитием аменореи и недостатком эстрогенов.
Клинические проявления. Проявляется уменьшением роста, развитием кифоза, болями в спине, компрессионными переломами позвонков.
Ренгенологически выявляется уменьшение высоты позвонков, они приобретают форму «рыбьих», могут быть следы старых или признаки свежих переломов (компрессионные переломы, переломы остистых отростков).
Лабораторные данные. В сыворотке крови несколько повышена концентрация ПТГ, снижен уровень витамина D3 — l,25(OH)2D — и повышена концентрация маркеров костеобразования и маркеров костной резорбции. Эти маркеры свидетельствуют о том, что при постменопаузальном и сенильном остеопорозе увеличивается ремоделирование кости с преобладанием резорбции. При наличии перелома кости может быть повышена в сыворотке крови концентрация щелочной фосфотазы.
Когда потеряно 30—50% костной массы, остеопороз диагностируется рентгенологически. Но при этом не всегда выявляются специфические черты остеопороза. Наиболее точным диагностическим методом выявления остеопороза является определение минеральной плотности кости. Это метод денситометрии. Согласно рекомендации ВОЗ, костная плотность > 2,5 SD свидетельствует о наличии остеопороза, а костная плотность между 1,0 и 2,5 — об остеопении.
Лечение остеопороза:
I. Устранение факторов, способствующих остеопорозу.
II. Физическая активность.
III. Лекарственная терапия.
В лечении остеопороза используют группы препаратов, подавляющих развитие и прогрессирование остеопороза:
Препараты, тормозящие резорбцию кости.
Препараты, стимулирующие синтез кости.
Комбинации препаратов обеих групп.
• Препараты антирезорбтивного действия.
К препаратам этой группы относятся кальций, витамин D, эстрогены, кальцитонин и бифосфонаты.
1) Кальций. Лечение препаратами кальция отчетливо снижает частоту переломов костей и, по данным денситометрии, увеличивает минеральную плотность кости. Кальций стимулирует синтез и минерализацию костей
Для всасывания кальция необходим витамин D. Поэтому всасывание кальция, при достаточном его содержании в пище, но при недостатке витамина D, снижается и в организме возникает дефицит кальция.
2) Витамин D. Считают, что в настоящее время у большинства людей имеет место недостаток витамина D. Нормальная концентрация витамина D в сыворотке крови более 25—30 нг/мл. Уровень витамина D в сыворотке ниже 25 нг/мл ведет к повышению секреции паратиреоидного гормона (ПТГ), что свидетельствует о недостатке всасывания кальция в кишечнике.
Для нормализации уровня кальция в сыворотке ПТГ стимулирует выход кальция из кости в кровь путем увеличения резорбции кости. Поэтому в лечении остеопороза препараты кальция используются в сочетании с витамином D. Лицам в возрасте 25—50 лет назначается кальций в дозе 500—1000 мг в день и 400 ЕД витамина D. Лицам старше 60 лет назначается 1000—1500 мг кальция в день и 800 ЕД витамина D. Подросткам, беременным женщинам и в период лактации кальций назначается в дозе 1500 мг в день.
При лечении препаратами кальция необходимо учитывать характер пищи. Если употребляется большое количество продуктов, содержащих много кальция, дозы препаратов кальция должны быть меньше. При лечении витамином D и кальцием необходимо следить за концентрацией кальция в сыворотке и, если возможно — ПТГ, чтобы избежать передозировки витамина D.
Клинические проявления интоксикации, вызванной витамином D, подобны клиническим проявлениям гиперпаратиреоза разной степени выраженности, так как являются следствием гиперкальциемии. При лечении препаратами витамина D короткого действия — кальцитриол — интоксикация легко устраняется кратковременной отменой препарата. Длительнодействующий препарат витамина D — эргокальциферол, который медленно накапливается, может привести к длительной интоксикации.
3) Эстрогены. Установлено, что эстрогены тормозят резорбцию кости, увеличивают минеральную плотность кости и уменьшают частоту переломов. Свое действие эстрогены оказывают путем подавления секреции остеобластами интер- лейкина-6 (ИЛ-6), который стимулирует активность остеокластов и секрецию остеокласты стимулирующего фактора. В результате уменьшается количество и активность остеокластов и резорбция кости. Минимальная доза эстрогенов, которая подавляет резорбцию кости, составляет 0,625 мг конъюгированного эстрогена в день или его эквивалентов. Лечение эстрогенами в течение 3 лет может увеличить минеральную плотность кости на 5%. Длительное лечение эстрогенами, в течение 10 лет, у 95% женщин подавляет резорбцию кости. При наличии у женщины интактной матки, к эстрогенам присоединяют прогестины. Если матка удалена, прогестины не требуются. Женщин пожилого возраста (старше 60 лет) также можно лечить эстрогенами, но в меньших дозах — 0,3 мг конъюгированного эстрогена в день.
Противопоказания для лечения эстрогенами: рак молочной железы или наличие факторов высокого риска его развития, рак эндометрия, тяжело протекающие артериальная гипертензия и ИБС, тромбофлебит, тромбозы.
4) Селективные эстрогеновые модуляторы. Это химические вещества, которые на одни ткани — кости, печень, матку — действуют как эстрогены (агонисты), а на другие — молочные железы, мозг — действуют как антиэстрогены (возможно, путем связывания в них рецепторов эстрогенов). К таким препаратам относятся тамоксифен и ралоксифен. Однако между ними есть различия. Ралоксифен обладает более выраженным эффектом как агонист эстрогенов на кости и печень, но интактен в отношении матки по сравнению с тамоксифеном. Он является и более сильным антиэстрогеном в действии на молочную железу. Под влиянием лечения тамоксифеном и особенно ралоксифеном уменьшается частота переломов костей
и повышается минеральная плотность костей. Кроме того, эти препараты снижают концентрацию липопротеинов низкой плотности и холестерина в сыворотке крови.
Калъцитонин ингибирует активность остеокластов и этим путем уменьшает резорбцию кости. При лечении кальцитонином минеральная плотность кости увеличивается на 10—15%. Для лечения остеопороза используется кальцитонин лосося в виде инъекций, но может использоваться в виде порошка для вдыхания в нос. Лечение кальцитонином показано в случаях наличия противопоказаний для лечения эстрогенами или ралоксифеном.
Бифосфонаты. Препараты бифосфонатов подавляют резорбцию кости, увеличивают минеральную плотность, уменьшают частоту переломов, предотвращают «сплющивание» позвонков и уменьшение роста. Существует целый ряд препаратов бифосфонатов. Наиболее предпочтительным для лечения остеопороза является алендронат (фосатакс). Его можно использовать в сочетании с эстрогенами. Алендро-натом лечат глюкокортикоид-индуцированный остеопороз. Для лучшего всасывания алендронат в дозе 10 мг принимают утром натощак, запивая водой, за 30 мин до еды. Не рекомендуется лежать в течение получаса после еды для предотвращения раздражения пищевода. Могут использоваться другие препараты бифосфонатов — риседро-нат, памидронат.
Препараты, стимулирующие образование кости: 1) Андрогены. Лечение тестостероном остеопороза у женщин ограничено из-за развития гирсутизма и вирилизации. Лечение тестостероном у мужчин проводится при наличии гипогонадизма.
2) Флюориды (фторсодержащие препараты). Оказывают стимулирующее действие на остеобласты, увеличивают минеральную плотность костей и уменьшают частоту переломов костей. Наиболее часто используется фторид натрия (оссеин) в виде драже, содержащий 40 мг оссеина. Это препарат пролонгированного действия и принимается по 1 табл. утром и вечером после еды, не разжевывая. Прием фторида натрия может быть непрерывным в течение года или курсами по 3 мес. с перерывами.
Жиры и клетчатка, содержащиеся в пище - важное значение в изменении путей поглощения организмом минеральных веществ в кишечнике. Сейчас известно, что короткоцепочечные ненасыщенные жирные кислоты не подавляют абсорбцию, а имеют тенденцию улучшать ее. С другой стороны, диеты, состоящие из грубоволокнистой клетчатки, все же действительно имеют тенденцию ограничивать поглощение кальция в кишечнике, хотя они снижают уровень холестерина в крови.
Для того, чтобы происходила абсорбция в кишечнике должен присутствовать биологически активный витамин Д. 1,25 дигидроксивитамин ДЗ образуется в почках под влиянием ПТГ в ответ на снижение уровней кальция в крови. Бор стимулирует повышенные уровни 17-эстродила в крови и имеет тот же самый эффект, что и гормон эстроген. Этот эффект был замечен у женщин, у которых были остеопоротические изменения и так же пониженное содержание магния. В присутствии повышенного потребления магния ответная реакция на бор значительно уменьшается.
Бор имеет дополнительное влияние на уменьшение экскреции магния и фосфора с мочой, одновременно он так же сокращает потери кальция.
Пища, должна содержать более высокие уровни магния, с одновременным приемом добавок бора и кальция для усиления эффекта (шпинат и ломкая фасоль имеют более высокий процент магния, чем кальция, и могут повысить содержание магния в организме).
Белки и цинк. Было показано, что диета с высоким содержанием животных белков увеличивает потери кальция с мочой. Растительные белки в виде соевой муки не приводят к этому. Белки создают возникающий после приема пищи гиперинсунилизм. А инсулин усиливает диурез.
Цинк. Недостаток цинка отрицательно влияет на использование организмом кальция из-за многих зависимых от цинка ферментов, требуемых для правильного функционирования метаболизма кальция. Абсорбция кальция в кишечнике, даже в присутствии витамина Д, уменьшается при наличии высоких уровней содержания цинка. Необходим цинк. При этом следует принимать во внимание тенденцию цинка при высоком его содержании ингибировать абсорбцию кальция в кишечнике
