
- •Методичні вказівки
- •Зміст модуля I
- •1. Основні хімічні поняття і стехіометричні закони
- •1.1. Предмет хімії і основні хімічні поняття
- •1.2. Основні закони хімічної взаємодії
- •1.3. Запитання для самоконтролю
- •1.4. Задачі для самоконтролю
- •2. Основні класи неорганічних сполук
- •2.1. Оксиди
- •2.2. Гідрати оксидів
- •2.2.1. Основи
- •2.2.2. Амфотерні гідроксиди
- •2.2.3. Кислоти
- •2.4. Запитання для самоконтролю
- •2.4. Задачі для самоконтролю
- •3. Будова атома. Періодичний закон д.І.Менделєєва
- •3.1. Загальні уявлення про будову атома, природа електрона і характеристики його стану в атомі
- •3.2. Квантові числа
- •3.3. Розподіл електронів в атомі, електронні й електронно-графічні формули елементів
- •3.4. Періодичний закон та періодична система елементів д.І.Менделєєва
- •3.5. Радіуси атомів та йонів елементів
- •3.6. Закономірності зміни енергетичних характеристик елементів.
- •Енергія йонізації
- •Енергія спорідненості до електрона
- •Електронегативність атомів
- •3.7. Запитання для самоконтролю
- •3.8. Задачі для самоконтролю
- •4. Хімічний зв’язок. Кристалічний стан речовин
- •4.1. Основні типи хімічного зв’язку. Ковалентний зв’язок
- •4.2. Іонний зв'язок
- •4.3. Металічний зв'язок
- •4.4. Водневий зв'язок
- •4.5. Міжмолекулярна взаємодія
- •4.6. Тверді тіла. Типи кристалічних граток
- •4.7. Запитання та задачі для самоконтролю
- •5. Основи хімічної термодинаміки
- •5.1. Основні термодинамічні поняття
- •5.2. Термохімія.
- •5.3. Напрям перебігу хімічних процесів.
- •5.4. Питання для самоконтролю
- •5.5. Задачі і вправи для самостійної роботи
- •6.Хімічна кінетика і рівновага
- •6.1. Загальні уявлення про швидкість хімічних реакцій
- •6.3. Закон діючих мас
- •6.4. Енергія активації
- •6.5. Вплив температури на швидкість реакції
- •6.6. Каталіз
- •6.7. Хімічна рівновага
- •6.8. Вплив зовнішніх факторів на хімічну рівновагу. Принцип ле Шательє
- •6.9. Запитання та задачі для самоконтролю
- •Список рекомендованої літератури
2.2.3. Кислоти
За теорією електролітичної дисоціації Арреніуса кислоти - це сполуки, що складаються з кислотного залишку і йонів гідрогену, здатних заміщуватись на метал (у розчині дисоціюють з утворенням катіонів тільки гідрогену). Кількість таких йонів гідрогену визначає основність кислоти: НС1, HNO3 – одноосновні, H2SO4, H2CO3 - двоосновні, Н3РО4- триосновна і т.д. Кислоти, до складу яких входять атоми оксигену, називають кисневими, якщо атоми оксигену відсутні - безкисневими.
Назви безкисневих кислот походять від назв елементів, що їх утворюють, або від міжнародних назв кислотних залишків з закінченням -на: НС1 - хлороводнева або хлоридна (тривіальна назва - соляна), H2S - сірководнева або сульфідна, HF - флуороводнева або фторидна (тривіальна назва - плавикова).
Згідно з правилами IUPAC назви кисневих кислот також походять під міжнародних назв відповідних кислотних залишків з додаванням закінчення -на: НС1О4 - хлоратна; H2SO4 -сульфатна; H2SO3 -сульфітна; HNO3, -нітратна; HNO2 -нітритна і т.д. Однак в хімічній літературі та побуті на сьогоднішній день ще досить часто зустрічаються загальновживані раніше назви кисневих кислот. Основу цих назв складають найменування центрального атома - елемента, навкруг якого розміщені атоми оксигену і гідрогену. Причому, якщо ступінь окиснення цього елемента відповідає номеру групи, в якій він знаходиться, назва кислоти має закінчення -на (-ва), якщо ступінь окиснення менший від номера групи, закінчення -иста.
![]() - хлорна
- хлорна
![]() -
сірчана
-
сірчана
![]() - ванадієва
- ванадієва
![]() - хлориста
- хлориста
![]() -
сірчиста
-
сірчиста
![]() - азотиста
- азотиста
Але є кислоти, утворені одним і тим же елементом з однаковим ступенем окиснення, але до їх складу входить різна кількість атомів гідрогену і оксигену. Тоді там, де цих атомів менше, до назви кислоти додають префікс "мета", а де найбільше - "орто": H2SiO3 - метасилікатна (метакремнієва), H4SiO4 - ортосилікатна (ортокремнієва).
В графічних формулах безкисневих кислот атоми гідрогену зв'язані безпосередньо з атомом елемента, який утворив кислоту: Н-С1, H-S-H, H-F, а в кисневих кислотах атоми гідрогену, що визначають основність кислоти, сполучають з атомами оксигену, які в свою чергу з'єднують з центральним атомом:
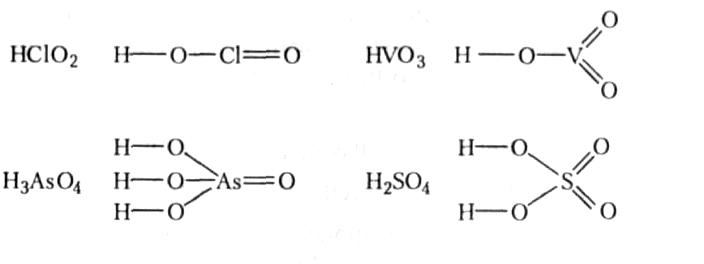
Хімічні властивості кислот зумовлені йонами гідрогену (точніше - гідроксонію Н3О+), що утворюються при розчиненні й дисоціації кислот у воді. Ці ж йони зумовлюють кислий смак розчину і забарвлення індикатора в характерний колір. Оскільки атоми гідрогену зв'язані з кислотним залишком досить міцним ковалентним зв'язком, на йони дисоціюють не всі молекули кислоти, а процес дисоціації - оборотний.
При взаємодії кислот з основами та оксидами (основними й амфотерними) обов'язковими продуктами реакцій є сіль і вода. Кислоти взаємодіють також з солями. Такі реакції протікають з утворенням малорозчинних або летких продуктів, а також коли більш сильна кислота витискує більш слабку:
H2S + Pb(NO3)2 = 2HNO3 + PbS↓
2HNO3 + СаСО3 = Са(NO3)2 + Н2О+СО2↑
HCl + CH3COONa= NaCl+CH3COOH
Важливою властивістю кислот є їх взаємодія з металами. Характер взаємодії залежить від активності металу і температури, а для деяких кислот – визначається їх особливою окисною функцією. Активні метали, що в ряді стандартних електродних потенціалів стоять до водню, витискують його з кислот:
2A1 + 3H2S04 = A12(S04)3 + 3H2↑
Zn + 2HCl = ZnCl2 + H2↑
Малоактивні ж метали, що стоять після водню, з кислотами, як правило, не взаємодіють за винятком азотної та концентрованої сірчаної кислот, які реагують як з активними, так і деякими неактивними металами, але виділяється при цьому не водень, а продукти відновлення нітрогену(азоту) чи сульфуру(сірки):
Cu (Zn та ін.) + 4HNO3 = Сu(NО3)2 + 2NО2 + 2Н2О
Си + 2H2SO4(к.) = CuSO4 + S02 + 2Н2О
Більшість кисневих кислот одержують взаємодією кислотних оксидів з водою. Кислоти, ангідриди яких з водою не реагують, добувають із відповідних солей за реакціями обміну:
Na2SiO3 + H2SO4 = Na2SO4 + H2SiO3↓
(NH4)2MoQ4 + 2HNO3 = 2NH4N03 + H2MoO4↓
Так можна одержувати й інші кислоти, однак слід пам'ятати, що такі реакції протікають тільки тоді, коли виділяються газоподібні, малорозчинні чи малодисоційовані речовини.
2.3. Солі
Солі визначають або як продукт заміщення атомів гідрогену кислоти на метал, або як продукт нейтралізації кислоти основою. Як правило, це йонні сполуки, які при розчиненні у воді легко дисоціюють на катіони (металу, амонію) і аніони кислотного залишку. Розрізняють солі середні, кислі, основні, комплексні та деякі інші.
Середні солі - це продукт повної нейтралізації кислоти основою:
Н3РО4 + 3NaOH = Na3PO4 + ЗН2О
Кислі солі - продукт неповної нейтралізації багатоосновної кислоти основою:
Н3Р04 +2NaOH=Na2HP04 +2Н2О H3P04+NaOH=NaH2P04 + H20
Основні солі - продукт неповної нейтралізації багатокислотної основи кислотою:
Mg(OH)2 + HCl = MgOHCl + H20
Комплексні солі - численний клас сполук, до складу яких входять комплексні йони, утворені за донорно-акцепторним механізмом зв'язку:
Na[Al(OH)4]; K3[Fe(CN)6]; [Cu(NH3)4]SO4
Номенклатура солей включає назви катіона і кислотного залишку. Спочатку називають кислотний залишок, причому слід давати його міжнародну назву, а потім катіон в родовому відмінку із ступенем окиснення в разі потреби:
АІСІ3 -хлорид алюмінію Са3(РО4)2 - ортофосфат кальцію Na2S - сульфід натрію NaPO3 - метафосфат натрію Li2SO3 - сульфіт літію Ва(АІО2)2 - метаалюмінат барію FeSO4 -сульфатферуму(ІІ) КMnО4 - манганат(VІІ) калію Cr(NO3)3-нітрат хрому (III) Ag2CrO4 - хромат аргентуму NH4NO2 -нітрит амонію К[АІ(ОН)4] - тетрагідроксоалюмінат калію
В кислих солях до назви кислотного залишку включають початок найменування гідрогену - "гідро", а в основних - назву гідроксильної групи "гідроксо":
Mg(HCO3)2 - гідрокарбонат магнію КН2РО4- дигідрофосфат калію (СиОН)2СО3-гідроксокарбонат міді(II); АІ(ОН)2СІ–дигідроксохлорид алюмінію
Найважливіші реакції утворення солей були розглянуті при вивченні оксидів, кислот і основ. Перегляньте ще раз цей матеріал і випишіть рівняння відповідних реакцій. Допоможе вам в цьому й схема генетичного зв'язку між класами неорганічних сполук (рис.2.2).
З хімічних властивостей найбільш характерні реакції взаємодії солей з металами і неметалами, кислотами і лугами, з водою та іншими солями, а також розклад солей при нагріванні:
1) Fe + CuSO4 = FeSO4 + Cu
2AgNO3+Cu=Cu(N03)2 + 2Ag
2) 2KBr + CI2 = 2KCI + Br2
2KI + Br2 = 2KBr + H2
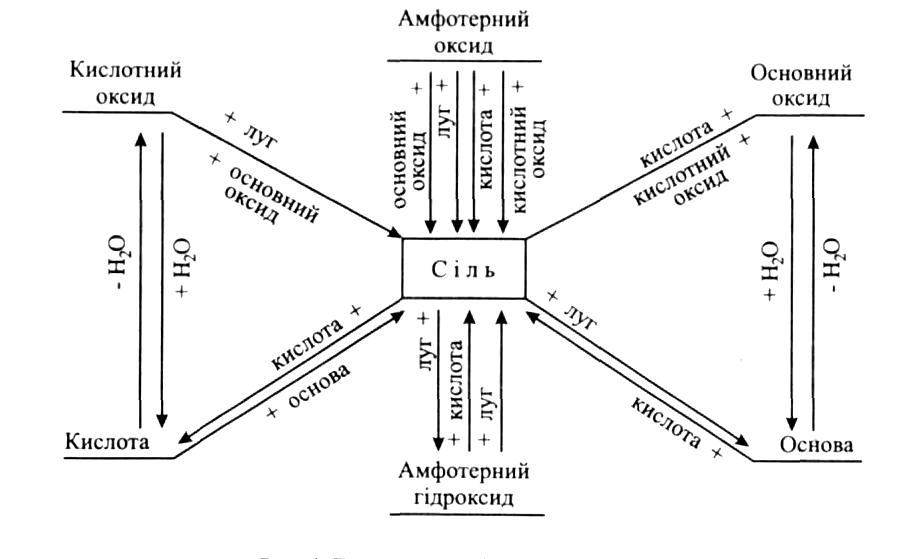
Рис.2.2. Генетичний зв'язок між класами неорганічних сполук
3) Na2CO3 + 2СН3СООН =2CH3COONa + H2O + CO2
Ca3(P04)2 + 2H2S04 = 2CaS04 + Ca(HzPO4)2
4) K2CO3 + Ba(OH)2 = BaCO3↓ + 2KOH
FeCl3 + 3KOH = 3KC1 + Fe(OH)3
5) Pb(NO3)2 + K2S = 2KNO3 + PbS↓
AgNO3 + KI = KNO3 +AgI↓
6) 2NaHCO3 Na2CO3 + H2O + CO2
4KC1O3 KC1 + 3KC1O4
7) CuSO4 + 5H2O = CuSO4·5H2O - утворення кристалогідратів
8) K2SO3 + H2O ↔ KHSO3 + KOH - гідроліз
ZnCl2 + H2O ↔ ZnOHCl + HCl
CH3COONH4 + H2O ↔CH3COOH + NH4OH
