
- •Методичні вказівки
- •Зміст модуля I
- •1. Основні хімічні поняття і стехіометричні закони
- •1.1. Предмет хімії і основні хімічні поняття
- •1.2. Основні закони хімічної взаємодії
- •1.3. Запитання для самоконтролю
- •1.4. Задачі для самоконтролю
- •2. Основні класи неорганічних сполук
- •2.1. Оксиди
- •2.2. Гідрати оксидів
- •2.2.1. Основи
- •2.2.2. Амфотерні гідроксиди
- •2.2.3. Кислоти
- •2.4. Запитання для самоконтролю
- •2.4. Задачі для самоконтролю
- •3. Будова атома. Періодичний закон д.І.Менделєєва
- •3.1. Загальні уявлення про будову атома, природа електрона і характеристики його стану в атомі
- •3.2. Квантові числа
- •3.3. Розподіл електронів в атомі, електронні й електронно-графічні формули елементів
- •3.4. Періодичний закон та періодична система елементів д.І.Менделєєва
- •3.5. Радіуси атомів та йонів елементів
- •3.6. Закономірності зміни енергетичних характеристик елементів.
- •Енергія йонізації
- •Енергія спорідненості до електрона
- •Електронегативність атомів
- •3.7. Запитання для самоконтролю
- •3.8. Задачі для самоконтролю
- •4. Хімічний зв’язок. Кристалічний стан речовин
- •4.1. Основні типи хімічного зв’язку. Ковалентний зв’язок
- •4.2. Іонний зв'язок
- •4.3. Металічний зв'язок
- •4.4. Водневий зв'язок
- •4.5. Міжмолекулярна взаємодія
- •4.6. Тверді тіла. Типи кристалічних граток
- •4.7. Запитання та задачі для самоконтролю
- •5. Основи хімічної термодинаміки
- •5.1. Основні термодинамічні поняття
- •5.2. Термохімія.
- •5.3. Напрям перебігу хімічних процесів.
- •5.4. Питання для самоконтролю
- •5.5. Задачі і вправи для самостійної роботи
- •6.Хімічна кінетика і рівновага
- •6.1. Загальні уявлення про швидкість хімічних реакцій
- •6.3. Закон діючих мас
- •6.4. Енергія активації
- •6.5. Вплив температури на швидкість реакції
- •6.6. Каталіз
- •6.7. Хімічна рівновага
- •6.8. Вплив зовнішніх факторів на хімічну рівновагу. Принцип ле Шательє
- •6.9. Запитання та задачі для самоконтролю
- •Список рекомендованої літератури
6.5. Вплив температури на швидкість реакції
Підвищення температури реагуючих речовин внаслідок збільшення швидкості молекул приводить до зростання загальної енергії системи і відповідно до збільшення відносного вмісту активних молекул, що рівнозначно зростанню швидкості хімічної реакції. Вплив температури і енергії активації на швидкість хімічних реакцій можна виразити за допомогою залежності константи швидкості реакції k від температури Т і ∆Еакт:
![]() ,
(6.4)
,
(6.4)
де А — множник Арреніуса, пропорційний числу зіткнень молекул.
Якщо концентрації реагуючих речовин дорівнюють 1 моль/л, то рівняння Арреніуса (6.4) дає змогу виразити залежність швидкості реакцій від температури:
![]() (6.5)
(6.5)
Оскільки в рівнянні (6.5) температура входить у показник степені, то швидкість хімічних реакцій дуже залежить від зміни температури.
Експериментально встановлено, що залежність швидкості хімічної реакції від температури можна виразити у вигляді емпіричного правила Вант-Гоффа: підвищення температури на кожні 10 градусів збільшує швидкість реакції приблизно в 2—4 рази.
У математичній формі правило Вант-Гоффа записується так:
![]() (6.6)
(6.6)
де ∆to— збільшення температури; v1 — швидкість реакції до підвищення температури; v2— швидкість реакції після підвищення температури (при температурі t2); γ— температурний коефіцієнт швидкості реакції (γ == 2—4).
Рівняння (6.6) є приблизним, тому що швидкість реакції крім температури залежить також від енергії активації ∆Еакт, яка, в свою чергу, залежить від температури.
6.6. Каталіз
Швидкість хімічних процесів можна значно збільшити завдяки введенню у реакційну систему певних речовин, які називаються каталізаторами. Каталізатор — це речовина, що збільшує швидкість реакції, кількісно і якісно при цьому не змінюючись.
Речовини, які уповільнюють швидкість хімічних процесів, а самі при цьому не змінюються, називаються інгібіторами.
З наведеного визначення може здатись, що каталізатор не бере участі в хімічній взаємодії речовин. Експериментально доведено, що каталізатор тільки кількісно не змінюється під час реакції, але бере участь у проміжних стадіях хімічної взаємодії і саме завдяки ньому збільшує. швидкість хімічних реакцій.
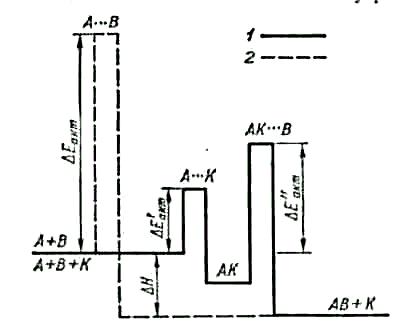
Механізм дії каталізаторів різний. Найпоширенішою формою дії каталізатора є утворення проміжних сполук з реагуючими речовинами. Зміна швидкості при цьому пояснюється зменшенням енергії активації. Розглянемо механізм дії каталізатора з погляду утворення проміжних сполук на прикладі взаємодії речовин А і В з утворенням сполуки АВ. Нехайё сполука утворюється через активний комплекс А---В, енергія активації якого ∆Еакт:
∆Еакт
А+В → А ••• В → АВ.
 Як
правило, для каталітичних процесів
енергія активації ∆Еакт
має досить високе значення. Тому
речовини А і В взаємодіють з дуже малою
швидкістю або зовсім не взаємодіють.
Можливий інший спосіб утворення сполуки
АВ. Нехай є речовина К, яка дуже легко
вступає у взаємодію з речовиною А:
Як
правило, для каталітичних процесів
енергія активації ∆Еакт
має досить високе значення. Тому
речовини А і В взаємодіють з дуже малою
швидкістю або зовсім не взаємодіють.
Можливий інший спосіб утворення сполуки
АВ. Нехай є речовина К, яка дуже легко
вступає у взаємодію з речовиною А:
∆
Рис.
6.3. Енергетична
схема взаємодії речо
вин
А і В з каталізатором К
(/) та без
ка талізатора
(2)
А+К → А ••• К → АК
Легкість взаємодії А і К означає, що енергія її активації ∆Е/акт мала, а швидкість велика. В свою чергу, сполука АК легко взаємодіє з речовиною В, утворюючи АВ і К:
∆Е//акт
АК + В → АК ••• В → АВ + К.
Отже, внаслідок реакції речовина (каталізатор) залишилась без зміни і утворилась сполука АВ. Енергетична схема двох способів взаємодії А і В (рис.6.3) показує, що при наявності каталізатора енергія активації реакції зменшується. Відповідно до рівняння (6.5) енергія активації входить у показник степеня з від'ємним знаком і тому навіть незначна її зміна приводить до значного збільшення швидкості реакції.
За своїм агрегатним станом каталізатори можуть бути твердими (Pt, Fe, Co, Ni, V2O5), рідкими і газоподібними (NО2). У зв'язку з цим каталітичні процеси поділяють на гомогенні і гетерогенні.
При гомогенному каталізі всі реагуючі речовини і каталізатор утворюють одну фазу (газоподібну або рідку). Прикладом гомогенного каталізу є окислення CO в газоподібній фазі при наявності пари води як каталізатора. Основою добування сірчаної кислоти баштовим методом також є гомогенна каталітична реакція
H2SO3 + NO2 = H2SO4 + NO,
яка може відбуватися як у рідкій, так і в газоподібній фазах.
При гетерогенному каталізі каталізатор утворює самостійну, як правило, тверду фазу, на поверхні якої відбуваються каталітичні процеси. Прикладом гетерогенного каталітичного процесу може бути окислення SO2 до SO3 на поверхні V2O5.
Важливою особливістю каталітичних процесів є специфічність дії каталізатора. Крім каталізаторів, здатних прискорювати лише одну реакцію, є каталізатори, які прискорюють цілу групу аналогічних реакцій. Наприклад, платина, нікель ї паладій досить добре каталізують реакції приєднання водню. Залежно від природи каталізатора, можна спрямувати взаємодію тих самих речовин у різному напрямі. Так, при наявності АІ2О3 метиловий спирт розкладається на Н2О і С2Н2, а при наявності залізо-мідного каталізатора СН3ОН утворює альдегід і водень.
Каталітичні процеси мають велике практичне значення. Значна частина продуктів сучасної хімічної промисловості виробляється на основі каталітичних реакцій. До каталітичних процесів належать синтез аміаку (каталізатор залізо) і метанолу, окислення SO2 до SO3(каталізатор V2O5), окислення МН3 до NO (каталізатор платина), добування поліетилену та інших полімерних матеріалів. Велику роль відіграють каталізатори в фізіологічних процесах, що відбуваються в рослинних і тваринних клітинах. Як каталізатори в живих клітинах виступають різного типу ферменти.
