
- •Методичні вказівки
- •Зміст модуля I
- •1. Основні хімічні поняття і стехіометричні закони
- •1.1. Предмет хімії і основні хімічні поняття
- •1.2. Основні закони хімічної взаємодії
- •1.3. Запитання для самоконтролю
- •1.4. Задачі для самоконтролю
- •2. Основні класи неорганічних сполук
- •2.1. Оксиди
- •2.2. Гідрати оксидів
- •2.2.1. Основи
- •2.2.2. Амфотерні гідроксиди
- •2.2.3. Кислоти
- •2.4. Запитання для самоконтролю
- •2.4. Задачі для самоконтролю
- •3. Будова атома. Періодичний закон д.І.Менделєєва
- •3.1. Загальні уявлення про будову атома, природа електрона і характеристики його стану в атомі
- •3.2. Квантові числа
- •3.3. Розподіл електронів в атомі, електронні й електронно-графічні формули елементів
- •3.4. Періодичний закон та періодична система елементів д.І.Менделєєва
- •3.5. Радіуси атомів та йонів елементів
- •3.6. Закономірності зміни енергетичних характеристик елементів.
- •Енергія йонізації
- •Енергія спорідненості до електрона
- •Електронегативність атомів
- •3.7. Запитання для самоконтролю
- •3.8. Задачі для самоконтролю
- •4. Хімічний зв’язок. Кристалічний стан речовин
- •4.1. Основні типи хімічного зв’язку. Ковалентний зв’язок
- •4.2. Іонний зв'язок
- •4.3. Металічний зв'язок
- •4.4. Водневий зв'язок
- •4.5. Міжмолекулярна взаємодія
- •4.6. Тверді тіла. Типи кристалічних граток
- •4.7. Запитання та задачі для самоконтролю
- •5. Основи хімічної термодинаміки
- •5.1. Основні термодинамічні поняття
- •5.2. Термохімія.
- •5.3. Напрям перебігу хімічних процесів.
- •5.4. Питання для самоконтролю
- •5.5. Задачі і вправи для самостійної роботи
- •6.Хімічна кінетика і рівновага
- •6.1. Загальні уявлення про швидкість хімічних реакцій
- •6.3. Закон діючих мас
- •6.4. Енергія активації
- •6.5. Вплив температури на швидкість реакції
- •6.6. Каталіз
- •6.7. Хімічна рівновага
- •6.8. Вплив зовнішніх факторів на хімічну рівновагу. Принцип ле Шательє
- •6.9. Запитання та задачі для самоконтролю
- •Список рекомендованої літератури
5.2. Термохімія.
Теплові
ефекти хімічних процесів вивчає
термохімія. При розрахунках використовуються
стандартні теплові ефекти
![]() ,
тобто визначені за стандартних умов
(за температури 298,15 К і тиску 101,3 кПа).
Рівняння реакцій, в яких зазначено
тепловий ефект, а також агрегатний стан
речовин, називають термохімічними.
З такими рівняннями можна виконувати
ті ж дії, що і з алгебраїчними (складати,
віднімати, помножувати на коефіцієнт
тощо).
,
тобто визначені за стандартних умов
(за температури 298,15 К і тиску 101,3 кПа).
Рівняння реакцій, в яких зазначено
тепловий ефект, а також агрегатний стан
речовин, називають термохімічними.
З такими рівняннями можна виконувати
ті ж дії, що і з алгебраїчними (складати,
віднімати, помножувати на коефіцієнт
тощо).
Усі термохімічні розрахунки базуються на двох законах термохімії.
Перший закон термохімії – закон Лавуазьє і Лапласа (1760) формулюється так: Тепловий ефект утворення хімічної сполуки дорівнює тепловому ефекту розкладання цієї сполуки тільки із зворотним знаком.
Наприклад, при утворенні 1 моль води із водню і кисню виділяться 241,8 кДж/моль.
![]() кДж/моль
кДж/моль
Таку саму енергію треба затратити, щоб розкласти 1 моль пароподібної води на водень і кисень, тобто
![]() кДж/моль
кДж/моль
Теплота утворення – це тепловий ефект реакції утворення 1 моль даної сполуки з простих речовин, найстійкіших за даних умов.
![]() ,
,
![]() ,0
кДж/моль
,0
кДж/моль
Теплота
утворення, віднесена до 1 моль речовини
за температури 298 К і тиску 101 кПа (760 мм
рт. ст.), називається стандартною теплотою
утворення і позначається
![]() .
.
Значення стандартних теплот утворення багатьох хімічних сполук визначені й зведені в таблиці термодинамічних величин і наводяться в довідниках.
Теплота
утворення (ентальпія утворення) простих
речовин у стійкому стані за стандартних
умов має нульове значення. Наприклад,
![]() ,
,![]()
![]()
![]() .
.
Другий закон термохімії – закон Гесса (основний закон термохімії) (1840) формулюється так: Тепловий ефект хімічної реакції не залежить від характеру й послідовності її стадій, а визначається лише початковими і кінцевими продуктами реакції та їх фізичним станом (при V=const або P=const).
Наприклад, при згорянні 1 моль графіту з утворенням вуглекислого газу (СО2) виділяється 393,0 кДж теплоти. Якщо процес провести через проміжну стадію з утворенням СО і подальшим його згорянням до СО2, то в першому випадку (утворення СО) виділяється 110,5 кДж теплоти, а в другому (утворення СО2 з СО) виділяється 282,5 кДж.
Із цього прикладу видно, що сума теплових ефектів проміжних реакцій (110,5+282,5=393,0 кДж/моль) дорівнює тепловому ефекту прямої реакції.
Примітка: Закон Гесса застосовують до процесів, що відбуваються при постійному об’ємі або при постійному тиску.
Наслідки із закону Гесса:
1.Тепловий ефект хімічної реакції ΔНох.р. дорівнює сумі теплот утворення продуктів реакції мінус сума теплот утворення вихідних речовин. Тобто для реакції
аА+вВ=сС+dD (5.3)
![]() (5.4)
(5.4)
Приклад.
Визначити тепловий ефект
![]() реакції Al2O3+3SO3=Al2(SO4)3,
якщо відомо, що
реакції Al2O3+3SO3=Al2(SO4)3,
якщо відомо, що
![]() =
-1675 кДж/моль;
=
-1675 кДж/моль;
![]() =
-395 кДж/моль;
=
-395 кДж/моль;
![]() =
-3434 кДж/моль.
=
-3434 кДж/моль.
Розв’язання. Згідно з рівнянням (5.4) маємо
![]() =-3434+1675+3·395,2=-553,4кДж
=-3434+1675+3·395,2=-553,4кДж
2.Тепловий ефект хімічної реакції ΔНх.р. дорівнює сумі теплот згорання вихідних речовин мінус сума теплот згорання продуктів реакції. Тобто для реакції(5.3)
![]() (5.5)
(5.5)
Стандартною теплотою (ентальпією) згоряння називається тепловий ефект реакції окислення 1 моль даної сполуки в атмосфері кисню до утворення вищих оксидів елементів, які входять до її складу, за стандартних умов. Значення стандартної ентальпії згоряння також можна найти в термодинамічних таблицях.
Із закону Гесса витікає ще кілька наслідків:
якщо здійснюються дві реакції, які приводять із різних початкових станів до однакових кінцевих станів, то різниця теплових ефектів дорівнює тепловому ефекту переходу з одного початкового стану в другий;
якщо здійснюються дві реакції, які приводять із однакових початкових станів до різних кінцевих станів, то різниця між їхніми тепловими ефектами дорівнює тепловому ефекту переходу з одного кінцевого стану в другий.
Таким чином, застосовуючи закон Гесса, можна обчислити теплові ефекти окремих реакцій, особливо проміжних стадій, які експериментальним шляхом визначити неможливо.
У термохімії визначають й інші теплові ефекти: теплоту розчинення, теплоту нейтралізації, теплоту плавлення та ін.
Теплота розчинення.
Багато хімічних реакцій перебігає у розчинах, і їх тепловий ефект залежить не тільки від енергії хімічної взаємодії самих речовин, але і від теплоти їх розчинення в розчиннику.
Теплота
розчинення твердої речовини в основному
є сумою двох величин: теплоти руйнування
кристалічної решітки (![]() >0)
та теплоти сольватації іонів молекулами
розчинника (
>0)
та теплоти сольватації іонів молекулами
розчинника (![]() <0):
<0):
![]() =
=![]() +
+
Знак сумарного теплового ефекту залежатиме від того, який із цих доданків більший за абсолютною величиною.
Теплота нейтралізації.
Теплота нейтралізації - тепловий ефект, який спостерігається при нейтралізації одного моль еквівалента кислоти одним моль еквівалента гідроксиду в розведених водних розчинах.
При взаємодії 1моль еквівалента сильної кислоти з 1моль еквівалента сильного гідроксиду в розведених водних розчинах виділяється майже однакова кількість теплоти
![]() =
-55,9 кДж/моль
(при 298 К).
=
-55,9 кДж/моль
(при 298 К).
Розглянемо для прикладу реакцію нейтралізації сильної кислоти сильною основою (лугом):
НС1 + NaOH = NaC I + Н2О,
або в іонній формі:
Н+ + Сl- + Na+ + ОН- = Na+ + Сl- + Н2О.
Після скорочення одержимо:
Н+ + ОН- = Н2О; = -55,9 кДж/моль.
Сталість теплот нейтралізації пов'язана з тим, що при взаємодії будь-якої сильної кислоти з будь-якою сильною основою, повністю дисоційованими у водних розчинах, у всіх випадках протікає однакова реакція: з іонів Н+ кислоти і іонів ОН- гідроксиду утворюються молекули води. Зрозуміло, що однаковим реакціям відповідає й однаковий тепловий ефект.
Нейтралізація
слабких кислот сильними основами або
сильних кислот слабкими основами
супроводжується одночасно дисоціацією
слабкого електроліту. При цьому
виділяється або поглинається теплота
дисоціації
![]() ,
яка залежить від кількості теплоти, що
поглинається при розпаді молекул
слабкого електроліту на іони й теплоти
сольватації іонів слабкого електроліту
молекулами розчинника. Залежно від
того, яка теплота з двох названих буде
більшою, теплота дисоціації може бути
додатною або від'ємною. Таким чином,
теплота нейтралізації слабких кислот
і гідроксидів складається із теплоти
утворення води з іонів Н+
і ОН-
(-55,9 кДж/моль) і теплоти дисоціації
слабкого електроліту
:
,
яка залежить від кількості теплоти, що
поглинається при розпаді молекул
слабкого електроліту на іони й теплоти
сольватації іонів слабкого електроліту
молекулами розчинника. Залежно від
того, яка теплота з двох названих буде
більшою, теплота дисоціації може бути
додатною або від'ємною. Таким чином,
теплота нейтралізації слабких кислот
і гідроксидів складається із теплоти
утворення води з іонів Н+
і ОН-
(-55,9 кДж/моль) і теплоти дисоціації
слабкого електроліту
:
= -55,9 + .
Теплоємність.
Загальна
теплоємність системи — це кількість
теплоти, яка потрібна
для підвищення температури системи на
один градус. Оскільки вона
є величиною екстенсивною, то більш
зручно користуватися теплоємністю,
віднесеною до одиниці кількості речовини.
В залежності від цього розрізняють
питому
(на
1 г чи 1 кг маси речовини)
та мольну
(на
1 моль) теплоємності. Їх
величини
залежать також
від умов нагрівання — СV
(при
V
= const)
та Ср
(р = const).
Теплоємність
залежить від природи речовини, а також
від температури, тому розрізняють
середню теплоємність
![]() (чи
(чи
![]() )
у заданому
інтервалі температур (від Т1
до
Т2)
та
істинну теплоємність Ср
(або
СV)
при
заданій температурі Т.
Середня
теплоємність
)
у заданому
інтервалі температур (від Т1
до
Т2)
та
істинну теплоємність Ср
(або
СV)
при
заданій температурі Т.
Середня
теплоємність
![]() ;
;
![]() .
.
а істинна теплоємність
![]() ;
;
![]()
Середня теплоємність наближається до істинної ( →Cр) при зменшенні температурного інтервалу, коли (Т2— Т1) —> 0. Для 1 моль ідеального газу Cр = CV +R (рівняння Майєра). Робота розширення 1 моль ідеального газу в різних процесах розраховується за формулами:
Ізобарний процес (p=const) |
Ізохорний процес (V=const) |
Ізотермічний процес (T=const) |
Адіабатичний процес (δQ=0) |
Ap=p(V2 - V1) pV=RT Wp=R(T2 - T1) |
dV=0 AV=0 |
AT=
RT |
δA=-dU; CV=dU/dT; dU= CV∙dT; δAQ=- CV∙dT; AQ= CV∙(T1 - T2); |
Температурну залежність Cр звичайно представляють у вигляді емпіричних рівнянь типу
Cр = а +bТ + cT 2 ; Cр = а +bТ + c′ T -2
та інших. У довідкових таблицях наводяться значення коефіцієнтів a, b, c, c′… та інтервал температур, для якого виправдовуються ці залежності.
Залежність теплового ефекту хімічних реакцій від температури описується рівнянням К.Кірхгофа в диференціальній
(d∆Hp/dT)p
= ∆Cp
та інтегральній
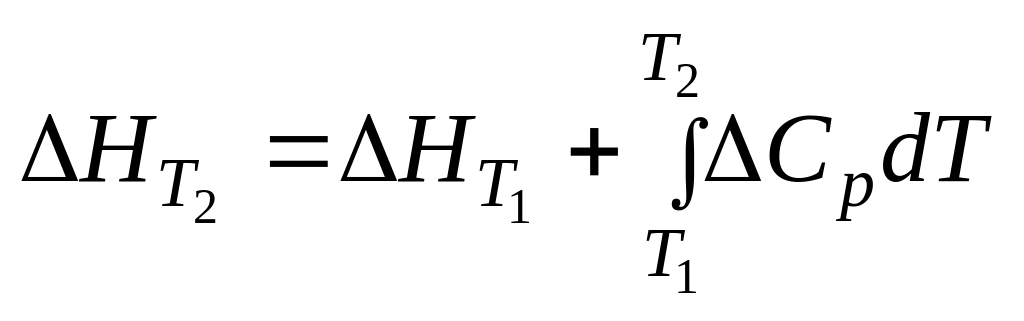 формах.
формах.
