
- •Методичні вказівки
- •Зміст модуля I
- •1. Основні хімічні поняття і стехіометричні закони
- •1.1. Предмет хімії і основні хімічні поняття
- •1.2. Основні закони хімічної взаємодії
- •1.3. Запитання для самоконтролю
- •1.4. Задачі для самоконтролю
- •2. Основні класи неорганічних сполук
- •2.1. Оксиди
- •2.2. Гідрати оксидів
- •2.2.1. Основи
- •2.2.2. Амфотерні гідроксиди
- •2.2.3. Кислоти
- •2.4. Запитання для самоконтролю
- •2.4. Задачі для самоконтролю
- •3. Будова атома. Періодичний закон д.І.Менделєєва
- •3.1. Загальні уявлення про будову атома, природа електрона і характеристики його стану в атомі
- •3.2. Квантові числа
- •3.3. Розподіл електронів в атомі, електронні й електронно-графічні формули елементів
- •3.4. Періодичний закон та періодична система елементів д.І.Менделєєва
- •3.5. Радіуси атомів та йонів елементів
- •3.6. Закономірності зміни енергетичних характеристик елементів.
- •Енергія йонізації
- •Енергія спорідненості до електрона
- •Електронегативність атомів
- •3.7. Запитання для самоконтролю
- •3.8. Задачі для самоконтролю
- •4. Хімічний зв’язок. Кристалічний стан речовин
- •4.1. Основні типи хімічного зв’язку. Ковалентний зв’язок
- •4.2. Іонний зв'язок
- •4.3. Металічний зв'язок
- •4.4. Водневий зв'язок
- •4.5. Міжмолекулярна взаємодія
- •4.6. Тверді тіла. Типи кристалічних граток
- •4.7. Запитання та задачі для самоконтролю
- •5. Основи хімічної термодинаміки
- •5.1. Основні термодинамічні поняття
- •5.2. Термохімія.
- •5.3. Напрям перебігу хімічних процесів.
- •5.4. Питання для самоконтролю
- •5.5. Задачі і вправи для самостійної роботи
- •6.Хімічна кінетика і рівновага
- •6.1. Загальні уявлення про швидкість хімічних реакцій
- •6.3. Закон діючих мас
- •6.4. Енергія активації
- •6.5. Вплив температури на швидкість реакції
- •6.6. Каталіз
- •6.7. Хімічна рівновага
- •6.8. Вплив зовнішніх факторів на хімічну рівновагу. Принцип ле Шательє
- •6.9. Запитання та задачі для самоконтролю
- •Список рекомендованої літератури
6.7. Хімічна рівновага
При вивченні основних закономірностей рівноважних процесів насамперед розглядають поняття про оборотні і необоротні реакції і оборотність хімічних процесів.
Необоротними хімічними реакціями називаються реакції, які відбуваються лише в одному напрямі. З погляду термодинаміки, відповідно до рівняння для ізобарного потенціалу ∆G=∆H-T∆S необоротні процеси відбуваються із зменшенням ентальпії (—∆H) і збільшенням ентропії (+∆S). Це означає, що ізобарний потенціал ∆G за будь-яких умов (концентрація реагуючих речовин і температура) завжди матиме від'ємне значення і реакція відбуватиметься тільки в одному напрямі.
До необоротних реакцій належать, наприклад, розкладання перманганату калію при нагріванні:
2КМп04 = К2МпО4 + МпО2 + 02,
розкладання бертолетової солі за рівнянням
2КС103=2КС1+302,
або взаємодія лужних металів з водою за рівнянням
2К + Н2О = 2КОН + Н2
та багато інших процесів.
Оборотними називаються реакції, які можуть відбуватися в прямому і в зворотному напрямах. Оборотні реакції відбуваються, як правило, із зменшенням ентальпії (—∆H )і ентропії (—∆S) системи. З рівняння ∆G=∆H-T∆S видно, що залежно від температури величина ізобарного потенціалу ∆G може мати або від'ємне (переважає ентальпійний фактор), або при високих температурах додатне значення (переважає ентропійний фактор). Для таких процесів за певних умов можлива пряма реакція або зворотна.
Рис.
6.4. Зміна
швидкості прямої V1
та зворотної V2
реакцій. Розглянемо докладніше оборотні
реакції, які одночасно за певних умов
відбуваються в обох напрямах. До таких
реакцій, як уже зазначалось, належить
взаємодія Н2 і І2 при
300—400° С:
Розглянемо докладніше оборотні
реакції, які одночасно за певних умов
відбуваються в обох напрямах. До таких
реакцій, як уже зазначалось, належить
взаємодія Н2 і І2 при
300—400° С:
Н2 + І2 ⇄2НІ
У перший момент швидкість прямої реакції
![]()
визначається початковими концентраціями вихідних речовин. Швидкість зворотної реакції при цьому дорівнює нулю. В міру взаємодії Н2 і I2 і утворення НІ швидкість прямої реакції зменшуватиметься, а швидкість зворотної реакції
![]()
зростатиме. Через деякий час швидкості прямої і зворотної реакцій зрівняються (рис.6.4). При цьому кількість утворених молекул НІ дорівнюватиме кількості молекул НІ, яка розклалася. Тобто концентрації всіх речовин у момент, коли швидкості прямої і зворотної реакцій однакові, не змінюються. Такий стан реакційної системи називається хімічною рівновагою. При хімічній рівновазі склад системи не змінюється, оскільки в системі відбувається хімічна взаємодія в обох напрямах з однаковою швидкістю. Тому хімічна рівновага має також назву динамічної рівноваги.
У момент хімічної рівноваги, коли швидкості прямої і зворотної реакцій однакові, можна записати:
![]() або
або
![]() , звідки
, звідки
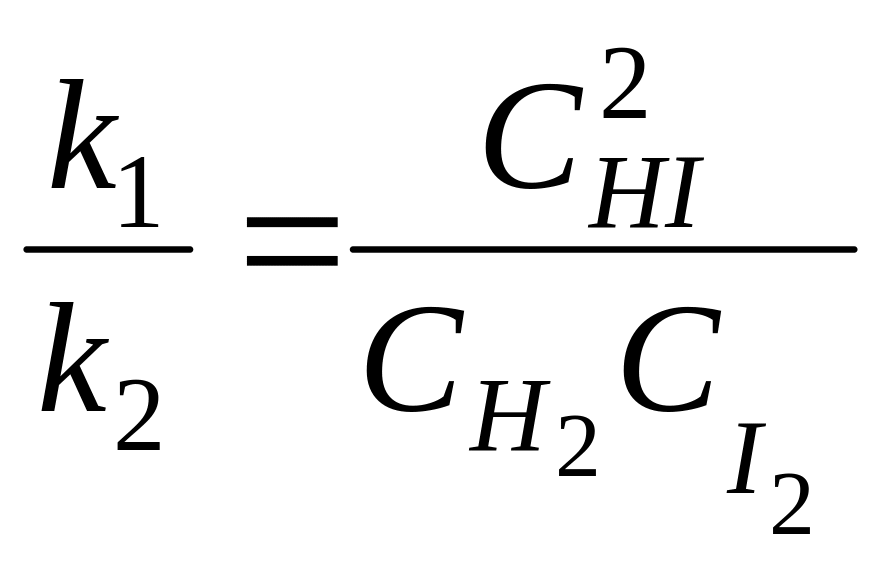
При даній температурі константи швидкості k1 і k2 є величини сталі, тому їх відношення К. = k1/k2 теж величина стала. Тоді
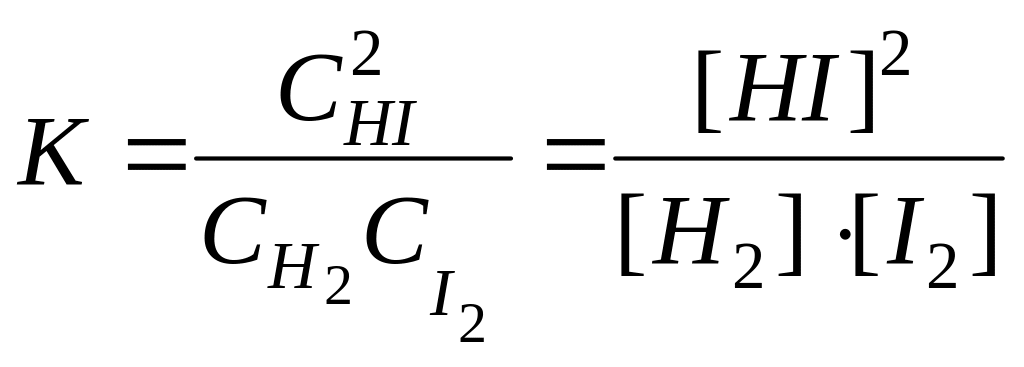 ,
(6.7)
,
(6.7)
де K— константа хімічної рівноваги. Квадратними дужками позначають рівноважні концентрації речовин.
У виразі для константи рівноваги (6.7) у чисельнику записують концентрації продуктів реакції, а у знаменнику - концентрації вихідних речовин, причому беруть рівноважні концентрації. Для зворотної реакції
аА+bВ ⇄eE+dD
константа рівноваги
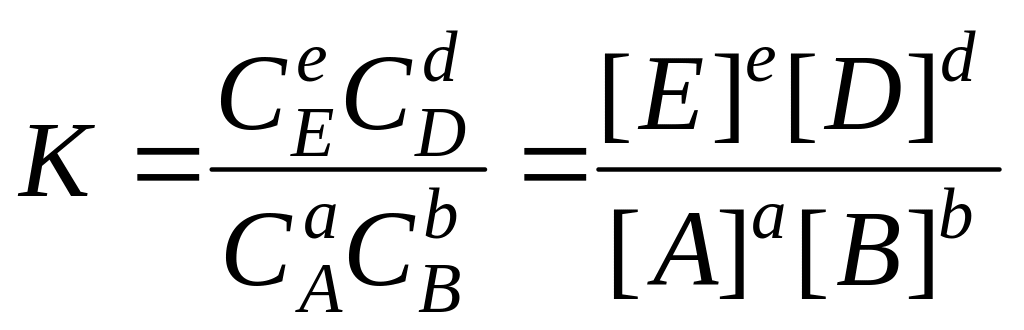 , (6.8)
, (6.8)
У вираз константи хімічної рівноваги, як і у вираз константи швидкості, концентрації входять у степенях, які дорівнюють стехіометричним коефіцієнтам у рівнянні реакції.
Рівняння (6.8) є одним з виразів закону діючих мас.
Слід зауважити, що закон діючих мас справедливий і для гетерогенних систем, але тільки для однорідних їх частин. Наприклад, для гетерогенної системи
С(т) + СО2 (г) ⇄ 2СО(г)
у відповідності до закону діючих мас для швидкості прямої реакції можемо записати:
![]() .
.
Вираз константи рівноваги для даної системи буде мати вигляд:
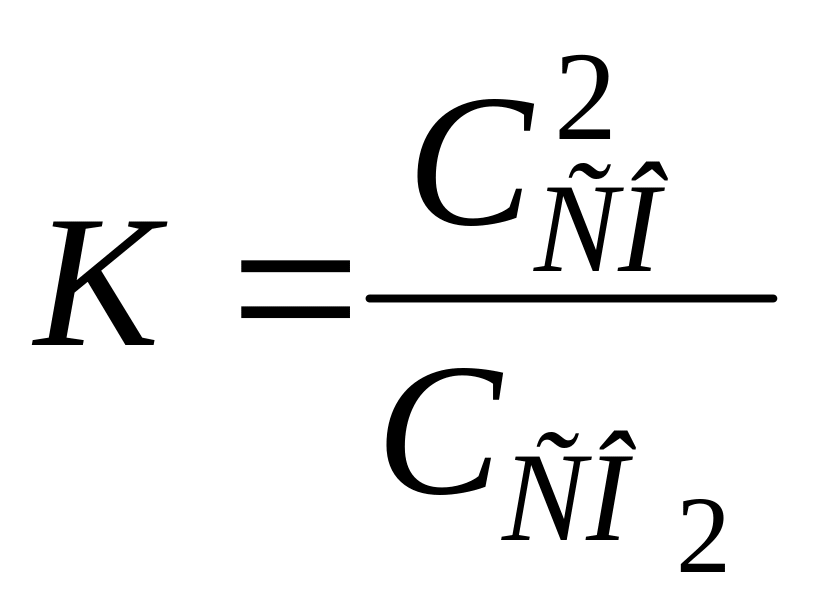
Константа хімічної рівноваги показує, що в момент рівноваги відношення добутку рівноважних концентрацій продуктів реакції до добутку рівноважних концентрацій реагуючих речовин є величиною сталою при Т == const. Тобто незалежно від початкових концентрацій рівновага в системі встановлюється завжди при тому самому відношенні концентрацій продуктів реакції і реагуючих речовин. Це співідношення не залежить від того, які речовини беруться як вихідні, наприклад Н2 + I2 або НІ.
Отже, константа рівноваги не залежить від концентрації речовин, а залежить від природи реагуючих речовин і температури реакції.
