
- •Методичні вказівки
- •Зміст модуля I
- •1. Основні хімічні поняття і стехіометричні закони
- •1.1. Предмет хімії і основні хімічні поняття
- •1.2. Основні закони хімічної взаємодії
- •1.3. Запитання для самоконтролю
- •1.4. Задачі для самоконтролю
- •2. Основні класи неорганічних сполук
- •2.1. Оксиди
- •2.2. Гідрати оксидів
- •2.2.1. Основи
- •2.2.2. Амфотерні гідроксиди
- •2.2.3. Кислоти
- •2.4. Запитання для самоконтролю
- •2.4. Задачі для самоконтролю
- •3. Будова атома. Періодичний закон д.І.Менделєєва
- •3.1. Загальні уявлення про будову атома, природа електрона і характеристики його стану в атомі
- •3.2. Квантові числа
- •3.3. Розподіл електронів в атомі, електронні й електронно-графічні формули елементів
- •3.4. Періодичний закон та періодична система елементів д.І.Менделєєва
- •3.5. Радіуси атомів та йонів елементів
- •3.6. Закономірності зміни енергетичних характеристик елементів.
- •Енергія йонізації
- •Енергія спорідненості до електрона
- •Електронегативність атомів
- •3.7. Запитання для самоконтролю
- •3.8. Задачі для самоконтролю
- •4. Хімічний зв’язок. Кристалічний стан речовин
- •4.1. Основні типи хімічного зв’язку. Ковалентний зв’язок
- •4.2. Іонний зв'язок
- •4.3. Металічний зв'язок
- •4.4. Водневий зв'язок
- •4.5. Міжмолекулярна взаємодія
- •4.6. Тверді тіла. Типи кристалічних граток
- •4.7. Запитання та задачі для самоконтролю
- •5. Основи хімічної термодинаміки
- •5.1. Основні термодинамічні поняття
- •5.2. Термохімія.
- •5.3. Напрям перебігу хімічних процесів.
- •5.4. Питання для самоконтролю
- •5.5. Задачі і вправи для самостійної роботи
- •6.Хімічна кінетика і рівновага
- •6.1. Загальні уявлення про швидкість хімічних реакцій
- •6.3. Закон діючих мас
- •6.4. Енергія активації
- •6.5. Вплив температури на швидкість реакції
- •6.6. Каталіз
- •6.7. Хімічна рівновага
- •6.8. Вплив зовнішніх факторів на хімічну рівновагу. Принцип ле Шательє
- •6.9. Запитання та задачі для самоконтролю
- •Список рекомендованої літератури
6.4. Енергія активації
Як зазначалось, умовою елементарного акту взаємодії є зіткнення частинок реагуючих речовин. Проте не кожне зіткнення може спричинити хімічну взаємодію. Справді, хімічна взаємодія передбачає перерозподіл електронної густини, утворення нових хімічних зв'язків і перегрупування атомів. Отже, крім зіткнення, для взаємодії частинок необхідно, щоб їх енергія була більшою за енергію відштовхування (енергетичний бар'єр) між їхніми електронними оболонками.
Частина молекул у системі внаслідок перерозподілу енергії завжди має певний надмір енергії порівняно з середньою енергією молекул. Тому вони можуть подолати енергетичний бар'єр і вступити в хімічну взаємодію. Такі реакційнодатні молекули дістали назву активних молекул. Різниця між середньою енергією системи і енергією, необхідною для перебігу реакції, називається енергією активації реакції. Вона потрібна для подолання енергетичного бap'єру.
Наявність енергетичного бар'єру призводить до того, що багато які реакції, перебіг яких цілком можливий, самовільно не починаються. Наприклад, вугілля, дерево, нафта, які здатні окислюватись і горіти на повітрі, за звичайних умов не займаються. Це пов’язано з великою енергією активації відповідних реакцій окислення. Підвищення температури збільшує кількість активних молекул і тому дедалі більша кількість молекул кисню, вугілля, дерева і нафти має необхідний запас енергії для початку реакції. При певній температурі швидкість реакції досягає певної величини і починається реакція горіння. Отже, під час хімічного процесу перехід системи вихідних речовин з енергетичним станом Евих у енергетичний стан продуктів реакції Епр здійснюється через енергетичний бар'єр, який дорівнює енергії активації системи ΔЕакт. При цьому тепловий ефект реакції дорівнює
∆H = Eпр - Евих
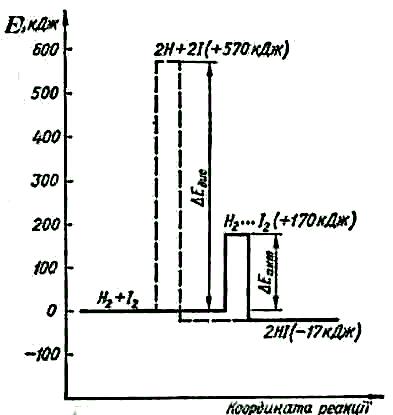
На рис.6.2 наведено енергетичну схему взаємодії водню і йоду. Характерною особливістю цієї реакції є те, що під час взаємодії активних молекул водню і йоду спочатку утворюється проміжна сполука
Н2 • • • І2, яка називається активним комплексом. Саме в цьому комплексі відбувається розрив зв'язків Н—Н і І—І і утворення нових зв'язків Н—І.
Рис.6.2.
Енергетична схема взаємодії водню і
йоду
 Я
Я
Енергія активації ∆Еакт — важлива характеристика хімічних перетворень. Саме енергія активації затримує або робить неможливими багато які реакції, які з погляду термодинаміки можуть відбуватися самовільно. Якби енергія активації для всіх реакцій дорівнювала нулю (∆Еакт = 0), то в природі відбувалося б безліч хаотичних хімічних реакцій, для яких величина ∆G від'ємна. Так, вугілля і нафта при контакті з повітрям загорілися б, азот повітря і вода утворили б розчин азотної кислоти, живі клітини зруйнувалися б внаслідок гідролізу.
Отже, існування багатьох молекул, кристалічних речовин і навіть живих клітин можливе лише тому, що їхні перетворення і руйнування пов'язані з подоланням значного енергетичного бар'єру.
