
- •Міністерство аграрної політики україни таврійський державний агротехнологічний університет
- •Методичні вказівки
- •Мелітополь – 2009
- •Техніка безпеки і правила роботи в хімічній лабораторії.
- •Правила роботи.
- •Лабораторна робота №1. Агрегатний стан речовин
- •Задачі для розв’язування на занятті:
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота №2. Хімічна термодінаміка
- •Задачі для розв’язування на занятті:
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота №3. Хімічна кінетика
- •Задачі для розв’язування на занятті:
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота №4. Хімічна рівновага
- •Задачі для розв’язування на занятті:
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота № 5. Фазова рівновага і фізико – хімічний аналіз
- •Фазові переходи в однокомпонентній системі. Діаграма стану води
- •Зміна ентальпії, ентропії та ізобарного потенціалу під час фазових переходів
- •Задачі для розв’язування на занятті:
- •Контрольні питання:
- •Лабораторна робота № 6. Розчини неелектролітів
- •Способи вираження складу розчину
- •Тиск насиченого пару розведених розчинів
- •Температура замерзання розбавлених розчинів
- •Температура кипіння розведених розчинів
- •Осмотичний тиск
- •Задачі для розв’язування на занятті:
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота № 7. Розчини електролітів
- •Роль розчинника в процесі дисоціації
- •Стан сильних електролітів у розчинах. Коефіцієнт активності
- •Дисоціація слабких електролітів
- •Рівновага в насичених розчинах електролітів
- •Реакція обміну в розчинах електролітів. Іонні рівняння
- •Задачі для розв’язування на занятті:
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота № 8. Розчини електролітів
- •Гідроліз солей
- •Задачі для розв’язування на занятті:
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота № 9. Окислювально-відновні реакції.
- •Методи упорядкування окисно-відновних рівнянь реакцій.
- •Задачі для розв’язування на занятті:
- •Контрольні питання:
- •Гальванічні елементи.
- •Задачі для розв’язування на занятті:
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота № 11. Електрохімія (електроліз. Гальванічні покриття)
- •Задачі для розв’язування на занятті:
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота № 12. Електрохімія (приготування та аналіз акумуляторної кислоти)
- •Свинцевий акумулятор (кислотний).
- •Р озрядження
- •Залізо-нікелевий акумулятор (лужний).
- •З арядження
- •Срібно – цинковий акумулятор.
- •Вимоги до електроліту.
- •Контрольні питання.
- •Лабораторна робота № 13. Поверхневі явища і адсорбція
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота № 14. Колоїдні розчини
- •Методи визначення молекулярної маси високомолекулярних сполук.
- •Середня молекулярна маса
- •Контрольні питання:
- •Список літератури
Лабораторна робота №3. Хімічна кінетика
Мета роботи – навчитися проводити розрахунки за законом діючих мас, правилом Вант – Гофа, досліджувати вплив різних факторів на швидкість хімічних реакцій.
ТЕОРЕТИЧНА ЧАСТИНА
Усі хімічні реакції поділяють на прості та складні. Прості реакції протікають в одну стадію, а складні – у декілька. Щоб молекули прореагували, вони повинні зіткнутися. Зіткнення, при якому молекули реагують, називають елементарним актом реакції.
Кожна хімічна реакція протікає з певною швидкістю. Одні йдуть миттєво. З вибухом, інші йдуть на протязі хвилин, годин, а деякі – роками (руйнування гірських порід, утворення деяких солей).
Швидкість реакції вимірюють зміною концентрації реагуючих речовин в одиницю часу. Концентрацію виражають в моль/л, час – у хвилинах або секундах. Необхідно враховувати, що хімічні реакції можуть бути гомогенні, якщо вони протікають в однорідній системі, і гетерогенні, якщо реагуючи речовини знаходяться у різному агрегатному стані або просто між ними є межа розділу.
У гомогенних системах реакція протікає у всьому об‘ємі і швидкість вимірюється кількістю речовини, що реагує за одиницю часу в одиниці об’єму.
В гетерогенних системах реакція йде на межі розділу фаз і залежить від величини поверхні розділу. Тому швидкість реакції вимірюється кількістю речовини, що реагує за одиницю часу на одиниці поверхні фази.
Для визначення швидкості реакції достатньо знати зміни у часі молярної концентрації тільки однієї речовини, яка бере участь у реакції, так як усі вони зв’язані стехіометричними коефіцієнтами у рівнянні реакції. Середня швидкість υ має вираз у рівнянні:
![]() , (1)
, (1)
де Δс – зміни молярної концентрації одної з речовин (в моль/м3 або моль/л) за певний час Δt, вимірюється у секундах, хвилинах та часах.
Швидкість реакції прийнято враховувати
позитивною величиною, але відношення
![]() може бути негативним (коли за швидкістю
реакції слідкують по зміні концентрацій
вихідних речовин). у цьому випадку в
рівнянні (1) ставимо знак “мінус”.
може бути негативним (коли за швидкістю
реакції слідкують по зміні концентрацій
вихідних речовин). у цьому випадку в
рівнянні (1) ставимо знак “мінус”.
Гранична
величина відношення
![]() , коли Δt становиться
безкінечно маленькою величиною чи, як
говорять, якщо Δt наближається
до нулю як до своєї границі, дорівнює
υ швидкості:
, коли Δt становиться
безкінечно маленькою величиною чи, як
говорять, якщо Δt наближається
до нулю як до своєї границі, дорівнює
υ швидкості:
![]() , (2)
, (2)
Таким чином, швидкість реакції – це швидкість у даний момент часу.
Залежність швидкості хімічної реакції від концентрації реагуючих речовин виражає основний постулат кінетики – закон діючих мас, що був сформульований норвезькими вченими Гульбергом і Вааге у 1867 році.
Швидкість хімічної реакції прямо пропорційна добутку концентрації реагуючих речовин у ступенях, що дорівнюють їх стехіометричним коефіцієнтам в рівнянні реакції.
(Або: при постійній температурі швидкість хімічної реакції в даний час пропорційна добутку молярних концентрацій реагуючих речовин до того моменту.)
В загальному вигляді математично цей закон для реакції
mA + nB = pC + qD
записується так:
υ = K[A]m[B]n (3)
де υ – швидкість реакції,
K – коефіцієнт пропорційності (константа швидкості),
A і B – мольні концентрації вхідних речовин,
m і n – стехіометричні коефіцієнти (кількість моль реагуючих речовин).
Якщо [A] = [B] = 1 моль/л, то відповідно до рівняння (3) маємо
υ = K,
тобто, константа швидкості це і є швидкість хімічної реакції, за умовою, що концентрації реагуючих речовин дорівнюють 1 моль/л. Константа швидкості реакції залежить від природи реагуючих речовин, температури, але не залежить від їх концентрації.
У випадку гетерогенних реакцій у рівняння закону дії мас входять концентрації тільки тих речовин, що знаходяться в газовій фазі або розчині. Концентрація речовини, що знаходиться у твердій фазі, звичайно являє собою постійну величину і тому входить у константу швидкості. Наприклад, для реакції горіння вугілля С + О2 = СО2 закон дії мас запишеться так: υ=КСО2
В залежності від числа молекул, що беруть участь в елементарному акті реакції, всі реакції поділяють на мономолекулярні, бімолекулярні і тримолекулярні.
Для простої бімолекулярної реакції типу А+В→ продукти реакції
![]() ,
,
де К – константа швидкості реакції; с(А) та с(В) – молярні концентрації реагуючих речовин.
Для тримолекулярній реакції типу 2А + В → продукти реакції:
![]()
Таким чином, в математичному виразі закону діючих мас для всіх простих гомогенних систем, що протікають у кінетичної області, реакцій кожна із концентрацій реагуючих речовин входить до ступеню, що дорівнює коефіцієнту перед формулою даної речовини у рівнянні реакції.
Константа швидкості реакції першого порядку дорівнює:
![]() (4)
(4)
Після інтегрування константа швидкості реакції другого порядку дорівнює:
![]() (5)
(5)
де а і b – початкові молярні концентрації реагуючих речовин, х – кількість речовин, які прореагували за час t. Якщо початкові концентрації реагуючих речовин однакові (а= b), то константа швидкості розраховується за рівнянням:
![]() (6)
(6)
Константа швидкості реакції другого порядку має одиниці вимірювання: м3/с*моль або л/с*моль.
Зниження порядку реакції буде проходити у тому випадку, коли концентрація однієї речовини з реакції залишається постійною - її надлишок, або постійне поповнення її вичерпання.
Існує велика кількість методів визначення порядку реакції. За однією з них порядок реакції визначається порівнянням констант. За цією метою спочатку данні підставляють у рівняння константи швидкості реакції першого порядку, потім – другого. Реакція буде мати той порядок, рівняння якого дасть постійне значення величини константи.
З ростом температури збільшується число активних зіткнень часток, що веде до підвищення швидкості реакції. Голландський вчений Вант-Гофф установив закон: при підвищенні температури на кожні 100 швидкість хімічних реакцій зростає в 2-4 рази (в середньому в 3 рази). Показник, що вказує, у скільки разів зростає швидкість реакції при збільшенні температури на кожні 100С, називається температурним коефіцієнтом γ. Правило Вант-Гоффа математично записується рівнянням:
![]() (7)
(7)
![]() (8)
(8)
Залежність швидкості реакції від температури приблизно має вираз:
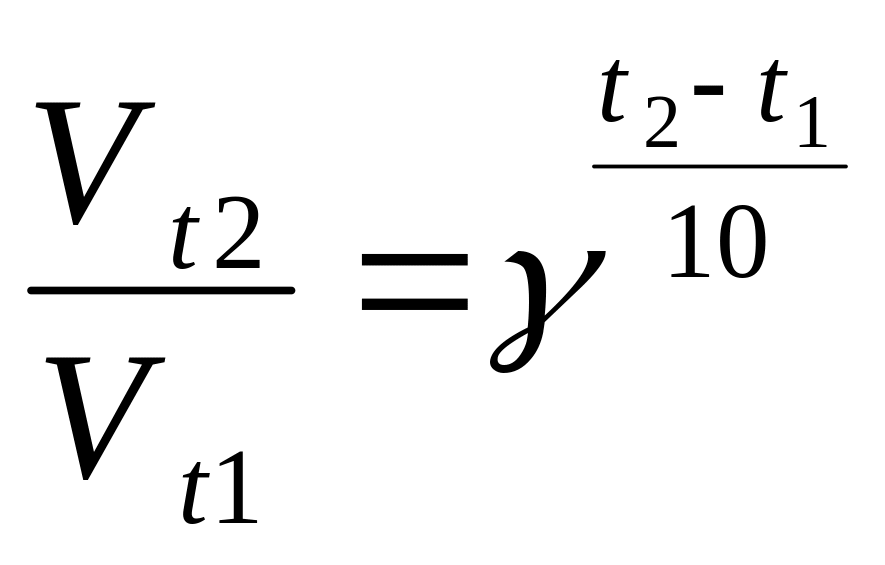 (9)
(9)
Тут Vt1- швидкість реакції при початковій температурі t1, Vt2 - швидкість реакції при кінцевій температурі t2, γ- температурний коефіцієнт.
Залежність швидкості хімічної реакції для неширокого інтегралу температур більш точнішим буде вираз:
![]() (10)
(10)
де Е – енергія активації, Дж/моль; R – молярна газова постійна, Дж/(моль*К); Т – термодинамічна температура.
Для простих реакцій енергією активації називають ту мінімальну енергію (у розрахунку на 1 моль), яку повинні мати реагуючи частинки, щоб зіткнення між ними призвело до хімічної взаємодії.
З рівняння (10) визначаємо енергію активації:
 (11)
(11)
У твердому стані взаємодія реагуючих часток може відбуватися тільки з поверхні. Тому, швидкість реакції в цьому випадку буде залежати від ступеня розвитку поверхні: чим більше поверхня, тим вище швидкість реакції.
На швидкість хімічної реакції можуть впливати каталізатори. Каталізатори – це речовини, що змінюють швидкість реакції, але зберігають свій склад і кількість після проміжних реакцій. Каталізатори, що прискорюють реакцію, називають позитивними, а які сповільнюють – негативними.
ЕКСПЕРІМЕНТАЛЬНА ЧАСТИНА
Мета роботи: встановити залежність швидкості реакції від природи і концентрацій реагуючих речовин, температури, ступеню здрібнення твердих речовин, наявності каталізатора.
Прилади та реактиви: водяна мікролазня, штатив з кільцем і азбестовою сіткою, газовий пальник, термометр на 100 0С, секундомір, бюретки. Гранульовані цинк і олово, карбонат кальцію (крейда) у шматочках. Розчини: розведеної та концентрованої хлороводневої кислоти, сірчаної кислоти (2н), тіосульфату натрію Na2S2O3 (0,25н та 0,1н). Дистильована вода.
Дослід 1. Вплив природи реагуючих речовин на швидкість реакції.
В дві пробірки налити по 1 мл розчину хлороводневої кислоти. До однієї з них опустити шматочок гранульованого олова, до іншої – такий же за розміром шматочок цинку. Порівняти інтенсивність виділення пухирців газу.
Завдання: скласти рівняння взаємодії хлороводневої кислоти з цинком і оловом. Зробити висновок про вплив природи реагуючих речовин на швидкість реакції.
Дослід 2. Вплив ступеня здрібнювання на швидкість реакції.
Взяти два маленьких шматочки крейди приблизно однакового розміру. Один зі шматочків помістити в пробірку, а інший подрібнити скляною паличкою на листку фільтрувального паперу, і порошок перенести в іншу пробірку. В обидві пробірки внести одночасно по 1 мл хлороводневої кислоти. Порівняти час розчинення крейди в кожному випадку.
Завдання: скласти рівняння реакції між карбонатом кальцію і хлороводневою кислотою. Зробити висновок про вплив ступеня здрібнювання твердих речовин на швидкість реакцій.
Дослід 3. Залежність швидкості реакції від концентрації реагуючих речовин.
В три пробірки налийте по 5 мл 2н розчину сірчаної кислоти.
В три стаканчика налийте: в перший 15 мл тіосульфату натрію, в другий 10 мл тіосульфату натрію та 5 мл води, в третій 5 мл тіосульфату натрію та 10 мл води. Потім по черзі в кожний стаканчик вилийте 5 мл сірчаної кислоти з пробірки, включіть секундомір і швидко перемішайте. Спостерігайте час появи легкої опалесценції і подальшого помутніння розчину від осадженої вільної сірки в кожному стаканчику.
Завдання: записати рівняння реакції, та результати спостереження записати у таблицю 1.
Таблиця 1.
№ ста кан
|
Р-н сірчаної к-ти, мл |
Р-н тіосіль фату натрію, мл |
Вода, мл |
Відносна концен трація тіосульфату натрію |
Час до появи помутніння р-ну t, c |
Відносна швидкість реакції υ=1/ t, (с-1) |
1 2 3 |
5 5 5 |
15 10 5 |
0 5 10 |
3 2 1 |
|
|
Зробіть висновок про зміну швидкості реакції при зміні концентрації і накресліть графік, де на осі абсцис відкласти умовну концентрацію розчину тіосульфату натрію, на осі ординат – умовну швидкість реакції.
Дослід 4. Залежність швидкості реакції від температури.
Налийте в одну пробірку 5 мл розчину тіосульфату натрію, в другу – 5 мл розчину 2н сірчаної кислоти. Обидві пробірки поставити у стакан з водою і через 5-7 хвилин вимірте температуру води. Потім злийте разом розчини двох пробірок і спостерігайте, за який час з’явиться помутніння. У дві другі пробірки налити по 5 мл тих самих розчинів. Помістить пробірки в стакан з водою, нагрійте на 10 0С вище, ніж в попередньому досліді. Злийте розчини і спостерігайте за який час з’явиться помутніння. Повторіть дослід, підняв температуру ще на 10 0С.
Завдання: результати спостереження записати у таблицю 2.
Таблиця 2.
№ досліду |
Температура досліду, t 0С |
Час до появи помутніння р-ну t, c |
Відносна швидкість реакції υ=1/ t, (с-1) |
|
|
|
|
Зробіть висновок про залежність швидкості реакції від температури і накресліть графік, де на осі абсцис відкласти температуру, на осі ординат – умовні значення швидкості реакції.
