
- •Міністерство аграрної політики україни таврійський державний агротехнологічний університет
- •Методичні вказівки
- •Мелітополь – 2009
- •Техніка безпеки і правила роботи в хімічній лабораторії.
- •Правила роботи.
- •Лабораторна робота №1. Агрегатний стан речовин
- •Задачі для розв’язування на занятті:
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота №2. Хімічна термодінаміка
- •Задачі для розв’язування на занятті:
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота №3. Хімічна кінетика
- •Задачі для розв’язування на занятті:
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота №4. Хімічна рівновага
- •Задачі для розв’язування на занятті:
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота № 5. Фазова рівновага і фізико – хімічний аналіз
- •Фазові переходи в однокомпонентній системі. Діаграма стану води
- •Зміна ентальпії, ентропії та ізобарного потенціалу під час фазових переходів
- •Задачі для розв’язування на занятті:
- •Контрольні питання:
- •Лабораторна робота № 6. Розчини неелектролітів
- •Способи вираження складу розчину
- •Тиск насиченого пару розведених розчинів
- •Температура замерзання розбавлених розчинів
- •Температура кипіння розведених розчинів
- •Осмотичний тиск
- •Задачі для розв’язування на занятті:
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота № 7. Розчини електролітів
- •Роль розчинника в процесі дисоціації
- •Стан сильних електролітів у розчинах. Коефіцієнт активності
- •Дисоціація слабких електролітів
- •Рівновага в насичених розчинах електролітів
- •Реакція обміну в розчинах електролітів. Іонні рівняння
- •Задачі для розв’язування на занятті:
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота № 8. Розчини електролітів
- •Гідроліз солей
- •Задачі для розв’язування на занятті:
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота № 9. Окислювально-відновні реакції.
- •Методи упорядкування окисно-відновних рівнянь реакцій.
- •Задачі для розв’язування на занятті:
- •Контрольні питання:
- •Гальванічні елементи.
- •Задачі для розв’язування на занятті:
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота № 11. Електрохімія (електроліз. Гальванічні покриття)
- •Задачі для розв’язування на занятті:
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота № 12. Електрохімія (приготування та аналіз акумуляторної кислоти)
- •Свинцевий акумулятор (кислотний).
- •Р озрядження
- •Залізо-нікелевий акумулятор (лужний).
- •З арядження
- •Срібно – цинковий акумулятор.
- •Вимоги до електроліту.
- •Контрольні питання.
- •Лабораторна робота № 13. Поверхневі явища і адсорбція
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота № 14. Колоїдні розчини
- •Методи визначення молекулярної маси високомолекулярних сполук.
- •Середня молекулярна маса
- •Контрольні питання:
- •Список літератури
Гальванічні елементи.
Гальванічні елементи - це прилади, в яких хімічна енергія окислювально-відновної реакції перетворюється в електричну.
Перший такий прилад був створено італійським фізиком - хіміком Вольта, потім вдосконалений російськими вченими Даніелем і Якобі. Гальванічний елемент, наприклад елемент Якобі, схематично може бути зображено слідуючою схемою:
Cu | Zn | ZnSO4 | | CuSO4 | Cu |
ЕK Е1 ЕД Е2
Вертикальними лініями позначені поверхневі розділи, де виникають стрибки потенціалів. Різницю електродних потенціалів або ЕДС елемента розраховують за формулою:
або Е = ЕK + Е1 + ЕД + Е2 , (1)
де Е1 та Е2 - стрибки потенціалів на кордоні метал/розчин та розчин/метал, ЕK – стрибок потенціалу, який називають контактним потенціалом, ЕД - стрибок потенціалу, який називають дифузним потенціалом. Він виникає при різній швидкості руху іонів, які проходять крізь кордон двох розчинів. Його величина зазвичай незначна та може бути зменшена практично до нуля.
Елемент будимо записувати так, щоб зліва був негативний електрод, не будемо записувати метал, на кордоні з яким виникає тільки контактний потенціал, якщо знешкоджено дифузійний потенціал, між розчинами ставимо дві лінії:
(-) Zn | ZnSO4 | | CuSO4 |Cu (+).
Стрибки потенціалів окремих електродів невизначені. Можемо визначити тільки ЕДС елемента. За електрод порівняння прийнято стандартний водневий електрод.
У процесі роботи елемента Якобі на катоді буде розчинятися цинк, а на аноді виділятися мідь з розчину:
Zn→Zn2+ + 2ē Cu2+ + 2 ē →Cu
Хімічний процес, який протікає у гальванічному елементі, відображається рівнянням: Zn+ Cu2+→Zn2+ + Cu
У кожному гальванічному елементі на негативному електроді проходить процес окислення, а на позитивному – відновлення.
Величина електродного потенціалу залежить від активності металу, концентрації його іонів у розчині та температури.
Електродний потенціал розраховується за формулою Нернста:
![]() ,
(2)
,
(2)
де Е0 – стандартний електродний потенціал метала;
n – валентність іонів метала у розчині;
С – концентрація іонів метала у розчині (в г-іон/л).
Для достатньо розчинних розчинів у цьому рівнянні активність можемо замінити молярною концентрацією еквіваленту іонів металу (моль/л).
При 180С коефіцієнт перед логарифмом дорівнює 0,058 : n.
Якщо електрод – неметал, який посилає аніони до розчину, то рівняння, яке зв’язує електродний потенціал з активністю аніона, буде мати вигляд:
Е=Е0-
![]() (3)
(3)
ЕДС елемента, якщо не враховувати дифузійний потенціал, буде дорівнювати різності електродних потенціалів:
ЕДС = Е0окисл. – Евідн. (4)
Виразив величину електродного потенціалу через рівняння (2), отримуємо:
![]() (5)
(5)
Якщо заряди іонів однакові: n1=n2=n, тоді рівняння (5) приймає вигляд:
![]() (6)
(6)
У тому випадку, коли обидва електроди
однакові, але занурені до розчинів з
різною концентрацією (активністю) іонів,
гальванічний елемент називається
концентраційним. Так як
![]() ,
тоді ЕДС цього елементу, якщо не
враховувати дифузійного потенціалу,
буде дорівнювати:
,
тоді ЕДС цього елементу, якщо не
враховувати дифузійного потенціалу,
буде дорівнювати:
![]() (7) де а1>а2
(7) де а1>а2
ЕДС концентраційних елементів мала.
Величина дифузійного потенціалу ЕД , яка виникає при зіткненні двох розчинів різної концентрації одного й того ж електроліту, який розпався на два однозарядні іона, виражається рівнянням:
![]() (8) де lK
та lC
– рух відповідно катоду та аноду,
С1 та С2 – активності.
(8) де lK
та lC
– рух відповідно катоду та аноду,
С1 та С2 – активності.
Якщо електроліт утворює два двозарядних іона, то в рівнянні (8) перед F ставимо множник 2.
Якщо електрод з інертного металу (Pt, Au) занурити до розчину, у якому проходить окисно – відновний процес, то на кордоні електроду та розчину виникає потенціал, який має назву окисно – відновний. Платиновий електрод сам при цьому не змінюється, а лише підводить та відводить електрони. Потенціал окисно – відновного електроліту для процесу
окисний стан + nē ⇄ відновлений стан
має вираз:
![]() (9) де О – окисний стан, а R
– відновлений стан.
(9) де О – окисний стан, а R
– відновлений стан.
У загальному випадку на електроді протікають окисно – відновні реакції: аА+bB+…nē ⇄ xX+yY,
де А, В – окисний стан, X, Y – відновлений стан, n – кількість електронів, яка необхідна для проходження процесу зліва на право. Потенціал електрода має вираз:
![]() (10) де Е0
– стандартний потенціал окисно –
відновного процесу, тобто потенціал,
коли концентрації (активності) усіх
речовин дорівнюють одиниці. У чисельнику
подлогарифметичного виразу знаходяться
концентрації (активності) речовин, більш
окислених у порівнянні з речовинами,
які знаходяться у знаменнику.
(10) де Е0
– стандартний потенціал окисно –
відновного процесу, тобто потенціал,
коли концентрації (активності) усіх
речовин дорівнюють одиниці. У чисельнику
подлогарифметичного виразу знаходяться
концентрації (активності) речовин, більш
окислених у порівнянні з речовинами,
які знаходяться у знаменнику.
На основі електрохімічних вимірів можемо визначити константи рівноваги – К для зворотних хімічних реакцій:
![]() (11) де Е0 – стандартна
ЕДС гальванічного елементу, яка дорівнює
різності стандартних електродних
потенціалів, n
– число електронів, які беруть
участь у реакції.
(11) де Е0 – стандартна
ЕДС гальванічного елементу, яка дорівнює
різності стандартних електродних
потенціалів, n
– число електронів, які беруть
участь у реакції.
Вимірювання ЕДС гальванічного елементу може бути використано для визначення розчинності важкорозчинних солей, рН розчину та інших цілей.
ЕКСПЕРИМЕНТАЛЬНА ЧАСТИНА
Мета роботи – ознайомити студентів з активністю металів, основними електрохімічними поняттями та процесами роботи гальванічних елементів.
Прилади та реактиви: штатив з набором пробірок, скляні стакани. Шматочки цинку, алюмінію, магнію, заліза. Розчини: хлороводневої, сірчаної, щавлевої кислот, гідроксиду натрію, гідроксиду амонію, хлориду натрію, нітрату срібла, карбонату натрію, ацетату натрію, сульфат міді. Гальванічний елемент.
Дослід №1. Витискання водню з кислоти.
Отримайте водень дією хлористоводневої кислоти з металами.
Робоче місце №1. – цинком.
№2. - алюмінієм.
№3. - магнієм.
№4. – залізом.
Складіть рівняння реакцій у молекулярному та іонному вигляді.
Дослід №2. Витискання одних металів іншими.
У розчин з сульфатом міді занурюють:
Робоче місце №1. – цинкову пластинку,
№2. – алюмінієвий дріт,
№3. – залізний дріт (цвях),
№4. - олов’яну пластинку.
Складіть рівняння реакцій у молекулярному та іонному вигляді.
Дослід №3. Гальванічні елементи.
Нижче перелічені напівелементи з’єднайте войлочним містком, занурюючи його у розчин солей (див. Рис. 3).
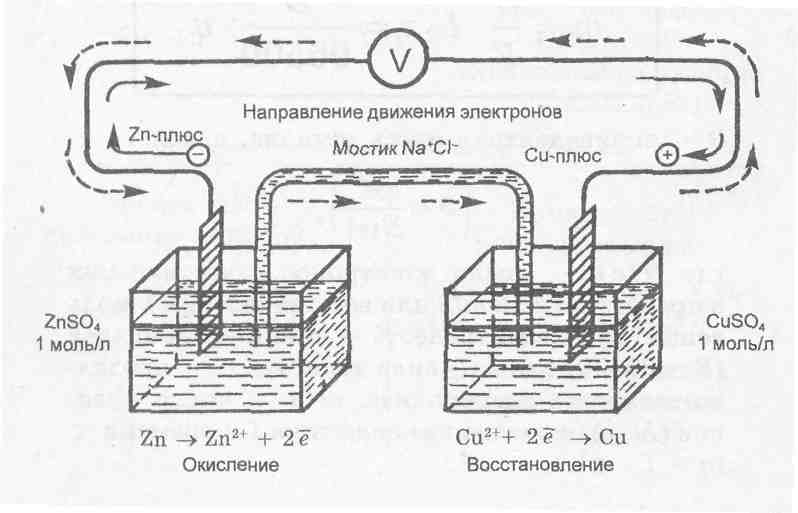
Рис. 3. Гальванічний елемент.
Металеві пластинки з’єднайте з вольтметром. Спостерігайте відхилення стрілки, яке свідчить про виникнення електричного струму.
Робоче місце №1. Мідну пластинку занурюють у 2,0 Н розчин сульфату міді, а цинкову – у 0,1 М розчин сульфату цинку.
Робоче місце №2. Мідяну пластинку занурюють у 2,0 Н розчин сульфату міді, а алюмінієву -–у 0,1 М розчин сульфату алюмінію.
Робоче місце №3. Мідяну пластинку занурюють у 2,0 Н розчин сульфату міді, а залізну – у 0,1 М розчин сульфату заліза.
Робоче місце №4. Цинкову пластинку занурюють у 2,0 М розчин сульфату цинку, а другу цинкову пластинку – у 0,001 М розчин сульфату цинку.
Складіть рівняння окислювально-відновних реакцій, які проходять на електродах. Розрахуйте ЕДС гальванічного елемента.
