
- •Міністерство аграрної політики україни таврійський державний агротехнологічний університет
- •Методичні вказівки
- •Мелітополь – 2009
- •Техніка безпеки і правила роботи в хімічній лабораторії.
- •Правила роботи.
- •Лабораторна робота №1. Агрегатний стан речовин
- •Задачі для розв’язування на занятті:
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота №2. Хімічна термодінаміка
- •Задачі для розв’язування на занятті:
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота №3. Хімічна кінетика
- •Задачі для розв’язування на занятті:
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота №4. Хімічна рівновага
- •Задачі для розв’язування на занятті:
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота № 5. Фазова рівновага і фізико – хімічний аналіз
- •Фазові переходи в однокомпонентній системі. Діаграма стану води
- •Зміна ентальпії, ентропії та ізобарного потенціалу під час фазових переходів
- •Задачі для розв’язування на занятті:
- •Контрольні питання:
- •Лабораторна робота № 6. Розчини неелектролітів
- •Способи вираження складу розчину
- •Тиск насиченого пару розведених розчинів
- •Температура замерзання розбавлених розчинів
- •Температура кипіння розведених розчинів
- •Осмотичний тиск
- •Задачі для розв’язування на занятті:
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота № 7. Розчини електролітів
- •Роль розчинника в процесі дисоціації
- •Стан сильних електролітів у розчинах. Коефіцієнт активності
- •Дисоціація слабких електролітів
- •Рівновага в насичених розчинах електролітів
- •Реакція обміну в розчинах електролітів. Іонні рівняння
- •Задачі для розв’язування на занятті:
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота № 8. Розчини електролітів
- •Гідроліз солей
- •Задачі для розв’язування на занятті:
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота № 9. Окислювально-відновні реакції.
- •Методи упорядкування окисно-відновних рівнянь реакцій.
- •Задачі для розв’язування на занятті:
- •Контрольні питання:
- •Гальванічні елементи.
- •Задачі для розв’язування на занятті:
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота № 11. Електрохімія (електроліз. Гальванічні покриття)
- •Задачі для розв’язування на занятті:
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота № 12. Електрохімія (приготування та аналіз акумуляторної кислоти)
- •Свинцевий акумулятор (кислотний).
- •Р озрядження
- •Залізо-нікелевий акумулятор (лужний).
- •З арядження
- •Срібно – цинковий акумулятор.
- •Вимоги до електроліту.
- •Контрольні питання.
- •Лабораторна робота № 13. Поверхневі явища і адсорбція
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота № 14. Колоїдні розчини
- •Методи визначення молекулярної маси високомолекулярних сполук.
- •Середня молекулярна маса
- •Контрольні питання:
- •Список літератури
Контрольні питання:
Сформулюйте правило фаз, напишіть рівняння та вкажіть умови, при яких справедливо це рівняння.
Дайте визначення поняттю „фаза”, „складові частини системи”, „компонент”, „ступінь свободи рівноважної системи”.
Вкажіть, в яких випадках число компонентів дорівнює числу складових частин системи. Як визначається число компонентів системи в інших випадках?
Як поділяють рівноважні системи на основі: а) числа ступенів свободи, б) кількості компонентів?
Напишіть варіанти рівняння Клапейрона – Клаузіуса у інтегральній формі, яка застосовується для фазових переходів при процесах плавлення та алотропних перетвореннях, випарюванні та сублімації.
Вкажіть області застосування правила фаз.
Лабораторна робота № 6. Розчини неелектролітів
Мета роботи – ознайомитися із впливом концентрації розчинів неелектролітів на зниження температури їх замерзання та підвищення їх температури кипіння.
ТЕОРЕТИЧНА ЧАСТИНА
Способи вираження складу розчину
Розчином називають однорідну систему, яка складається з двох або декількох компонентів.
Стан розчину визначається температурою, тиском та складом. Кількісний склад розчину може мати вираз різними способами та в різних одиницях. Розглянемо деякі з них.
Масова доля ω – відношення маси компонента до загальної маси розчину:
 (1) де m1,
m2…mk
– маса компонентів розчину.
(1) де m1,
m2…mk
– маса компонентів розчину.Молярна доля Х – відношення кількості речовини (n) компонента до загальної кількості речовини:
 (2) Сума молярних долей усіх компонентів
дорівнює одиниці:
(2) Сума молярних долей усіх компонентів
дорівнює одиниці:

Об’ємна доля φ – компонента – відношення об’єму компонента, який міститься у розчині, до загального об’єму розчину:
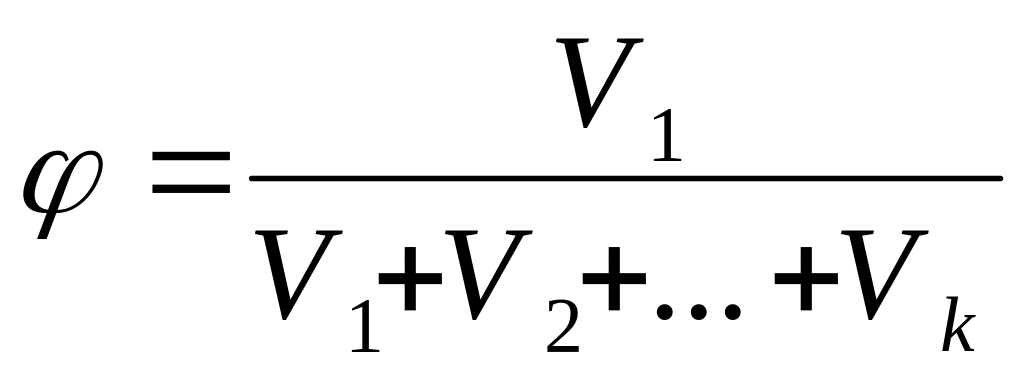 ,
(3) де V1,
V2…Vk
– об’єми компонентів. Для ідеальних
газів склад, який має вираз у об’ємній
долі, співпадає з молярною долею.
Масова, молярна та об’ємні долі
компонентів речовин – відносні
показники, тому їх одиниці є долі одиниці
або відсотки.
,
(3) де V1,
V2…Vk
– об’єми компонентів. Для ідеальних
газів склад, який має вираз у об’ємній
долі, співпадає з молярною долею.
Масова, молярна та об’ємні долі
компонентів речовин – відносні
показники, тому їх одиниці є долі одиниці
або відсотки.
Молярна концентрація (концентрація кількості речовини) с(Х) частин Х – відношення кількості речовини n (X), яка міститься у розчині до об’єму V розчину:
 (4) Одиницею молярної концентрації
є моль/м3. Частіше застосовують
моль/л або моль/дм3.
(4) Одиницею молярної концентрації
є моль/м3. Частіше застосовують
моль/л або моль/дм3.
Молярна концентрація еквіваленту *
 - відношення кількості речовини
- відношення кількості речовини
 еквіваленту до загального об’єму V
розчину:
еквіваленту до загального об’єму V
розчину:
 (4а) або
(4а) або
 (4б)
Одиницею молярної концентрації
еквіваленту є моль/м3. Частіше
застосовують моль/л або моль/дм3.
(4б)
Одиницею молярної концентрації
еквіваленту є моль/м3. Частіше
застосовують моль/л або моль/дм3.
Моляльність b(X) розчину – відношення кількості речовини n (X) розчинених часток Х до маси m розчинника:
 (5) Одиницею моляльності є моль/кг.
(5) Одиницею моляльності є моль/кг.
Для переходу від одного способу вираження складу розчину до іншого необхідно знати молярні маси розчинників (М1) та розчинної речовини (М2) та у ряді випадків густина розчину (ρ). Нижче наведені формули для такого переходу, де усі величини повинні бути виражені тільки в одиницях СІ: молярні маси у кг/моль, густина у кг/м3, молярна концентрація у моль/м3 , моляльність у моль/кг, а масова та молярна долі у долях від одиниці:
![]() (6)
(6)
![]() (7)
(7)
![]() (8)
(8)
![]() (9)
(9)
Для переходу від молярної концентрації до молярної концентрації еквіваленту використовують рівняння (4б). Число еквівалентності Z для даної речовини визначається як добуток ступеню окислення металу (кислотного залишку) на число атомів металу (число кислотних залишків) у молекулі.
