
- •Міністерство аграрної політики україни таврійський державний агротехнологічний університет
- •Методичні вказівки
- •Мелітополь – 2009
- •Техніка безпеки і правила роботи в хімічній лабораторії.
- •Правила роботи.
- •Лабораторна робота №1. Агрегатний стан речовин
- •Задачі для розв’язування на занятті:
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота №2. Хімічна термодінаміка
- •Задачі для розв’язування на занятті:
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота №3. Хімічна кінетика
- •Задачі для розв’язування на занятті:
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота №4. Хімічна рівновага
- •Задачі для розв’язування на занятті:
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота № 5. Фазова рівновага і фізико – хімічний аналіз
- •Фазові переходи в однокомпонентній системі. Діаграма стану води
- •Зміна ентальпії, ентропії та ізобарного потенціалу під час фазових переходів
- •Задачі для розв’язування на занятті:
- •Контрольні питання:
- •Лабораторна робота № 6. Розчини неелектролітів
- •Способи вираження складу розчину
- •Тиск насиченого пару розведених розчинів
- •Температура замерзання розбавлених розчинів
- •Температура кипіння розведених розчинів
- •Осмотичний тиск
- •Задачі для розв’язування на занятті:
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота № 7. Розчини електролітів
- •Роль розчинника в процесі дисоціації
- •Стан сильних електролітів у розчинах. Коефіцієнт активності
- •Дисоціація слабких електролітів
- •Рівновага в насичених розчинах електролітів
- •Реакція обміну в розчинах електролітів. Іонні рівняння
- •Задачі для розв’язування на занятті:
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота № 8. Розчини електролітів
- •Гідроліз солей
- •Задачі для розв’язування на занятті:
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота № 9. Окислювально-відновні реакції.
- •Методи упорядкування окисно-відновних рівнянь реакцій.
- •Задачі для розв’язування на занятті:
- •Контрольні питання:
- •Гальванічні елементи.
- •Задачі для розв’язування на занятті:
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота № 11. Електрохімія (електроліз. Гальванічні покриття)
- •Задачі для розв’язування на занятті:
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота № 12. Електрохімія (приготування та аналіз акумуляторної кислоти)
- •Свинцевий акумулятор (кислотний).
- •Р озрядження
- •Залізо-нікелевий акумулятор (лужний).
- •З арядження
- •Срібно – цинковий акумулятор.
- •Вимоги до електроліту.
- •Контрольні питання.
- •Лабораторна робота № 13. Поверхневі явища і адсорбція
- •Контрольні питання:
- •Задачі:
- •Лабораторна робота № 14. Колоїдні розчини
- •Методи визначення молекулярної маси високомолекулярних сполук.
- •Середня молекулярна маса
- •Контрольні питання:
- •Список літератури
Контрольні питання.
Які прилади називаються акумуляторами?
Напишіть рівняння хімічних реакцій які мають місце під час зарядження та розрядження свинцевого акумулятора?
Напишіть рівняння хімічних реакцій які мають місце під час зарядження та розрядження залізо-нікелевого акумулятора?
Якої величини електричний струм використовують для зарядження акумулятора?
Як визначити, коли акумулятор заряджений?
Що краще: акумулятор “перезарядити” чи “недозарядити”?
Струмом якої величини (малої чи великої) треба підзаряджувати акумулятор?
Що таке сухозаряджений акумулятор?
Які перетворення здійснюються з катодними та анодними пластинками під час зарядження свинцевого і залізо-нікелевого акумуляторів?
Що таке кипіння акумулятора?
Що таке сульфатація пластин у свинцевому акумуляторі?
Чому у свинцевому акумуляторі негативно заряджених пластин на одну більш ніж позитивних?
Що таке ємність акумулятора і від чого вона залежить?
Як можна визначити ємність акумулятора?
Які домішки в акумуляторній кислоті є особливо шкідливими?
Які електрохімічні процеси на електродах сприяють порушенню роботи свинцевого акумулятора?
Якими якісними реакціями можна виявити у кислоті наявність домішок хлору і заліза?
Як впливають домішки хлороводневої, азотної та органічних кислот на пластини акумуляторів?
До якої величини напруження ведуть розрядку акумулятора?
Як буде змінюватись щільність електроліту при зарядці і розрядці акумулятора?
Які переваги та недолік свинцевого акумулятора у порівнянні з лужним?
Що означає надпис на акумуляторі 6СТ-55 А/год.
Лабораторна робота № 13. Поверхневі явища і адсорбція
Мета роботи – ознайомлення студентів з класифікацією сорбційних процесів, теорією адсорбції та характеристикою поверхневих явищ.
ТЕОРЕТИЧНА ЧАСТИНА
Явище поглинання твердими або рідкими тілами речовин з навколишньої середи має назву сорбції. Сорбція, яка проходить тільки на поверхні тіла, має назву адсорбції. Якщо поглинання проходить по всій товщині, то таке явище має назву абсорбції.
Адсорбцію виражають в молях на квадратний метр. Але площу поверхні поглинувача знайти важчі, ніж його масу, тому частіше адсорбцію виражають у моль/ кг, а адсорбцію газів – у кубічних метрах на кілограм.
Величина адсорбції залежить від природи адсорбенту та адсортбату, від температури, від тиску газу або концентрації розчиненої речовини. Залежність адсорбції від тиску газоподібної речовини виражається емпіричним рівнянням Фрейндлиха:
![]() (1) де
х – кількість адсорбату в молях або
об’єм в метрах кубічних, m
– маса поглинача, кг, р – тиск, Па,
а або n – константи, які
характерні для даного процесу адсорбції
(n>1).
(1) де
х – кількість адсорбату в молях або
об’єм в метрах кубічних, m
– маса поглинача, кг, р – тиск, Па,
а або n – константи, які
характерні для даного процесу адсорбції
(n>1).
Так як це рівняння справедливе тільки при постійній температурі, то його називають ізотермою адсорбції.
Константи а та
![]() в рівнянні Фрейндлиха можуть бути
визначені графічним способом. З цією
метою логарифмують рівняння (1):
в рівнянні Фрейндлиха можуть бути
визначені графічним способом. З цією
метою логарифмують рівняння (1):
![]() (2) Д
(2) Д алі
в логарифмічних координатах строять
графік ізотерми адсорбції: по осі абсцис
відкладають логарифми рівноважних
тисків lg p,
а по осі ординат – логарифми адсорбції
алі
в логарифмічних координатах строять
графік ізотерми адсорбції: по осі абсцис
відкладають логарифми рівноважних
тисків lg p,
а по осі ординат – логарифми адсорбції
![]() .
Крива на графіку буде представляти
собою пряму лінію. Якщо цю лінію продовжити
до перехрестя її з осію ординат, то вона
на ній відділить відрізок, який буде
дорівнювати lg a.
Це слідує з рівняння (2). Якщо lg
p = 0, то
.
Крива на графіку буде представляти
собою пряму лінію. Якщо цю лінію продовжити
до перехрестя її з осію ординат, то вона
на ній відділить відрізок, який буде
дорівнювати lg a.
Це слідує з рівняння (2). Якщо lg
p = 0, то
![]() .
Тангенс кута нахилу цієї прямої до осі
абсцис є значення
.
.
Тангенс кута нахилу цієї прямої до осі
абсцис є значення
.
Але рівняння Фрейндлиха не можливо застосовувати в області малих та великих тисків адсорбіруємої речовини. Порівняльно задовільну кількісну характеристику адсорбції як при низьких, так і при високих тисках адсорбуємої речовини дає рівняння ізотерми адсорбції Лєнгмюра, яке було виведено на основі молекулярно – кінетичної теорії:
![]() (3) де Г – кількість адсорбуємої речовини
(моль) одиницею поверхні поглинувача,
Г∞ - кількість адсорбуємої речовини в
молях при повному насичені одиниці
поверхні, р – тиск, b –
константа адсорбуємої рівноваги.
(3) де Г – кількість адсорбуємої речовини
(моль) одиницею поверхні поглинувача,
Г∞ - кількість адсорбуємої речовини в
молях при повному насичені одиниці
поверхні, р – тиск, b –
константа адсорбуємої рівноваги.
Для визначення фізичного смислу константи у рівнянні Лєнгмюра необхідно прийняти деяке часткове значення для Г, наприклад Г= Г∞/2. тоді, підставляючи це в рівняння (3), отримаємо:
![]() ;
2p = p+b;
b=p
;
2p = p+b;
b=p
Звідси маємо, що константа чисельно дорівнює тому тиску адсорбтива, при якому адсорбція дорівнює половині граничної. Таким чином, усі величини, які входять до рівняння Лєнгмюра, мають певний фізичний смисл та теоретично обґрунтовані.
Для визначення Г∞ та b графічним методом необхідно рівняння Лєнгмюра привести до лінійного вигляду. З цією метою одиницю ділять на обидві частини рівняння:
 ;
;
![]() (4)
(4)
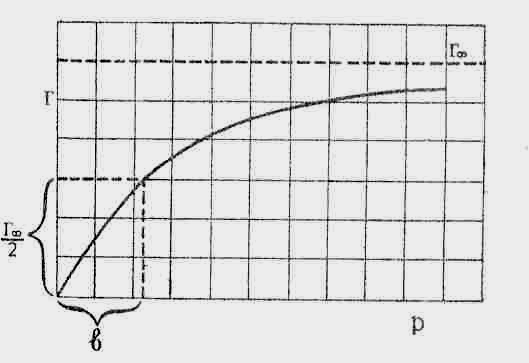
Якщо на осі абсцис відкласти величину
![]() ,
а на осі ординат
,
а на осі ординат
![]() ,
то на графіку отримаємо пряму лінію. З
рівняння (4) слідує, що якщо
=0,
то
=
,
то на графіку отримаємо пряму лінію. З
рівняння (4) слідує, що якщо
=0,
то
=![]() .
Звідси, якщо пряму лінію графіку
продовжити до перехрестя з осію ординат,
то відрізок ОА на осі ординат буде
дорівнювати
.
.
Звідси, якщо пряму лінію графіку
продовжити до перехрестя з осію ординат,
то відрізок ОА на осі ординат буде
дорівнювати
.
Тангенс кута нахилу цієї прямої до осі абсцис є значення
![]() . Визначивши графічним методом константу
Г∞, константу b тепер
можна також розрахувати з рівняння (3).
. Визначивши графічним методом константу
Г∞, константу b тепер
можна також розрахувати з рівняння (3).
Якщо речовина адсорбується твердим тілом з розчину, то в рівняннях Фрейндлиха та Лєнгмюра тиск р замінюють величиною рівноважної молярної концентрації С:
![]() (5)
(5)
![]() (6)
(6)
Якщо ж адсорбція якоїсь речовини проходить на поверхні розчину, то це призводить до змін поверхневого натягнення. Кількісне співвідношення між величиною адсорбції та змінами поверхневого натягнення з концентрацією розчину визначається рівнянням Гібса (1878р.):
![]() (7) де Г – адсорбція – надлишок
розчиненої речовини, моль/м2, с –
молярна концентрація розчину, моль/л,
R – газова
постійна, Дж/(моль*К), Т – температура,
К, σ – поверхневе натягнення, Н/м.
(7) де Г – адсорбція – надлишок
розчиненої речовини, моль/м2, с –
молярна концентрація розчину, моль/л,
R – газова
постійна, Дж/(моль*К), Т – температура,
К, σ – поверхневе натягнення, Н/м.
Для приблизних розрахунків
![]() можна замінити на
можна замінити на
![]() ,
тоді
,
тоді
![]() (8)
(8)
З рівняння маємо, що якщо з збільшенням концентрації розчиненої речовини поверхневе натягнення зменшується, то адсорбція позитивна. Якщо ж розчинена речовина поверхневе натягнення збільшує, то адсорбція негативна.
ЕКСПЕРИМЕНТАЛЬНА ЧАСТИНА
Мета роботи – ознайомлення студентів з сорбційними процесами, та характеристикою поверхневих явищ.
Прилади та реактиви: штатив з набором пробірок, скляні стакани. Розчини: фуксин, спиртовий розчин фуксину, сульфат міді, дихромат калію, перманганат калію, крохмаль, йод. Активоване вугілля. Скляні палички. Центрифуга.
Дослід 1. адсорбція фарбників.
В дві сухі конічні пробірки внесіть по 30-35мг активованого вугілля. В першу пробірку внесіть 5-7 крапель розчину головного фарбника – фуксину. До другої пробірки – 5-7 крапель спиртового розчину фуксину.
Суміші у пробірках перемішайте скляною паличкою та відцентрифугуйте. Що спостерігаємо?
Дослід 2. адсорбція зафарбованих іонів вугіллям.
В окремі конічні пробірки внесіть по 10-15 крапель розведених 0,02М розчинів сульфату міді, дихромату калію та перманганату калію. Додайте до кожної пробірки по 30-35мг активованого вугілля, багато раз перемішайте та відцентрифугуйте. Що спостерігаємо?
Дослід 3. вплив температури на адсорбцію.
Внесіть у пробірку 1мл розчину крохмалю, додайте 1 краплю розчину йоду. Суміш перемішайте, проводити нагрівання до повного знебарвлення розчину. Чому розчин знебарвився? Дайте розчину охолодитися. Спостерігайте появу синього кольору. Як впливає збільшення температури на адсорбцію?
