
- •Методичні вказівки
- •Загальні вказівки до проведення та оформлення студентами лабораторних робіт
- •Лабораторна робота № 1 Методи та засоби вимірювання термодинамічних параметрів. Похибки вимірювань та їх оцінка
- •Формули визначення похибки
- •Засоби вимірювання температури
- •Засоби вимірювання тиску
- •Засоби вимірювання швидкостей і витрат рідин
- •Похибки вимірювань і їх оцінка
- •Лабораторна робота № 2 дослідження процесу, що протікає при постійному об'ємі
- •Опис лабораторної установки
- •Підготовка лабораторної установки до роботи
- •Робота з установкою
- •Теоретичні відомості та обробка результатів досліджень
- •Лабораторна робота №3 Дослідження процесу, що протікає при постійній температурі
- •Робота з установкою
- •Етапи роботи
- •Теоретичні відомості і обробка результатів досліджень
- •Лабораторна робота №4 Дослідження процесу, який протікає при постійному тиску
- •Теоретичні відомості і обробка результатів досліджень
- •Лабораторна робота № 5 Експериментальна перевірка закону стану ідеального газу
- •Короткі теоретичні відомості
- •Порядок проведення експериментальних досліджень
- •Обробка результатів досліджень
- •Лабораторна робота № 6 Визначення теплоти пароутворення
- •Основні поняття і визначення
- •Опис лабораторної установки
- •Порядок проведення роботи
- •Лабораторна робота № 7 Визначення залежності температури насичення від тиску
- •Опис лабораторної установки
- •Порядок проведення роботи
- •Лабораторна робота № 8 Визначення показників адіабати
- •Методика експериментального визначення показника адіабати
- •Порядок проведення досліду
- •Лабораторна робота № 9 визначення ізобарної теплоємності повітря
- •Теоретичні основи
- •Опис дослідної установки
- •Методика проведення і обробка результатів вимірювань
- •Лабораторна робота №10 визначення питомої теплоємності речовини
- •Коротка теорія
- •Опис установки
- •Порядок виконання і етапу роботи
- •Облік теплоти, яка йде на нагрівання калориметра
- •Облік теплових витрат
- •Порядок виконання II етану роботи
- •Порядок роботи
- •Результати вимірювань і розрахунків шуканих величин
- •Коротка теорія
- •Опис установки
- •Порядок виконання роботи
- •(Титульний лист)
- •Лабораторна робота №...
- •II. Коротка теорія
- •III. Таблиця вимірів і розрахунку величин, що визначаються
- •Параметри стану
- •Співвідношення між різними одиницями вимірювання тиску
- •Співвідношення між одиницями роботи і тепла
- •Література:
Лабораторна робота №4 Дослідження процесу, який протікає при постійному тиску
Мета роботи: закріпити і поглибити знання про зміну параметрів стану ідеального газу, що виникають в термодинамічних процесах при постійному тиску.
Дана лабораторна робота виконується на лабораторній установці, описаній в лабораторних роботах №2 і №3.
Для вивчення термодинамічного процесу, який протікає при постійному тиску, використовують результати досліджень, отримані в ході виконання експериментально -дослідницьких робот №2 і №3. При цьому, обробці підлягають параметри газового стану, отримані для однакових значень Р.
Теоретичні відомості і обробка результатів досліджень
Процес,
який протікає при постійному тиску,
називають ізобарним
(dp
= 0, Р
= соnst).
Крива
процесу називається ізобарою.
З
рівняння стану ідеального газу РV
=
PТ
для
ізобарного
процесу знаходимо:
![]() ,
так як Р=const,
то
і
,
так як Р=const,
то
і
![]() і
і
![]() - закон
Гей-Люссака, або при Р
= соnst:
- закон
Гей-Люссака, або при Р
= соnst:
![]() або
або
![]() .
.
В ізобарному процесі об'єми однієї і тієї ж кількості газу змінюються прямо пропорційно абсолютним температурам.
При ізобарному процесі температура газу при розширенні зростає, при стисканні зменшується.
Питома робота зміни об'єму при постійному тиску виражається рівнянням:
 .
.
або,
так як PV=RT,
маємо
![]() .
.
Корисна
зовнішня робота
![]() .
.
Кількість теплоти, надана тілу в ізобарному процесі:
- при постійній теплоємності дорівнює:
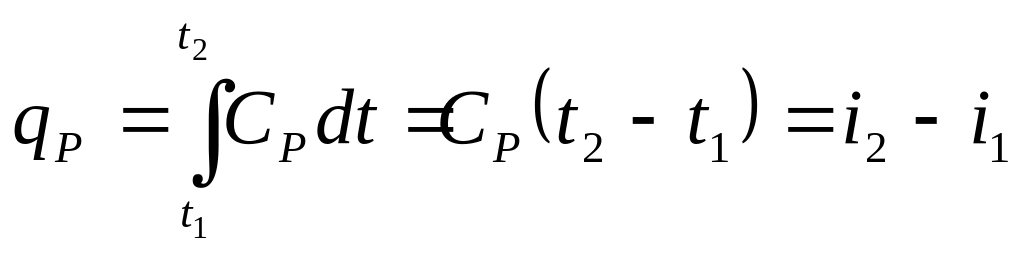 ;
;
- при змінній теплоємності:
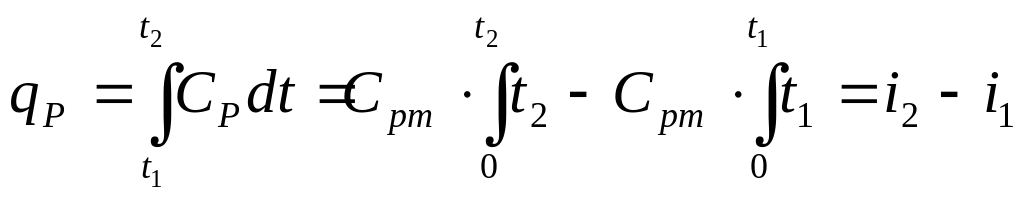 .
.
Р

V

Частина
наданої теплоти qр,
яка
дорівнює
![]() ,
переходе
в роботу розширення, а інша частина йде
на збільшення
внутрішньої енергії тіла.
,
переходе
в роботу розширення, а інша частина йде
на збільшення
внутрішньої енергії тіла.
В процесах зміни стану газу при постійному тиску .зовнішню теплоту
можна визначити як різницю ентальпій кінцевого і початкового станів тіла, які
можна встановити з таблиць термодинамічних властивостей газів.
Для оборотного ізобарного процесу при постійній теплоємності зміну ентропії знаходять з рівняння:
![]() ,
,
але при Р = соnst:
![]()
тому:
![]()
Ізобара на ТS - діаграмі подібно ізохорі спрямована випуклістю вниз (при СР - const ізобара - логарифмічна крива). Дотична до кривої в будь-якій її точці дає значення істинної теплоємності Ср.
Всі ізобари являються еквідистантними кривими, які мають при одній і тій же температурі однакові кутові коефіцієнти. Горизонтальна відстань між ізобарами різних тисків визначається з рівняння:
, при Т = соnst:
![]() .
.
3 останнього рівняння витікає, що відстань між ізобарами залежить від величини тисків і природи газу. Чим більше тиск газу, тим ізобара ближче до вісі ординат.
У випадку здійснення ізохорного і ізобарного процесів в одному інтервалі температур зростання ентропії буде більше в ізобарному процесі, так як Ср завжди більше Сv. Ізобари являються більш похилими кривими, ніж ізохори.
За даними, наведеними в табл. будують ТS і РV -діаграми ізобарного процесу і роблять відповідні висновки з отриманих експериментальних даних.
Таблиця експериментальних і розрахункових параметрів газу при ізобарному прогресі зміни його стану
Таблиця 4.1.
№ з/п |
hN мм. вод. ст. |
В+9,8 hN Па |
t, 0С |
TN=273.15+ + t,0С |
VN=VC+ +((πd2)/4)hN |
V/T |
L=P(V2- -V1), P=const |
CP(t2- -t1) |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
Таблиця 4.1. (продовження)
|
ln |
|
ln |
|
ln |
ΔS=(S1- -S2)= =CP · ·ln(T2/T1) |
ΔS=CP· ·ln(V2/V1) |
R· ·ln(P2/ /P1) |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
Питання:
1.Дати визначення ізобарного процесу.
2. Закон Гей-Люсака.
3. Пояснити ізобарний процес на T-S діаграмі.
4.Пояснити схему лабораторної установки.
5. Розповісти послідовність виконання експерименту.
