
- •Методичні вказівки
- •Загальні вказівки до проведення та оформлення студентами лабораторних робіт
- •Лабораторна робота № 1 Методи та засоби вимірювання термодинамічних параметрів. Похибки вимірювань та їх оцінка
- •Формули визначення похибки
- •Засоби вимірювання температури
- •Засоби вимірювання тиску
- •Засоби вимірювання швидкостей і витрат рідин
- •Похибки вимірювань і їх оцінка
- •Лабораторна робота № 2 дослідження процесу, що протікає при постійному об'ємі
- •Опис лабораторної установки
- •Підготовка лабораторної установки до роботи
- •Робота з установкою
- •Теоретичні відомості та обробка результатів досліджень
- •Лабораторна робота №3 Дослідження процесу, що протікає при постійній температурі
- •Робота з установкою
- •Етапи роботи
- •Теоретичні відомості і обробка результатів досліджень
- •Лабораторна робота №4 Дослідження процесу, який протікає при постійному тиску
- •Теоретичні відомості і обробка результатів досліджень
- •Лабораторна робота № 5 Експериментальна перевірка закону стану ідеального газу
- •Короткі теоретичні відомості
- •Порядок проведення експериментальних досліджень
- •Обробка результатів досліджень
- •Лабораторна робота № 6 Визначення теплоти пароутворення
- •Основні поняття і визначення
- •Опис лабораторної установки
- •Порядок проведення роботи
- •Лабораторна робота № 7 Визначення залежності температури насичення від тиску
- •Опис лабораторної установки
- •Порядок проведення роботи
- •Лабораторна робота № 8 Визначення показників адіабати
- •Методика експериментального визначення показника адіабати
- •Порядок проведення досліду
- •Лабораторна робота № 9 визначення ізобарної теплоємності повітря
- •Теоретичні основи
- •Опис дослідної установки
- •Методика проведення і обробка результатів вимірювань
- •Лабораторна робота №10 визначення питомої теплоємності речовини
- •Коротка теорія
- •Опис установки
- •Порядок виконання і етапу роботи
- •Облік теплоти, яка йде на нагрівання калориметра
- •Облік теплових витрат
- •Порядок виконання II етану роботи
- •Порядок роботи
- •Результати вимірювань і розрахунків шуканих величин
- •Коротка теорія
- •Опис установки
- •Порядок виконання роботи
- •(Титульний лист)
- •Лабораторна робота №...
- •II. Коротка теорія
- •III. Таблиця вимірів і розрахунку величин, що визначаються
- •Параметри стану
- •Співвідношення між різними одиницями вимірювання тиску
- •Співвідношення між одиницями роботи і тепла
- •Література:
Лабораторна робота № 5 Експериментальна перевірка закону стану ідеального газу
Мета роботи: закріпити і поглибити знання про закони стану ідеального газу, отримати навички роботи з засобами вимірювання.
Короткі теоретичні відомості
Встановлено, що ідеальні гази і реальні гази, які знаходяться при певних тисках і температурах, підпорядковуються законам:
Бойля-Маріотта:
![]() або
або
![]() ;
(5.1.)
;
(5.1.)
Гей-Люссака:
![]() або
або
![]() ;
(5.2.)
;
(5.2.)
а також
Клапейрона:
![]() . (5.3.)
. (5.3.)
Використавши відоме значення:
μR - 8314,2 Дж/(кмольград), (5.4.)
універсальної газової постійної, де μ - молекулярна маса газу; рівняння Клапейрона може бути записано:
![]() ,
(5.5.)
,
(5.5.)
де: Р - тиск, Па; V - об'єм, який займає газ, м3; т - маса газу, кг; Т - абсолютна температура, °К.
Аналізуючи рівняння (5.5.) приходимо до висновку, що для даної маси газу добуток РV буде змінюватись прямо пропорційно температурі Т. В ко-ординатах (Т,РV) ця залежність повинна бути представлена у вигляді прямої лінії, проведеної до осі Т під кутом α. Змінюючи параметри газового стану, використовуючи результати експериментальних досліджень, представлених в координатах (Т ,РV), легко визначити значення α.
З іншої сторони значення α, можна визначити з рівняння (5.5.):
![]() ,
(5.6.)
,
(5.6.)
Звідки:
![]() .
(5.7.)
.
(5.7.)
У випадку проведення досліджень з використанням, в якості досліджуваного, атмосферного повітря, для визначення можна скористатись табличними значеннями μ=28,96 кг/моль і ρ=1,293 кг/м3, де ρ- густина повітря при нормальних фізичних умовах (Р =101325 Н/м2, Т=273,15°С), Vμ=22,4143 м3/кмоль, Vμ- об'єм одного моля при нормальних умовах.
Треба відмітити складність в безпосередньому визначенні маси газу, який підлягає експериментальним дослідженням, що з достатньою для досліджень точністю, значно простіше визначати розрахунковим шляхом, визначивши попередньо об'єм V, де V - об'єм посудини, в яку вміщується газ, що досліджується.
Використовуючи залежність:
![]() (5.8.)
(5.8.)
яку можна отримати з законів Бойля-Маріотта і Гей-Люссака, залежність (5.8.) називають об'єднаним законом Бойля-Маріотта і Гей-Люссака, з якої можна визначити масу досліджуваного газу. За аналогією з (6.8.) для двох сполук газу запишемо:
![]() (5.9.)
(5.9.)
де: Рн , Vн , Тн - тиск, температура і об'єм при нормальних умовах, який займав би газ, якщо він займав об'єм V при початкових параметрах дослідження - Рп,Vп, тоб-то при тиску і температурі в приміщенні перед початком дослідження. Об'єм V можна з достатньою точністю визначити дослідницьким шляхом, наприклад, заповнивши посудину водою і визначивши об'єм залитої води. Перед заповненням повітря посудину просушити. Використавши залежність (6.9.) можна записати:
![]() .
.
Тоді маса газу, який заповнив V при відомих ρн, Тп буде дорівнювати:
![]() . (5.10.)
. (5.10.)
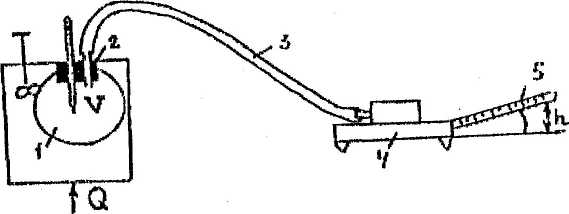
Рис. 5.1. Принципова схема установки
На Рис.5.1. наведена принципова схема установки: колба 1 об'ємом V ос-нащена пробкою з термометром і штуцером 2, через який внутрішня порожнина колби з'єднана за допомогою капілярного шлангу 3 з мік-романометром 4. Вимірювальна трубка 5 мікроманометру 4 протарирована з метою визначення, якому об'єму VТ відповідає один її мм довжини (значення VT дає викладач). Колба вміщена в посудину з водою, оснащену мішалкою, до якої підводиться регульований тепловий потік Q.
