
- •Методичні вказівки
- •Загальні вказівки до проведення та оформлення студентами лабораторних робіт
- •Лабораторна робота № 1 Методи та засоби вимірювання термодинамічних параметрів. Похибки вимірювань та їх оцінка
- •Формули визначення похибки
- •Засоби вимірювання температури
- •Засоби вимірювання тиску
- •Засоби вимірювання швидкостей і витрат рідин
- •Похибки вимірювань і їх оцінка
- •Лабораторна робота № 2 дослідження процесу, що протікає при постійному об'ємі
- •Опис лабораторної установки
- •Підготовка лабораторної установки до роботи
- •Робота з установкою
- •Теоретичні відомості та обробка результатів досліджень
- •Лабораторна робота №3 Дослідження процесу, що протікає при постійній температурі
- •Робота з установкою
- •Етапи роботи
- •Теоретичні відомості і обробка результатів досліджень
- •Лабораторна робота №4 Дослідження процесу, який протікає при постійному тиску
- •Теоретичні відомості і обробка результатів досліджень
- •Лабораторна робота № 5 Експериментальна перевірка закону стану ідеального газу
- •Короткі теоретичні відомості
- •Порядок проведення експериментальних досліджень
- •Обробка результатів досліджень
- •Лабораторна робота № 6 Визначення теплоти пароутворення
- •Основні поняття і визначення
- •Опис лабораторної установки
- •Порядок проведення роботи
- •Лабораторна робота № 7 Визначення залежності температури насичення від тиску
- •Опис лабораторної установки
- •Порядок проведення роботи
- •Лабораторна робота № 8 Визначення показників адіабати
- •Методика експериментального визначення показника адіабати
- •Порядок проведення досліду
- •Лабораторна робота № 9 визначення ізобарної теплоємності повітря
- •Теоретичні основи
- •Опис дослідної установки
- •Методика проведення і обробка результатів вимірювань
- •Лабораторна робота №10 визначення питомої теплоємності речовини
- •Коротка теорія
- •Опис установки
- •Порядок виконання і етапу роботи
- •Облік теплоти, яка йде на нагрівання калориметра
- •Облік теплових витрат
- •Порядок виконання II етану роботи
- •Порядок роботи
- •Результати вимірювань і розрахунків шуканих величин
- •Коротка теорія
- •Опис установки
- •Порядок виконання роботи
- •(Титульний лист)
- •Лабораторна робота №...
- •II. Коротка теорія
- •III. Таблиця вимірів і розрахунку величин, що визначаються
- •Параметри стану
- •Співвідношення між різними одиницями вимірювання тиску
- •Співвідношення між одиницями роботи і тепла
- •Література:
Порядок проведення досліду
1. За допомогою насосу довести тиск повітря в посудині до 250-450 мм вод. ст.
Почекати, поки показання манометра h1 не стане постійним і записати його.
Швидко випустити повітря через клапан 3 так, щоб показання манометра 2 стало рівним нулю, після чого клапан знову закрити.
Почекати, поки показання манометра h3 не стане постійним.
За допомогою барометра виміряти барометричний тиск.
6. Розрахувати показник адіабати за формулою (8.8.), при цьому всі значення тисків потрібно заздалегідь виразити в одиницях стандарту СЕВ,
тобто
Па.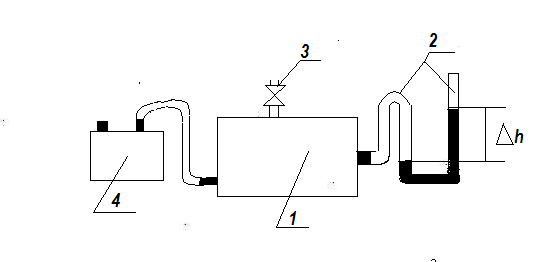
Рис. 8.2.
1- закрита посудина; 2 – U – подібний манометр; 3 – клапан; 4 – насос.
Схема установки
Дослідна установка складається із закритої посудини 1, оснащеної рідинним U - подібним манометром 2, клапаном 3 і насосом 4 (Рис. 8.2.).
Питання:
Дати визначення поняття «ізобарний процес».
Пояснити адіабатний процес у P-V координатах.
Пояснити схему установки.
Розповісти порядок проведення досліду.
Лабораторна робота № 9 визначення ізобарної теплоємності повітря
Мета лабораторної роботи: ознайомити студентів з основними методами проведення калориметричного експерименту.
Одним із способів визначення теплоємності газоподібних тіл є метод проточного калориметрування, суть якого полягає в наступному. Якщо до потоку газу, що протікає через калориметр, підвести деяку кількість теплоти, то температура газу зросте. При встановленому тепловому режимі роботи такого калориметра витрата повітря, його температура на вході і на виході, кількість підведеної теплоти постійні у часі. Отримані дослідні дані у режимі постійного тиску дозволяють розраховувати середню теплоємність повітря.
Задача лабораторної роботи полягає у визначенні середньої ізобарної теплоємності повітря при атмосферному тиску і порівняно невеликій температурі.\
Теоретичні основи
Теплоємністю називається кількість теплоти, яку необхідно підвести або відвести від робочого тіла, щоб змінити його температуру на один градус. В залежності від температурного інтервалу розрізняють істинну і середню теплоємності.
Істинною теплоємністю називається теплоємність, віднесена до нескінченно малої зміни температури, Дж/град:
![]() .
(9.1.)
.
(9.1.)
Середньою теплоємністю називається теплоємність, віднесена до кінцевої різниці температур, Дж/град:
![]() .
(9.2.)
.
(9.2.)
В
термодинамічних розрахунках розглядається
питома теплоємність,
віднесена до одиниці кількості речовини.
Тому
розрізняють
масову
теплоємність,
віднесену до 1 кг
робочого
тіла
С (Дж/(кг![]() ));
об'ємну, віднесену
до 1 м3
газу
при нормальних
фізичних умовах С’ (Дж/(м3
))
і
молярну,
віднесену
до 1 кмоль
μС
(Д/(кмольК))
));
об'ємну, віднесену
до 1 м3
газу
при нормальних
фізичних умовах С’ (Дж/(м3
))
і
молярну,
віднесену
до 1 кмоль
μС
(Д/(кмольК))
Питомі
теплоємності зв'язані між собою простими
аналітичними
залежностями. Теплоємність 1 кмоль
у
д. разів більше
теплоємності 1 кг
газу,
тобто μС=![]() ;
для теплоємності
1 м3
при
нормальних фізичних умовах можна
написати
співвідношення, Дж/(м3К):
;
для теплоємності
1 м3
при
нормальних фізичних умовах можна
написати
співвідношення, Дж/(м3К):
![]() .
(9.3.)
.
(9.3.)
Із визначення масової теплоємності маємо, Дж/кг:
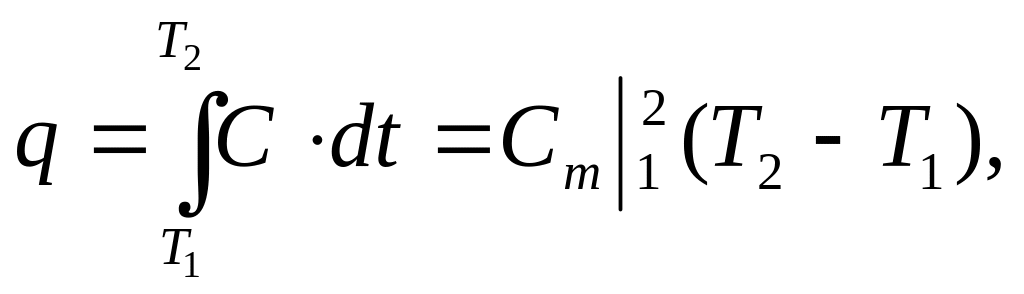
звідки
отримаємо, Дж/(кгК):
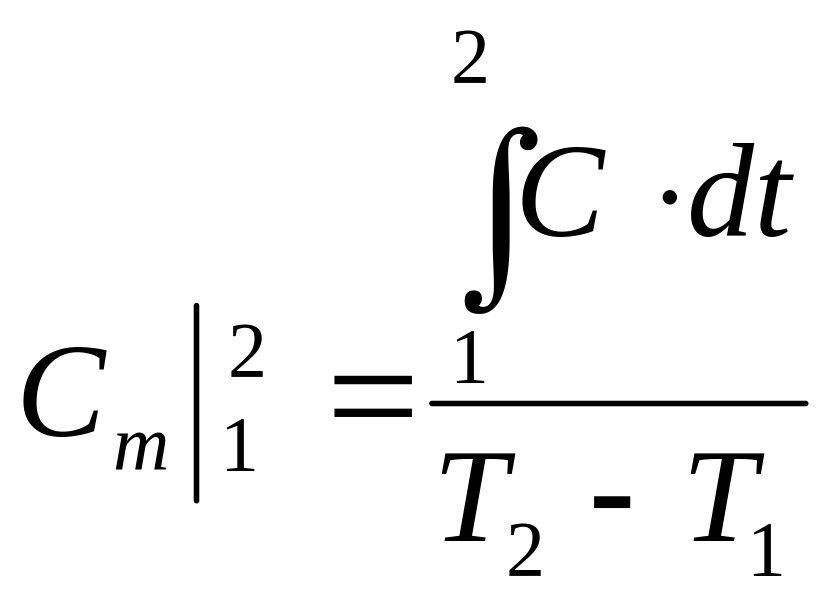 , (9.4.)
, (9.4.)
що характеризує зв'язок між істинною та середньою теплоємностями.
Теплоємність не є параметром стану робочого тіла і для любого газу залежить від характеру термодинамічного процесу.
Так як кількість теплоти залежить від характеру процесу, то і теплоємність залежить від умов протікання процесу теплообміну. Загальний інтерес представляють теплоємності в процесах при постійному об'ємі (СV) і постійному тиску (СР).
Щоб встановити зв'язок між цими теплоємностями, скористаємося рівнянням першого закону термодинаміки:
![]() .
(9.5.)
.
(9.5.)
Для ізобарного процесу з ідеальним газом:
![]() (9.6.)
(9.6.)
з
рівняння стану
![]() маємо, що
маємо, що
![]()
Звідси
отримуємо,
![]()
СР-СV=К. (9.7.)
Ця залежність встановлена Майером.
Виходячи з співвідношення (9.3.) для молярної теплоємності ізобарного процесу маємо:
![]() (9.8.)
(9.8.)
У
табл.9.1.
наведено наближені значення величин
![]() і
і
![]() для
іде-альних газів, отриманих на основі
молекулярно-кінетичної
теорії теплоємностей.
для
іде-альних газів, отриманих на основі
молекулярно-кінетичної
теорії теплоємностей.
Ізобарну теплоємність газів і парів майже завжди вимірюють у проточному калориметрі. Для цього через калориметр пропускають газ, а до газу підводять теплоту. При цьому вимірюють витрату газу, кількість підведеної теплоти, температуру газу на вході і на виході калориметра.
Таблиця 9.1.
Газ |
Молекулярна теплоємність ккал/(кмоль-К) |
Теплоємність кДж/(кмопь-К) |
|
||
|
|
|
|
||
одноатомний |
3 |
5 |
12,5 |
20,8 |
1,67 |
двохатомний |
5 |
7 |
20,8 |
29,1 |
1,4 |
багатоатомний |
7 |
9 |
29,1 |
37,4 |
1,3 |
Розрахункова формула для визначення теплоємності Ср у проточному калориметрі може бути отримана наступним чином. У випадку стаціонарного режиму калориметра запишемо рівняння першого закону термодинаміки для потоку:
![]() ,
(9.9.)
,
(9.9.)
де: qел - теплота, підведена від електричного нагрівача до 1 кг газу, qТ.П.- теплові втрати у навколишнє середовище в розрахунку на 1 кг газу, i1, i2 - ентальпія газу відповідно до і після нагріву, Дж/кг; ω1,ω2 - швидкість руху газу відповідно на вході і виході калориметра, м/с; Z1, Z2- рівень перерізу відповідно підводу та відводу газів у калориметрі, м; lT - технічна робота газу, Дж/кг.
Так як швидкості газу ω1 i ω2 майже не відрізняються одна від одної, технічна ро-бота не виконується, а калориметриметр розташований горизонтально Z1= Z2, то рівняння (9.9.) приймає вигляд:
qел - qТ.П.=і2 – і1 . (9.10.)
В загальному випадку ентальпія газу залежить від температури і тиску. Проте повітря при атмосферному тиску за властивостями дуже близьке до ідеального газу, а ентальпія ідеального газу від тиску не залежить. Відповідно,
![]() ,
(9.11.)
,
(9.11.)
для кінцевої різниці температур:
![]() ,
(9.12.)
,
(9.12.)
де СРт - середня теплоємність в даному інтервалі температур. Підставляючи рівняння (9.12) у (9.10), отримуємо розрахункову формулу для визначення се-
редньої ізобарної теплоємності:
qел
-
qТ.П.=![]() . (9.13)
. (9.13)
![]() (9.14.)
(9.14.)
Таким чином, експеримент у проточному калориметрі дозволяє отримати теплоємність СРт.
Для реальних газів необхідно враховувати залежність ентальпії від тиску і тому рівняння для розрахунку теплоємності ускладнюється.
У формулі (9.14.) qел і qТ.П. розраховані на 1 кг робочого тіла. В експерименті ці величини визначаються за одиницю часу (за 1с –Qел і QТ.П.), а за 1 с через калориметр проходить не 1 кг газу, а т кг. Тому розрахункова формула може бути представлена у вигляді,
![]() .
(9.15.)
.
(9.15.)
