
- •Методичні вказівки
- •Загальні вказівки до проведення та оформлення студентами лабораторних робіт
- •Лабораторна робота № 1 Методи та засоби вимірювання термодинамічних параметрів. Похибки вимірювань та їх оцінка
- •Формули визначення похибки
- •Засоби вимірювання температури
- •Засоби вимірювання тиску
- •Засоби вимірювання швидкостей і витрат рідин
- •Похибки вимірювань і їх оцінка
- •Лабораторна робота № 2 дослідження процесу, що протікає при постійному об'ємі
- •Опис лабораторної установки
- •Підготовка лабораторної установки до роботи
- •Робота з установкою
- •Теоретичні відомості та обробка результатів досліджень
- •Лабораторна робота №3 Дослідження процесу, що протікає при постійній температурі
- •Робота з установкою
- •Етапи роботи
- •Теоретичні відомості і обробка результатів досліджень
- •Лабораторна робота №4 Дослідження процесу, який протікає при постійному тиску
- •Теоретичні відомості і обробка результатів досліджень
- •Лабораторна робота № 5 Експериментальна перевірка закону стану ідеального газу
- •Короткі теоретичні відомості
- •Порядок проведення експериментальних досліджень
- •Обробка результатів досліджень
- •Лабораторна робота № 6 Визначення теплоти пароутворення
- •Основні поняття і визначення
- •Опис лабораторної установки
- •Порядок проведення роботи
- •Лабораторна робота № 7 Визначення залежності температури насичення від тиску
- •Опис лабораторної установки
- •Порядок проведення роботи
- •Лабораторна робота № 8 Визначення показників адіабати
- •Методика експериментального визначення показника адіабати
- •Порядок проведення досліду
- •Лабораторна робота № 9 визначення ізобарної теплоємності повітря
- •Теоретичні основи
- •Опис дослідної установки
- •Методика проведення і обробка результатів вимірювань
- •Лабораторна робота №10 визначення питомої теплоємності речовини
- •Коротка теорія
- •Опис установки
- •Порядок виконання і етапу роботи
- •Облік теплоти, яка йде на нагрівання калориметра
- •Облік теплових витрат
- •Порядок виконання II етану роботи
- •Порядок роботи
- •Результати вимірювань і розрахунків шуканих величин
- •Коротка теорія
- •Опис установки
- •Порядок виконання роботи
- •(Титульний лист)
- •Лабораторна робота №...
- •II. Коротка теорія
- •III. Таблиця вимірів і розрахунку величин, що визначаються
- •Параметри стану
- •Співвідношення між різними одиницями вимірювання тиску
- •Співвідношення між одиницями роботи і тепла
- •Література:
Теоретичні відомості та обробка результатів досліджень
Ізохорним процесом називають процес, який відбувається при постійному об'ємі (dV = соnst, або V = соnst). Крива процесу називається ізохорою. В координатах Р-V ізохора зображується прямою лінією, яка відтинає на вісі О — V відрізок, рівний V = соnst і паралельно вісі ОР. З рівняння стану ідеального газу РV = RТ при V = сonst отримуємо:
![]() .
(2.1.)
.
(2.1.)
Це співвідношення називають законом Шарля. З закону Шарля слідує, що
![]() (2.2.)
(2.2.)
Зовнішня робота газу при V = сonst дорівнює нулю, так як dV = соnst. З цього випливає:
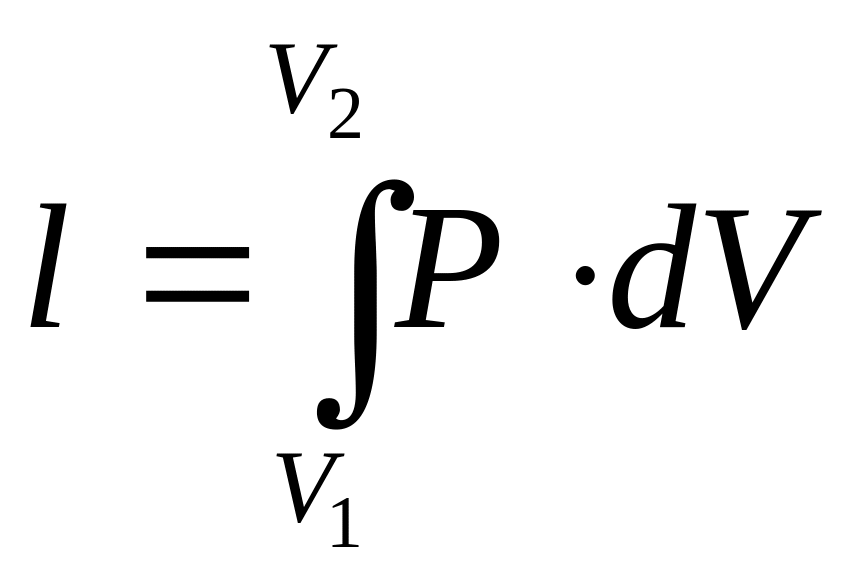 .
.
Корисна зовнішня робота l’, що використовується над об’ємом, який міститься в колбі, дорівнює:
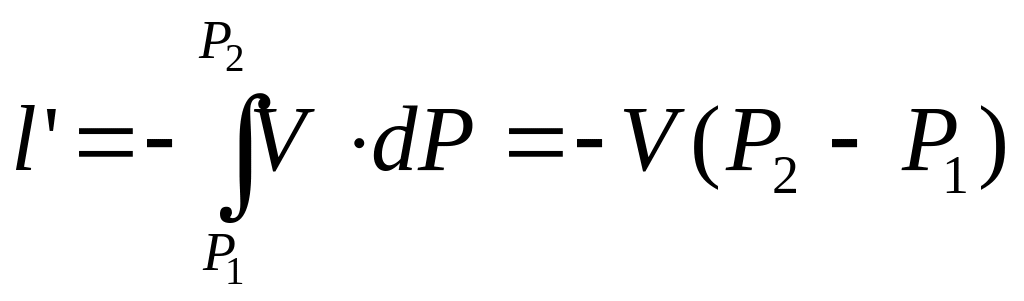 ,
,
де: V – об’єм повітря, який знаходиться в колбі і визначається дослідним шляхом.
Виходячи з математичного виразу першого закону термодинаміки:
dq = dU + dl;
q = U2 – U1 + l, (2.3.)
і враховуючи, що в ізохорному процесі l=0, отримаємо:
q = U2 – U1? , (2.4.)
де: U2 і U1 – внутрішня енергія тіла 1 і 2.
З
рівняння (2.5.) витікає, що вся зовнішня
робота витрачається тільки на змі-ну
внутрішньої енергії тіла. При постійній
теплоємності U1=CV![]() ,
a
U2=CV
,
a
U2=CV![]() ;
тобто:
;
тобто:
q = U2 – U1=CV(t2-t1) . (2.5.)
При змінній теплоємності:
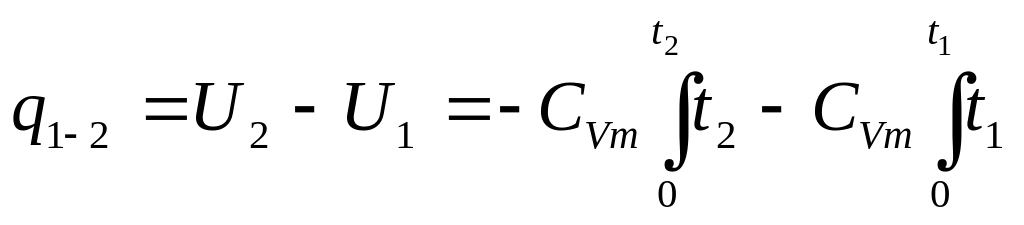 .
.
Якщо ізохорний процес здійснюється з підводом теплоти, то в ході процесу тиск і внутрішня енергія збільшуються і навпаки.
Зміну ентропії в оборотному ізохорному процесі визначають з рівняння:

S2
– S1
=![]() ,
(2.6.)
,
(2.6.)
тобто: V = сonst, то ln (V2/V1)=0 та в кінцевому результаті маємо:
S2
– S1
=![]() (2.7.)
(2.7.)
Визначивши з табличних даних значення CV, легко визначити значення ΔS = S2 – S1 при зміні експериментального параметру Р. Формули 2.5, 2.6, 2.7, дозволяють визначити параметри стану газу, віднесені до 1кмоль, 1 м3 або 1 кг в залежності від того, яке значення CV вибираємо з табличних значень.
За даними, наведеними в таблиці, зображуємо спостерігаємий нами ізохорний процес на Т - S діаграмі.
Висновки: згідно теорії ізохори, побудовані для різних об'ємів газу, вміщеного в колби різної ємності, повинні бути зміщені одна відносно іншої на відстань, яка визначається з рівняння:
Sп
– S3=
![]() .
.
При
Т=
сonst:
ΔS=
Sп
– S3=![]() .
.
Чим більший об'єм газу, тим далі ізохора від вісі ординат. Зображений на Т - S діаграмі ізохорний процес підтверджує відомі теоретичні відомості.
Таблиця експериментальних і розрахункових параметрів газу при ізохорній зміні його стану
№ з/п |
Δh, мм. вод. ст. |
Р=В+ +9,8Δh Па |
t, оС |
Т2=273+ + t,оС |
Р/Т |
V0=RТ/Ρ |
l=V· ·(Ρ2-Ρ1) |
q=CV · ·(t2-t1) |
S2-S1= CV· ·ln(T2/T1)- CVln(P2/P1) |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
Питання:
Дати визначення ізотермічному процесу.
Закон Шарля.
Розповісти схему лабораторної установки.
Пояснити ізотермічний процес.
Розповісти послідовність виконання експерименту.
