
- •Методичні вказівки
- •Загальні вказівки до проведення та оформлення студентами лабораторних робіт
- •Лабораторна робота № 1 Методи та засоби вимірювання термодинамічних параметрів. Похибки вимірювань та їх оцінка
- •Формули визначення похибки
- •Засоби вимірювання температури
- •Засоби вимірювання тиску
- •Засоби вимірювання швидкостей і витрат рідин
- •Похибки вимірювань і їх оцінка
- •Лабораторна робота № 2 дослідження процесу, що протікає при постійному об'ємі
- •Опис лабораторної установки
- •Підготовка лабораторної установки до роботи
- •Робота з установкою
- •Теоретичні відомості та обробка результатів досліджень
- •Лабораторна робота №3 Дослідження процесу, що протікає при постійній температурі
- •Робота з установкою
- •Етапи роботи
- •Теоретичні відомості і обробка результатів досліджень
- •Лабораторна робота №4 Дослідження процесу, який протікає при постійному тиску
- •Теоретичні відомості і обробка результатів досліджень
- •Лабораторна робота № 5 Експериментальна перевірка закону стану ідеального газу
- •Короткі теоретичні відомості
- •Порядок проведення експериментальних досліджень
- •Обробка результатів досліджень
- •Лабораторна робота № 6 Визначення теплоти пароутворення
- •Основні поняття і визначення
- •Опис лабораторної установки
- •Порядок проведення роботи
- •Лабораторна робота № 7 Визначення залежності температури насичення від тиску
- •Опис лабораторної установки
- •Порядок проведення роботи
- •Лабораторна робота № 8 Визначення показників адіабати
- •Методика експериментального визначення показника адіабати
- •Порядок проведення досліду
- •Лабораторна робота № 9 визначення ізобарної теплоємності повітря
- •Теоретичні основи
- •Опис дослідної установки
- •Методика проведення і обробка результатів вимірювань
- •Лабораторна робота №10 визначення питомої теплоємності речовини
- •Коротка теорія
- •Опис установки
- •Порядок виконання і етапу роботи
- •Облік теплоти, яка йде на нагрівання калориметра
- •Облік теплових витрат
- •Порядок виконання II етану роботи
- •Порядок роботи
- •Результати вимірювань і розрахунків шуканих величин
- •Коротка теорія
- •Опис установки
- •Порядок виконання роботи
- •(Титульний лист)
- •Лабораторна робота №...
- •II. Коротка теорія
- •III. Таблиця вимірів і розрахунку величин, що визначаються
- •Параметри стану
- •Співвідношення між різними одиницями вимірювання тиску
- •Співвідношення між одиницями роботи і тепла
- •Література:
Результати вимірювань і розрахунків шуканих величин
Таблиця 10.1.
№, з/п |
т, кг |
т1,кг |
ω,кг |
ω1,кг |
t,0С |
t1,0С |
Q,0С |
Q1,0С |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
Таблиця 10.1. (продовження)
Q0Х, 0С |
Q10Х, 0С |
τ, с |
І, А |
U, В |
СХ,
|
∆СХ, |
|
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
Питання:
Поняття теплоємності речовини.
Що таке питома теплоємність речовини.
Як визначити теплоємність досліджуваної речовини.
Розповісти схему лабораторної установки.
Розповісти послідовність експерименту.
ЛАБОРАТОРНА РОБОТА № 11
Визначення коефіцієнта внутрішнього тертя, середньої довжини
вільного пробігу та ефективного діаметру молекул повітря методом витоку через капіляр
Прилади і матеріали : лабораторна установка, секундомір.
Вступ
Коефіцієнт внутрішнього тертя визначає дійсний (необоротний) процес витоку газу із отвору.
Витік - це процес течії газу (рідини) із простору з тиском Р1 у простір з меншим тиском Р2, який відбувається через канали спеціального профілю (отвір, трубку або сопло).
Внутрішнє тертя виникає між струминками газу, який рухається, а зміна тиску газу визначається середньою довжиною вільного пробігу молекул газу, яка обернено пропорційна тиску.
Процеси витоку хімічно однорідних газів можуть оцінюватися також за величиною „ефективних" діаметрів молекул.
За знайденими із досліду значеннями коефіцієнта внутрішнього тертя, середньою довжиною пробігу і ефективними діаметрами молекул можна визначити інші параметри робочого тіла (коефіцієнти: теплопровідності, дифузії та інші.)
Тому метою даної роботи є визначення вище названих параметрів.
Коротка теорія
Використовуючи рівняння Клапейрона-Мендєлєєва можна встановити, що зменшення тиску в посудині на величину dp відповідає збільшенню маси, що витікає, на dm , тобто:
![]() ,
(11.1.)
,
(11.1.)
де:
μ
-
молекулярна маса газу;
R
=8,31![]() - універсальна
газова постійна;
- універсальна
газова постійна;
V- об'єм посудини; Т- абсолютна температура.
Цю ж масу можна виразити за формулою:
![]() ,
(11.2.)
,
(11.2.)
де: w - швидкість газу (рідини), що витікає; s - переріз потоку; dτ - час витоку.
Розподіл швидкості витоку газу по перерізу капіляра визначається виразом:
![]() ,
(11.3.)
,
(11.3.)
де: Р-Ро - різниця тисків на вході і виході капіляра, довжина якого l і внутрішній радіус r0; η – коефіцієнт внутрішнього тертя (коефіцієнт в'яз-кості) газу.
Підставивши
у формулу (11.2.) і проінтегрувавши її по
d
від
0
до r0,
вра-ховуючи, що
![]() густину
газу визначимо із
рівняння Мендєлєєва-Клапейрона:
густину
газу визначимо із
рівняння Мендєлєєва-Клапейрона:
![]() ,
,
де Р' - середній тиск у капілярі, який дорівнює півсумі тисків на кінцях капі-ляра:
![]() .
.
Тоді (11.2.) запишеться у вигляді:
![]() .
(11.2’.)
.
(11.2’.)
Порівнюючи вираз (11.2’.) до формули (11.1.) отримаємо:
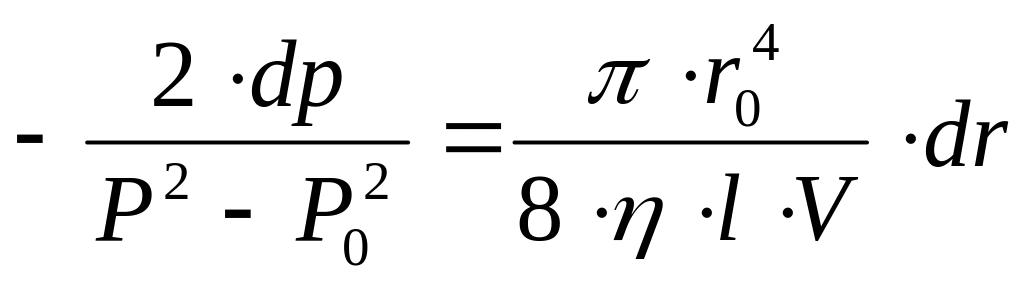 .
.
Проінтегрувавши
ліву і праву частини відповідно - по dр
від
Р1,
яке
відповідає моменту
0, до Р2,
яке відповідає τ і по dτ
від
моменту часу 0 до τ, в результаті отримаємо:
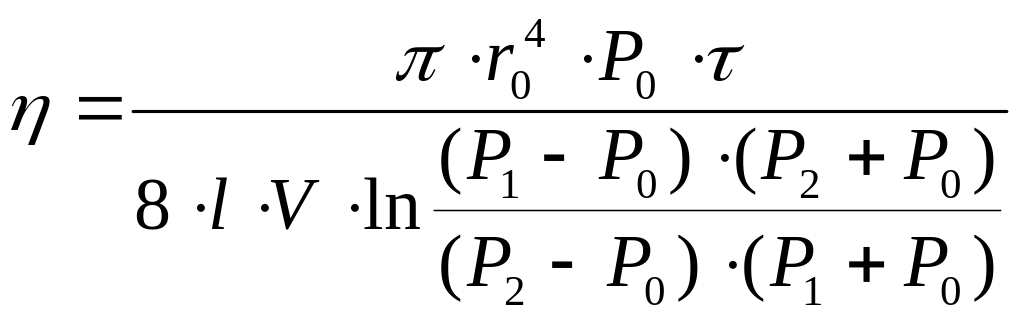 . (11.4.)
. (11.4.)
У даній роботі тиски в посудині Р1 і Р2 не дуже відрізняються від зов-нішнього атмосферного тиску Р0, тому:
![]() .
.
Змінюючи
відношення
![]() відношенням різниць рівнів h1/h2
рідини у манометрі на початку і в кінці
проміжку часу τ, в кінцевому результаті
отримаємо:
відношенням різниць рівнів h1/h2
рідини у манометрі на початку і в кінці
проміжку часу τ, в кінцевому результаті
отримаємо:
![]() .
(11.5.)
.
(11.5.)
Із кінетичної теорії газів:
![]() ,
,
де:
![]() -
середня довжина вільного пробігу
молекул;
-
середня довжина вільного пробігу
молекул;
![]() -
середня ариф-метична швидкість молекул
газу.
-
середня ариф-метична швидкість молекул
газу.
Густину газу (р) виразимо через рівняння стану, після перетворення отримаємо:
![]() .
.
Середня довжина вільного пробігу пов’язана з ефективним діаметром молекули σ співвідношенням:
![]() ,
,
де
![]() Дж/К - постійна Больцмана, тоді:
Дж/К - постійна Больцмана, тоді:
![]() .
(11.6.)
.
(11.6.)
За дослідними даними визначаються:
Коефіцієнт дифузії:
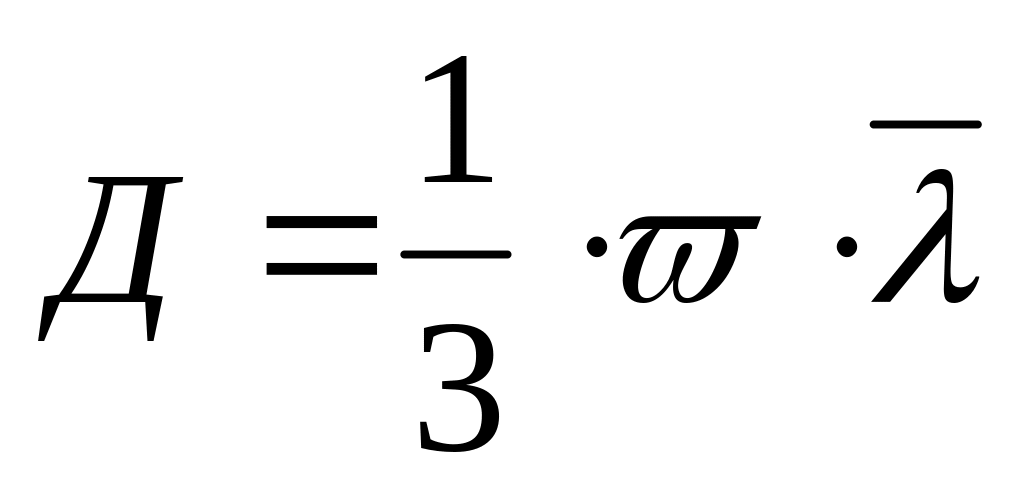 ;
;Густина газу:
![]() .
(11.7.)
.
(11.7.)
Коефіцієнт теплоємності і в’язкості:
![]() ,
(11.8.)
,
(11.8.)
для повітря і = 6;
![]() ,
(11.9.)
,
(11.9.)
де і
– число ступенів свободи; NА=![]() 1/кмоль – число Авогадро.
1/кмоль – число Авогадро.
Питома теплоємність газу в ізохоричному процесі:
![]() .
(11.10.)
.
(11.10.)
Середнє число зіткнень молекул:
![]() .
(11.11.)
.
(11.11.)
6) Відносна швидкість руху молекул, число молекул в одиниці об’єму газу:
![]() .
(11.12.)
.
(11.12.)
7) Маса однієї молекули:
![]() .
(11.13.)
.
(11.13.)
8) Середня квадратична швидкість молекули:
![]() ;
(11.14.)
;
(11.14.)
![]() ,
(11.15.)
,
(11.15.)
де μ – відносна молекулярна маса повітря, μ=28,96 кг/моль.
9) Внутрішня енергія одного моля газу:
![]() .
(11.16.)
.
(11.16.)
10)
Кінематична в’язкість:
![]() .
(11.17.)
.
(11.17.)
