
- •Часть 2
- •Оглавление
- •Предисловие
- •В добрый путь и удачи!
- •Глава 3 электричество и магнетизм
- •Электростатика
- •Электрическое поле
- •Закон Кулона
- •Напряженность
- •Работа электростатического поля
- •Связь напряженности и разности потенциалов
- •Электроемкость
- •Энергия электростатического поля
- •Постоянный ток
- •Электрическая цепь. Законы Кирхгофа
- •Законы Ома
- •Соединение проводников
- •Работа и мощность тока
- •Закон Джоуля – Ленца
- •Ток в металлах
- •Работа выхода
- •Контакт металл – металл
- •Ток в жидкостях
- •Некоторые источники тока
- •Ток в газах
- •Ток в вакууме
- •Ток в полупроводниках
- •Контакт полупроводник – полупроводник
- •Электромагнетизм
- •Закон Био – Савара – Лапласа
- •Сила Лоренца
- •Сила Ампера
- •Взаимодействие параллельных токов
- •Рамка с током в магнитном поле
- •Магнитный поток
- •Магнетики
- •Электромагнитная индукция
- •Правило Ленца
- •Самоиндукция
- •Принцип работы генератора
- •Цепь переменного тока
- •Ответы на вопросы по главе 3
- •Глава 4 колебания и волны
- •Колебания
- •Характеристики и виды колебательных процессов
- •Пружинный маятник
- •Физический маятник
- •Колебательный контур
- •Энергия незатухающих гармонических колебаний
- •Сложение колебаний
- •Вынужденные колебания
- •Движение связанных систем
- •Упругие волны
- •Плоская волна
- •Энергия упругой волны
- •Электромагнитные волны
- •Шкала электромагнитных волн
- •Ответы на вопросы по главе 4
- •Итоговые задания
- •Часть 2
- •346500, Г. Шахты, Ростовская обл., ул. Шевченко, 147.
-
Некоторые источники тока
Зная механизм электрического тока в жидкости, можно понять работу химических источников тока.
Рассмотрим работу гальванического элемента Вольта14 (рис. 3.18).
В
электролитической ванне находится
сильный электролит – водный раствор
серной кислоты определенной концентрации.
В такую электролитическую ванну помещают
нейтральную цинковую пластину. Она
начинает растворятся, и при растворении
заряжается отрицательно относительно
раствора, так как в раствор переходят
ионы Zn+
+ (каждый ион
цинка оставляет два «своих» электрона
некомпенсированными). Стремление цинка
растворяться характеризуется его
упругостью
растворения,
которая измеряется количеством ионов,
у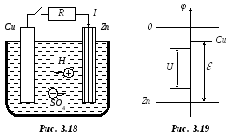 ходящих
в раствор с единицы поверхности за
единицу времени, и практически не
меняется при работе элемента.
ходящих
в раствор с единицы поверхности за
единицу времени, и практически не
меняется при работе элемента.
Под действием возникшего электрического поля начинается обратный процесс осаждения ионов цинка на пластине, скорость которого зависит от разности потенциалов раствора и цинка и постепенно возрастает. При достижении совершенно определенной разности потенциалов раствора и цинка (рис. 3.19; за нуль принят потенциал раствора) скорости обоих процессов станут равными, наступит динамическое равновесие, пластина перестанет растворяться, а разность потенциалов – расти. Говорят: упругость растворения уравновешена разностью потенциалов.
Эту разность потенциалов трудно использовать. Нужно поместить в ту же электролитическую ванну второй электрод. Но если он тоже будет цинковым, с ним произойдет тот же процесс, возникнет такая же разность потенциалов раствора и электрода. Разности потенциалов между электродами не будет. Значит, второй электрод надо взять не цинковым, его упругость растворения должна быть далека от упругости растворения цинка. Вольт выбрал второй электрод из меди. Медная пластинка, помещенная в раствор серной кислоты, тоже начинает растворяться и заряжается отрицательно относительно раствора. Возникшая разность потенциалов тоже препятствует растворению, и наступает динамическое равновесие, пластинка перестает растворяться; ее упругость растворения уравновесилась разность потенциалов.
Но
упругость растворения меди мала, она
быстро уравновешивается получающейся
разностью потенциалов, и пластинка
почти не растворяется. Иначе, равновесие
достигается при малом отрицательном
потенциале меди (рис. 3.19). Следовательно,
за счет работы химических сил получена
разность потенциалов медного и цинкового
электродов, т.е. полюсов разомкнутого
источника, другими словами, э.д.с.
источника
![]() .
.
Мы показали, как создается разность потенциалов. Рассмотрим, как она поддерживается. Замкнем электроды на какой-либо потребитель тока. По внешней цепи пойдет ток от медного к цинковому электроду (от плюса к минусу, а медный электрод хотя заряжен отрицательно относительно раствора, но имеет положительный заряд относительно цинка). При этом электроны по внешней цепи уходят от цинка к меди. Потенциал цинка повышается, динамическое равновесие нарушается, разность потенциалов раствора и цинка уменьшается и не уравновешивает теперь упругость растворения цинка. Цинковая пластинка снова начинает растворяться, каждый уходящий в раствор ион оставляет лишними на пластине два электрона. Пришедшие электроны понижают потенциал меди, динамическое равновесие нарушается, разность потенциалов раствора и меди увеличивается.
В предыдущем подразделе мы рассмотрели электролиз серной кислоты в электролитической ванне (см. рис. 3.17), к электродам которой подведено напряжение от внешнего источника. Ток через раствор протекал от положительного электрода к отрицательному, т.е. справа налево, и естественно, положительные ионы двигались в ту же сторону, получали недостающие им электроны на левом электроде и становились нейтральными. Аналогично, отрицательные ионы двигались направо и отдавали свои лишние электроны правому электроду.
При работе гальванического элемента через электролитическую ванну тоже справа налево идет ток. Значит, происходит процесс электролиза серной кислоты, в результате которого на левом (медном) электроде положительные ионы Н+ получают недостающие электроны, а на правом (цинковом) электроде отрицательные ионы отдают свои лишние электроны. Следовательно, электроны, отданные кислотным остатком, участвуют в токе, а избыточные электроны с медной пластины уходят на положительные ионы водорода.
Итак, положительные ионы водорода притягиваются к положительному (!) полюсу элемента, получают на нем недостающий электрон и превращаются в атомарный водород. Потенциал медной пластины поэтому перестает уменьшаться. Потенциал цинковой пластины перестает увеличиваться благодаря растворению цинка. Между электродами сохраняется, т.е. поддерживается, определенная разность потенциалов U (рис. 3.17), которая, конечно, меньше э.д.с.
В результате вторичных реакций при электролизе на цинковой пластине выделяется атомарный кислород, на медной – атомарный водород. Затем эти атомы могут соединятся по два в молекулы соответствующих газов.
Но атомарные водород и кислород могут не только соединятся в молекулы; они могут и «растворяться», т.е. уходить в раствор в виде положительных (Н+) и отрицательных (О ) ионов. При таком процессе каждый уходящий в раствор ион водорода оставляет «свой» электрон на положительном электроде источника; соответственно каждый «растворяющийся» атом кислорода забирает два электрона с отрицательного электрода источника. Образуется новый элемент с газовыми электродами – положительным (кислород) и отрицательным (водород). Его э.д.с. (обычно ее называют противо-э.д.с.) уменьшает э.д.с. источника, происходит поляризация гальванического элемента – уменьшение его э.д.с. вследствие появления газового элемента.
Для уменьшения поляризации можно время от времени вынимать электроды (достаточно один медный) и счищать газовый столб. Это механическая деполяризация.
Удобно добавить в раствор какое-либо соединение, богатое кислородом и не взаимодействующее с раствором и электродами источника (например, Mn2O7) – деполяризатор. В момент «рождения» водород очень активен химически и, соединяясь с кислородом деполяризатора, связывается в воду и не образует газового электрода. Такие гальванические элементы называются неполяризующимися.
Аккумуляторы предназначены для накопления электроэнергии.
Ч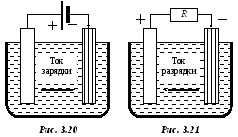 тобы
стать источниками тока, они должны быть
предварительно заряжены. Рассмотрим
работу свинцового или кислотного
аккумулятора. В электролитическую ванну
с раствором серной кислоты погружены
два одинаковых свинцовых электрода
(точнее, покрытых окисью свинца, рис.
3.20). Каждый из них растворяется (и
заряжается отрицательно, см. работу
элемента Вольта) до тех пор, пока его
упругость растворения не будет
уравновешена разностью потенциалов
между ним и раствором. При этом оба
электрода имеют одинаковые
потенциалы. Присоединим к ним внешний
источник тока и пустим через аккумулятор
ток зарядки, который вызовет электролиз
серной кислоты. В результате электролиза
(и его вторичных реакций) на положительном
электроде выделится
кислород, а на отрицательном – водород.
Кислород вызовет окисление:
тобы
стать источниками тока, они должны быть
предварительно заряжены. Рассмотрим
работу свинцового или кислотного
аккумулятора. В электролитическую ванну
с раствором серной кислоты погружены
два одинаковых свинцовых электрода
(точнее, покрытых окисью свинца, рис.
3.20). Каждый из них растворяется (и
заряжается отрицательно, см. работу
элемента Вольта) до тех пор, пока его
упругость растворения не будет
уравновешена разностью потенциалов
между ним и раствором. При этом оба
электрода имеют одинаковые
потенциалы. Присоединим к ним внешний
источник тока и пустим через аккумулятор
ток зарядки, который вызовет электролиз
серной кислоты. В результате электролиза
(и его вторичных реакций) на положительном
электроде выделится
кислород, а на отрицательном – водород.
Кислород вызовет окисление:
Pb O + O Pb O2;
водород – восстановление:
Pb O + 2H Pb + H2O;
Итак, в результате зарядки электроды стали разными, их упругости растворения и, следовательно, разности потенциалов с раствором различны; появилась разность потенциалов электродов.
Аккумулятор стал источником тока. Отключим заряжавший источник и вместо него включим нагрузку (рис. 3.21). Пойдет ток разрядки в обратном направлении, при этом полярность аккумулятора не изменится.
При разрядке химические реакции на электродах идут в обратную сторону. Доводить их до конца не рекомендуется, после того как э.д.с. упадет до 1,9 В, следует аккумулятор подзарядить.
Емкостью аккумулятора называется количество электричества, которое от него можно получить:
Q=It.
Ее выражают в ампер-часах. Например, от аккумулятора емкостью 60 А·ч можно получить ток силой 3 А в течении 20 ч или 0,5 А в течении 120 ч и т.д.
