
- •Часть 2
- •Оглавление
- •Предисловие
- •В добрый путь и удачи!
- •Глава 3 электричество и магнетизм
- •Электростатика
- •Электрическое поле
- •Закон Кулона
- •Напряженность
- •Работа электростатического поля
- •Связь напряженности и разности потенциалов
- •Электроемкость
- •Энергия электростатического поля
- •Постоянный ток
- •Электрическая цепь. Законы Кирхгофа
- •Законы Ома
- •Соединение проводников
- •Работа и мощность тока
- •Закон Джоуля – Ленца
- •Ток в металлах
- •Работа выхода
- •Контакт металл – металл
- •Ток в жидкостях
- •Некоторые источники тока
- •Ток в газах
- •Ток в вакууме
- •Ток в полупроводниках
- •Контакт полупроводник – полупроводник
- •Электромагнетизм
- •Закон Био – Савара – Лапласа
- •Сила Лоренца
- •Сила Ампера
- •Взаимодействие параллельных токов
- •Рамка с током в магнитном поле
- •Магнитный поток
- •Магнетики
- •Электромагнитная индукция
- •Правило Ленца
- •Самоиндукция
- •Принцип работы генератора
- •Цепь переменного тока
- •Ответы на вопросы по главе 3
- •Глава 4 колебания и волны
- •Колебания
- •Характеристики и виды колебательных процессов
- •Пружинный маятник
- •Физический маятник
- •Колебательный контур
- •Энергия незатухающих гармонических колебаний
- •Сложение колебаний
- •Вынужденные колебания
- •Движение связанных систем
- •Упругие волны
- •Плоская волна
- •Энергия упругой волны
- •Электромагнитные волны
- •Шкала электромагнитных волн
- •Ответы на вопросы по главе 4
- •Итоговые задания
- •Часть 2
- •346500, Г. Шахты, Ростовская обл., ул. Шевченко, 147.
-
Ток в жидкостях
Некоторые жидкости
являются проводниками второго рода11
– электролитами. Обычно это растворы
какого-то вещества в диэлектрике.
Полярные молекулы при растворении
распадаются на ионы – происходит
электрическая диссоциация. Если степень
диссоциации (процент распавшихся
молекул) высока, раствор представляет
собой сильный электролит. Поместим в
электролитическую ванну два электрода
(одинаковых и практически нерастворимых,
рис. 3.17), присоединенных к источнику
тока. Электрод, соединенный с положит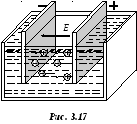 ельным
полюсом источника, называется анодом,
с отрицательным полюсом – катодом12.
Под действием электрического поля
положительные ионы начнут дрейфовать
к катоду, отрицательные – к аноду.
Следовательно, на хаотическое движение
будет наложено упорядоченное – потечет
ток. Движущиеся к катоду ионы (положительные)
называются катионами, к аноду
(отрицательные) – анионами. Дойдя
до электродов, анионы отдают лишние
электроны (которые по цепи источником
тока перегоняются к катоду), катионы
приобретают недостающие им электроны.
И катионы, и анионы становятся нейтральными
атомами или группами атомов. Промежуток
между электродами оказывается проводящим,
так как с катода электроны ушли (на
катионы), к аноду – пришли (с анионов).
Свободными зарядами в электролитах
являются ионы, ток в жидкостях представляет
собой их направленное движение.
Проводимость электролитов – ионная.
Температурный коэффициент сопротивления
жидкостей отрицателен – при повышении
температуры в среднем быстрее движутся
ионы, сопротивление уменьшается.
ельным
полюсом источника, называется анодом,
с отрицательным полюсом – катодом12.
Под действием электрического поля
положительные ионы начнут дрейфовать
к катоду, отрицательные – к аноду.
Следовательно, на хаотическое движение
будет наложено упорядоченное – потечет
ток. Движущиеся к катоду ионы (положительные)
называются катионами, к аноду
(отрицательные) – анионами. Дойдя
до электродов, анионы отдают лишние
электроны (которые по цепи источником
тока перегоняются к катоду), катионы
приобретают недостающие им электроны.
И катионы, и анионы становятся нейтральными
атомами или группами атомов. Промежуток
между электродами оказывается проводящим,
так как с катода электроны ушли (на
катионы), к аноду – пришли (с анионов).
Свободными зарядами в электролитах
являются ионы, ток в жидкостях представляет
собой их направленное движение.
Проводимость электролитов – ионная.
Температурный коэффициент сопротивления
жидкостей отрицателен – при повышении
температуры в среднем быстрее движутся
ионы, сопротивление уменьшается.
Кроме того, с ростом температуры обычно увеличивается коэффициент (степень) диссоциации и, следовательно, концентрация ионов. При заданной температуре электролит подчиняется закону Ома, т.е. сопротивление его постоянно (не зависит от напряжения). Лучшим доказательством правильности представлений об ионной проводимости электролитов является электролиз.
-
К
 ак
степень диссоциации зависит от
диэлектрической проницаемости
растворителя?
ак
степень диссоциации зависит от
диэлектрической проницаемости
растворителя?
Электролиз – это выделение свободных веществ на электродах при прохождении через раствор (расплав) электрического тока.
Пусть, например, в электролитической ванне находится сильный электролит – раствор серной кислоты в воде. Молекулы серной кислоты при растворении почти полностью диссоциировали: H2SO4 2H + +SO4 .
При прохождении электрического тока через раствор в результате электролиза на катоде выделяется атомарный водород, на аноде молекулы SO4. Далее начинаются вторичные реакции при электролизе: атомарный водород соединяется в молекулы: 2Н Н2 . Неустойчивые молекулы SO4 распадаются: SO4 SO3 + О. Атомы кислорода соединяются в молекулы 2О О2 . Молекулы SO3 взаимодействуют с водой, образовавшиеся молекулы серной кислоты диссоциируют: SO3 + H2O
H2SO4 2H+ + SO4 .
В результате вторичных реакций восстанавливается концентрация ионов в растворе, выделяются на электродах газы водорода и кислорода в пропорциях, в которых эти элементы входят в состав воды. Фактически происходит разложение воды на водород и кислород.
Законы Фарадея для электролиза были установлены экспериментально:
1. Масса вещества, выделившегося на электроде, прямо пропорциональна силе тока, прошедшего через электролит, и времени его прохождения: m = kQ = kIt.
Коэффициент пропорциональности k называется электрохимическим эквивалентом данного вещества.
2. электрохимические эквиваленты веществ пропорциональны их химическим эквивалентам13: k ~ x.
Отношение этих эквивалентов одинаково для всех веществ:
![]() .
.
Оба закона Фарадея для электролиза можно объединить:
![]() .
.
Пропустим
через раствор электролита количество
электричества
![]() .
Тогда на электроде выделится масса
вещества т=х (численно равная
химическому эквиваленту).
.
Тогда на электроде выделится масса
вещества т=х (численно равная
химическому эквиваленту).
Таким образом, постоянная Фарадея F численно равна заряду, который необходимо пропустить через электролит, чтобы на электродах выделить массу вещества, равную его химическому эквиваленту: F = 96484,56 Кл/моль. У одновалентных веществ химический эквивалент равен одному молю, т.е. содержит число атомов NA. Значит, измерив постоянную Фарадея, мы узнаем, какое количество электричества прошло через раствор, выделив на электроде NA одновалентных атомов. Следовательно, каждый атом получил или отдал при электролизе количества электричества
![]() Кл,
Кл,
что соответствует абсолютному значению заряда электрона. Если выделяющееся в процессе электрода вещество имеет валентность n, то его химический эквивалент равен А/n и имеет число атомов NA/n. Значит, каждый атом получил или отдал заряд nF/NA=ne, т.е. кратное е количества электричества. Мы приходим к представлению об ионе как о частице, у которой по той или другой причине есть избыток или недостаток электронов. Избавившись от лишних или получив недостающие электроны на электродах, ион становиться нейтральной группой атомов. Этот процесс мы и назвали электролизом.
-
О
 бъясните
физический смысл первого закона Фарадея
для электролиза?
бъясните
физический смысл первого закона Фарадея
для электролиза?
