- •1. Аминокислоты, Протеиногенные ак, классиф. Незаменимые и заменимые ак. Редкие ак.
- •16.Пищеварительные гликозидазы
- •10. Трансферазы, биол. Роль, п/Кл, представители.
- •14.Лигазы
- •17.Пищеварительные липолитические ферменты
- •12.Лиазы
- •13.Изомеразы и мутазы
- •19. Тканевые протеолитические ферменты
- •5. Простые б. Классификация, биол роль, представители
- •6.Сложные белки (протеиды)
- •21. Жирные кислоты. Ненас и нас жк, представ., биол.Роль, незаменимые жк
- •Насыщенные жирные кислоты
- •Ненасыщенные жирные кислоты
- •8. Ф. ,строение, номенклатура, классификация, ф-х св-ва, различ. И сходство ф и неорг. Кат.
- •7.Нуклеиновые кислоты. Днк, рнк, сост., стр., св-ва
- •Дезоксирибонуклеиновая кислота, состав, строение, функции
- •Рибонуклеиновая кислота (рнк)
- •23. Воски, биол. Роль. Стерины, биол роль.
- •18.Физико-химические свойства ферментов
- •22.Простые липиды (многокомпонентные)
- •9. Оксидоредуктазы, биол.Роль, п/Кл., представители.
- •58. Энзимопатии
- •56. Амилаза. Биол.Роль, применение в энзимодиагностике.
- •55. Креатинкиназа, роль в энзимодиагностике.
- •54. Аспартатаминотрансфераза, значение в энзимодиагностике.
- •53. Аланинаминотрансфераза, значение в энзимодиагностике.
- •52. Лактатдегидрогеназа, роль в энзимодиагностике.
- •51.Обмен липидов. Переваривание и всасывание липидов в желудочно-кишечном тракте. Липолитические пищеварительные ферменты. Желчные кислоты, представители, биологическая роль.
- •Переваривание и всасывание
- •Переваривание холестерина
- •Всасывание
- •50. Обмен аминокислот в тканях.
- •Гидролитическое дезаминирование:
- •4.Окислительное дезаминирование:
- •49.Обмен белков.
- •46.Обмен углеводов. Переваривание и всасывание углеводов в пищеварительном тракте. Пищеварительные амилолитические ферменты.
- •45.Дыхательная цепь, компоненты, биологическая роль.
- •Итоговая реакция, которая происходит на цитохромоксидазе, имеет вид
- •39.Гормоны щитовидной железы и паращитовидных желез.
- •40.Гормоны тимуса, эпифиза, поджелудочной железы.
- •43. Минеральные вещества
- •38. Гормоны надпочечников и половых желез.
- •36.Макроэргические соединения
- •47.Схема анаэробного распада углеводов. Ферменты анаэробного распада.
- •44. Цикл Кребса, биологическая роль, основные реакции. Ферменты цикла Кребса.
- •27.Полисахариды стр. Св-ва, предст., биол.Роль. Распр. В природе.
- •42.Вода
- •31. Фолиевая кислота, биотин
- •35. Витаминоподобные вещества предст, биол. Роль, антивитамины, биол.Роль.
- •33.Жирараств вит е и f.
- •34. Жирораств. Вит к и q
- •32. Жиросрастворимые вит а и д.
- •30.Вит с, р. Стр. Св-ва симптомы недост, нормы потребл, биол ф-ии
- •29.Водораств вит. В5, в6,в12 стр. Св-ва симптомы недост, нормы потребл, биол ф-ии
- •25.Углеводы, классиф, биол. Ф-ии, Моносах, представ, структ, св-ва.
- •24. Сложные липиды (липоиды) классифик., строение, биол. Роль
- •20. Липиды, классиф., биол.Ф-ии, Липидные мономеры. Формулы рационального питания для липидных компонентов.
- •11.Гидролазы, биол. Роль, п/Кл, представители.
- •15.Пищеварительные ферменты
- •28.Витамины класс., биол. Роль,. Водораств вит в1 в2 в3, стр. Св-ва симптомы недост, нормы потребл, биол ф-ии
49.Обмен белков.
Переваривание и всасывание белков.
Белки – обязательный компонент сбалансированного пищевого рациона.
Главными источниками белков для организма являются пищевые продукты растительного и животного происхождения. Переваривание белков в организме происходит с участием протеолитических ферментов желудочно-кишечного тракта. Протеолиз – гидролиз белков. Протеолитические ферменты – ферменты, осуществляющие гидролиз белков. Данные ферменты подразделяются на две группы – экзопепетидазы, катализирующие разрыв концевой пептидной связи с освобождением одной какой-либо концевой аминокислоты, и эндопептидазы, катализирующие гидролиз пептидных связей внутри полипептидной цепи.
В ротовой полости расщепления белков не происходит из-за отсутствия протеолитических ферментов. В желудке имеются все условия для переваривания белков. Протеолитические ферменты желудка – пепсин, гастриксин – проявляют максимальную каталитическую активность в сильно кислой среде. Кислая среда создается желудочным соком (рН = 1,0–1,5), который вырабатывается обкладочными клетками слизистой оболочки желудка и в качестве основного компонента содержит соляную кислоту. Под действием соляной кислоты желудочного сока происходит частичная денатурация белка, набухание белков, что приводит к распаду его третичной структуры. Кроме того, соляная кислота переводит неактивный профермент пепсиноген (вырабатывается в главных клетках слизистой оболочки желудка) в активный пепсин. Поступление пищевого белка в желудок стимулирует секрецию гормона гастрина, который в свою очередь стимулирует секрецию соляной кислоты и пепсиногена в клетках слизистой оболочки желудка. Пепсин катализирует гидролиз пептидных связей, образованных остатками ароматических и дикарбоновых аминокислот (оптимум рН = 1,5–2,5). Слабее проявляется протеолитическое действие пепсина на белки соединительной ткани (коллаген, эластин). Не расщепляются пепсином протамины, гистоны, мукопротеины и кератины (белки шерсти и волос).
По мере переваривания белковой пищи с образованием продуктов гидролиза щелочного характера рН желудочного сока изменяется до 4,0. С уменьшением кислотности желудочного сока проявляется деятельность другого протеолитического фермента – гастриксина (оптимум рН= 3,5–4,5).
В желудочном соке детей обнаружен химозин (реннин), расщепляющий казеиноген молока.
Дальнейшее переваривание полипептидов (образовавшихся в желудке) и нерасщепившихся белков пищи осуществляется в тонком кишечнике под действием ферментов панкреатического и кишечного соков. Отделение панкреатического и кишечного соков регулируется нейрогормонами секретином и холецистокинином. Секретин регулирует секрецию и отделение поджелудочного сока, богатого бикарбонатами и участвующего в нейтрализации соляной кислоты, поступившей с пищевым комком из желудка. Холецистокинин регулирует секрецию поджелудочного сока, богатого ферментами. Протеолитические ферменты (трипсин, химотрипсин) синтезируются в поджелудочной железе и поступают в тонкий кишечник с панкреатическим соком. Оба фермента наиболее активны в слабощелочной среде (7,8–8,2), что соответствует рН тонкого кишечника. Профермент трипсина – трипсиноген, активатор – энтерокиназа (вырабатывается стенками кишечника) или ранее образованный трипсин. Трипсин гидролизует пептидные связи, образованные аргинином и лизином. Профермент химотрипсина – химотрипсиноген, активатор – трипсин. Химотрипсин расщепляет пептидные связи между ароматическими аминокислотами, а также связи, которые не были гидролизованы трипсином.
Благодаря гидролитическому действию на белки эндопептидаз (пепсин, трипсин, химотрипсин) образуются пептиды различной длины и некоторое количество свободных аминокислот. Дальнейший гидролиз пептидов до свободных аминокислот осуществляется под влиянием группы ферментов – экзопептидаз. Одни из них – карбоксипептидазы – синтезируются в поджелудочной железе в виде прокарбоксипептидазы, активируются трипсином в кишечнике, отщепляют аминокислоты с С-конца пептида; другие – аминопептидазы – синтезируются в клетках слизистой оболочки кишечника, активируются трипсином, отщепляют аминокислоты с N – конца.
О![]()
![]() ставшиеся
низкомолекулярные пептиды (2–4
аминокислотных остатка) расщепляются
тетра-, три- и дипептидазами в клетках
слизистой оболочки кишечника. Всасывание
продуктов распада белков.Транспорт
аминокислот через клеточные мембраны
Продукты гидролиза белков всасываются
в пищеварительном тракте в основном в
виде свободных аминокислот (САК) с
участием ионов Nа+,
поступают в
кровь и
далее в различные органы и ткани, где
подвергаются различным превращениям.
Различная
скорость проникновения аминокислот
через мембраны клеток, установленная
при помощи метода меченых атомов,
свидетельствует о существовании в
организме 5
и более специфических транспортных
систем, каждая из которых функционирует
при переносе определенной группы близких
по строению аминокислот: 1) нейтральных
с небольшой боковой цепью, 2) нейтральных
с объемной боковой цепью, 3) основных,
4) кислых, 5) пролина.
Пути
использования
аминокислот в организме.
Существуют
многообразные пути использования
аминокислот после всасывания в кишечнике.
Поступив через воротную
вену в печень, они прежде всего подвергаются
ряду превращений (хотя
значительная часть аминокислот разносится
кровью по вceму
организму
и используется для физиологических
целей). В
печени аминокислоты
участвуют не только в биосинтезе
собственных белков и белков плазмы
крови, но также в синтезе специфических
азотсодержащих соединений: пуриновых
и пиримидиновых нуклеотидов, креатина,
мочевой кислоты, НАД и др. Печень, кроме
того, обеспечивает сбалансированный
фонд свободных аминокислот организма
(около 30 г). Источниками свободных
аминокислот организма служат пищевые
белки, белки собственных тканей, а также
синтез аминокислот из углеводов.
ставшиеся
низкомолекулярные пептиды (2–4
аминокислотных остатка) расщепляются
тетра-, три- и дипептидазами в клетках
слизистой оболочки кишечника. Всасывание
продуктов распада белков.Транспорт
аминокислот через клеточные мембраны
Продукты гидролиза белков всасываются
в пищеварительном тракте в основном в
виде свободных аминокислот (САК) с
участием ионов Nа+,
поступают в
кровь и
далее в различные органы и ткани, где
подвергаются различным превращениям.
Различная
скорость проникновения аминокислот
через мембраны клеток, установленная
при помощи метода меченых атомов,
свидетельствует о существовании в
организме 5
и более специфических транспортных
систем, каждая из которых функционирует
при переносе определенной группы близких
по строению аминокислот: 1) нейтральных
с небольшой боковой цепью, 2) нейтральных
с объемной боковой цепью, 3) основных,
4) кислых, 5) пролина.
Пути
использования
аминокислот в организме.
Существуют
многообразные пути использования
аминокислот после всасывания в кишечнике.
Поступив через воротную
вену в печень, они прежде всего подвергаются
ряду превращений (хотя
значительная часть аминокислот разносится
кровью по вceму
организму
и используется для физиологических
целей). В
печени аминокислоты
участвуют не только в биосинтезе
собственных белков и белков плазмы
крови, но также в синтезе специфических
азотсодержащих соединений: пуриновых
и пиримидиновых нуклеотидов, креатина,
мочевой кислоты, НАД и др. Печень, кроме
того, обеспечивает сбалансированный
фонд свободных аминокислот организма
(около 30 г). Источниками свободных
аминокислот организма служат пищевые
белки, белки собственных тканей, а также
синтез аминокислот из углеводов.
При обычном питании энергетическая роль аминокислот невелика (обеспечивают около 10 % суточной потребности), однако она может быть существенной при преимущественно белковом питании, а также при голодании.
48.Схемы прямого и непрямого аэробного распада углеводов. Ферменты аэробного распада.
Аэробный распад глюкозы
Данный путь превращения углеводов является основным при обеспечении организма энергией. Протекает непрямым (дихотомическим) или прямым (апотомическим) путями.
Аэробный непрямой распад глюкозы протекает в тканях, богатых кислородом (мозг, легкие). В результате такого распада глюкоза полностью распадается до СО2 и Н2О (с выделением большого количества энергии):
С6Н2О6 + 6О2 6СО2 + 6Н2О + энергия.
Процесс окисления глюкозы происходит в три этапа:
1. Распад глюкозы до пировиноградной кислоты (ПВК).
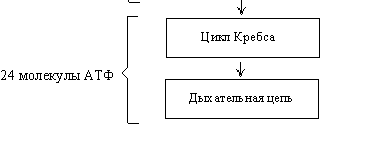
2. Превращение ПВК в ацетил-КоА (СН3СО – SКоА) в цикле Кребса.
3. Дыхательная цепь.
Промежуточные продукты анаэробного и аэробного непрямого распада до стадии образования ПВК идентичны.
Для аэробного непрямого распада характерно образование ацетил-КоА из пирувата по схеме
Пируват + НАД + КоА Ацетил-КоА + СО2 + НАДН.
Реакция катализируется пируватдегидрогеназным комплексом. Далее ацетил-КоА включается в цикл Кребса. Энергетический баланс – 38 молекул АТФ.
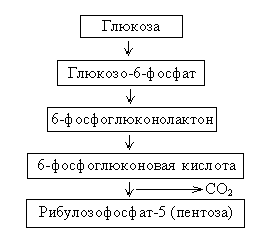
Аэробный прямой распад глюкозы является апотомическим. В нем имеет место прямое окисление молекулы глюкозы без предварительного ее расщепления на две триозы. Этот распад называется пентозным циклом, так как при прямом окислении глюкозы образуется пентоза и выделяется СО2. Такое окисление углеводов называется гексозомонофосфатным.
Прямой распад характерен для тканей, в которых происходит интенсивный синтез жирных кислот и ароматических липидов (молочная железа, надпочечники, жировая ткань и печень). Гексозомонофосфатный распад "поставляет" пентозы для биосинтеза нуклеиновых кислот.
Схема аэробного непрямого распада
Э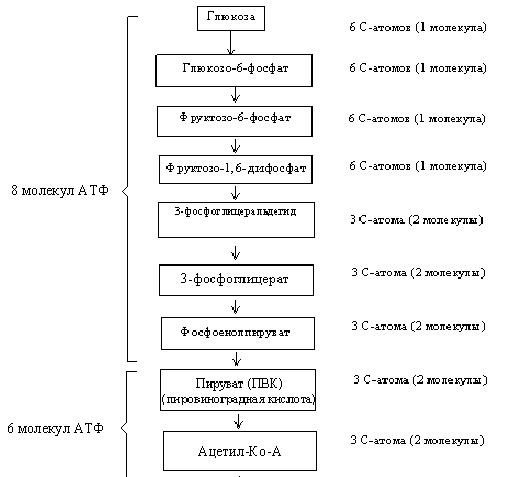
 нергетический
баланс – 38 молекул АТФ.
нергетический
баланс – 38 молекул АТФ.
Схема пентозного распада
Энергетический выход – 36 молекул АТФ.
Пентозный путь характерен для эритроцитов, лактирующей молочной железы, коркового вещества надпочечников, половых желез.